
塩基とはプロトンを受け入れる分子で、酸とはプロトンを放出する分子を指します。 このため、アンモニアは、その窒素原子がプロトンを受け入れやすい電子対を持っているため、塩基性とみなされます。 しかし、アンモニアは水溶液中で完全にイオンに分解されない化合物である弱塩基に分類される。 分子がバラバラになってイオンになることを解離といいます。 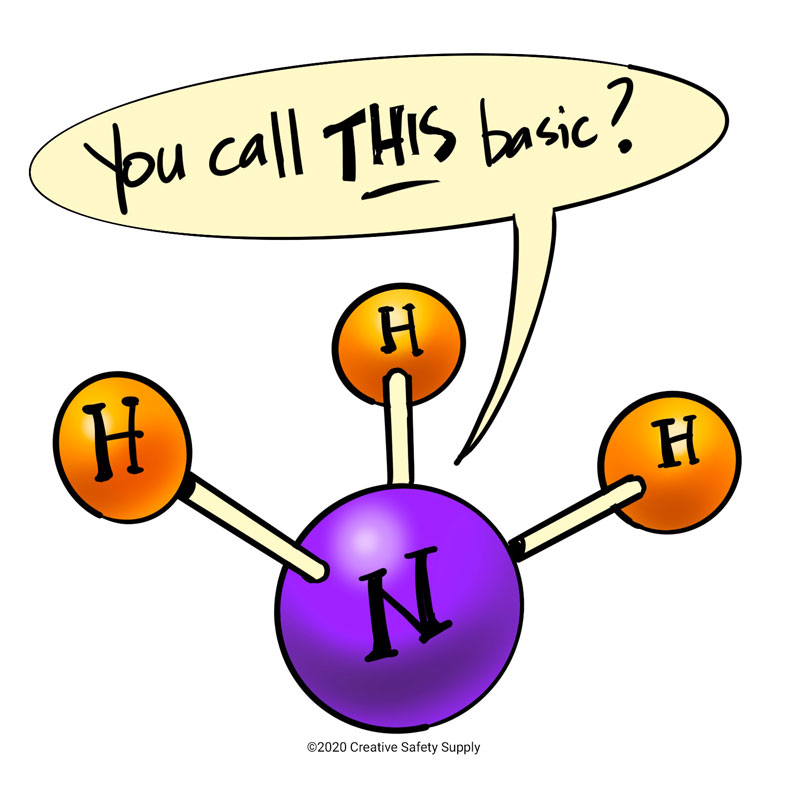
アンモニアはもともと水酸化物イオンを含まないが、水に溶かすと水から水素イオンを得て、水酸化物とアンモニウムイオンを生成する。 しかし、アンモニアは溶液中では水酸化物イオンとアンモニウムイオンに完全に変化しないため、弱塩基とみなされます。 分解すると、正電荷のアンモニウムイオン(NH4+)と負電荷の水酸化物イオン(OH-)になりますが、アンモニア分子の一部はまだ結合したままです。 すべての分子が分解されたわけではないので、解離は不完全とみなされ、ごく一部のアンモニア分子から水酸化物イオンが実際に生成されたことになる。 反応性、酸化性、または腐食性については記述していません。 強塩基は強酸と同じように苛性で危険なものである。 例えば、無水アンモニアはpH11.6ですが、塩酸(pH0)が腐食するように、粘膜、皮膚、目にひどい刺激を与え、化学熱傷を引き起こします
。