学習目標
- 気体の特徴を説明できる。
物質の3つの共通の相(または状態)は気体、液体、固体です。 気体は3つのうち最も密度が低く、非常に圧縮性が高く、置かれた容器を完全に満たす。 気体は分子間力が比較的弱いため、他の分子とは無関係に常に動いているため、このような振る舞いをする。 一方、固体は分子間力が非常に強く、分子がその場に固定されているため、比較的密で剛性が高く、非圧縮性である。 液体は、固体と同じように密度が高く、圧縮されないが、気体のように容器の形に合わせて容易に流動する。 したがって、液体の分子間力の総和は、気体と固体の分子間力の中間にあると結論づけることができる。 図10.1.1に3つの状態を比較し、分子レベルでの違いを示します。
図10.1.1 固体、液体、気体の2原子物質(O2)
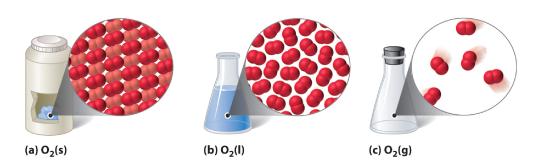
(a)固体のO2には一定の体積と形状があって、分子はぴったりと集まっている。 (b)液体O2は容器の形状に従うが体積は一定で、分子が比較的密に詰まった状態である。 (c)気体のO2は容器の大きさや形に関係なく、完全に容器を満たしており、大きく離れた分子で構成されている
ある物質の状態は、条件によって強く左右される。 たとえば、H2Oは、固体の氷、液体の水、水蒸気(気体)の3つの状態すべてで見られるのが普通である。 私たちは、水を飲んだり、料理したり、お風呂に入ったりと、生命維持に欠かせない液体として、ほとんどの環境で水と出会っています。 また、気温が低くなって液体が氷になると、その上をスキーやスケートで滑ったり、雪玉や雪だるまに詰めたり、氷で住居を作ったりすることができる。 水蒸気気体と蒸気の区別は微妙で、通常の条件下(25℃、1.0気圧)では液体または固体である物質が、気体になったものを蒸気という。 窒素(N2)や酸素(O2)は気体ですが、大気中の気体である水は水蒸気と呼ばれ、私たちが呼吸する空気の成分であり、料理やコーヒー・お茶を入れるために水を温めると発生します。 100℃以上の水蒸気は水蒸気と呼ばれます。 蒸気は、発電用のタービンなど大きな機械を動かすのに使われます。 水の3つの状態の性質を表10.1.1
原子、イオン、分子の幾何構造および物理・化学的性質は、通常その物理的状態に依存せず、たとえば氷、液体水、水蒸気の個々の水分子はすべて同一である。 これに対して、物質の巨視的な性質は、分子間力と温度や圧力などの条件によって決まる物理状態に強く依存する。
図10.1.2に、気体、液体、固体状態でよく見られる元素の周期表での位置を示す。 水素を除き、天然に気体として存在する元素は、周期表の右側にある。 このうち、希ガス(第18族)はすべて単原子ガスであるが、他の気体元素は2原子分子(H2、N2、O2、F2、Cl2)である。 酸素は第2の同素体である反応性の高い3原子分子オゾン(O3)を形成することもあり、これも気体である。 一方、臭素(Br2として)と水銀(Hg)は、通常の条件下(25℃、1.0気圧、一般に「室温・圧力」と呼ばれる)では液体である。 29.76℃で溶けるガリウム(Ga)は、容器を手に持ったり、夏の暑い日に冷房のない部屋に置いておくだけで液体になる。 1076>
図 10.1.2 25℃、1気圧で気体、液体、固体として自然に存在する元素
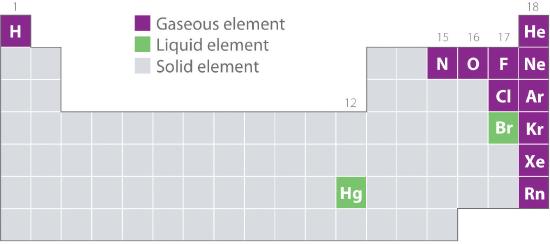
希ガスと水銀は単原子の種として存在するが、他のすべてのガスと臭素は2原子分子である。
これまでに出会った元素や化合物の多くは、一般に気体として存在します;より一般的なものを表 10.1.2 に挙げました。 ガス状物質には、ハロゲン化水素(HX)などの多くの二元水素化物、カルコゲンの水素化物、15族元素のN、P、Asの水素化物、14族元素のC、Si、Geの水素化物、ジボラン(B2H6)などがあります。 また、非金属の単純な共有結合酸化物の多くは、CO, CO2, NO, NO2, SO2, SO3, ClO2 などの気体である。 低分子有機化合物も気体である。炭素原子数が4以下の炭化水素や、ジメチルエーテル、塩化メチル(CH3Cl)、ホルムアルデヒド(CH2O)、アセトアルデヒド(CH3CHO)といった単純な分子も気体である。 また、冷媒であるクロロフルオロカーボン(CFC)やハイドロクロロフルオロカーボン(HCFC)は、圧縮することで容易に液化し、液体を減圧することで気体にすることができる気体である。 冷蔵庫内のチューブで液体から気体に相変化することで冷却し、冷蔵庫の底や背面にあるコイルで圧縮することで室内を暖めることができるのです。 圧縮性のある気体としては、他にアンモニアやSO2が冷媒として使われてきたが、毒性があるため家屋内では使用することができない。 アンモニアは効率がよく安価なため、今でも大型商業施設では冷媒として使われています。
先に述べた気体物質(単原子希ガス以外)はすべて共有結合または極性共有結合を持ち、非極性または極性の分子である。 一方、NaBr(沸点=1390℃)やLiF(沸点=1673℃)のようなイオン性化合物は、強い静電引力により、室温・圧力下では気体として存在することができない。 また、一般に極性化合物の沸点は、分子量の近い非極性化合物の沸点より高く、化合物群の中で最も軽いものは気体である可能性が高い。 したがって、一連の化合物の中で、最も軽く、最も極性の低いものが気体である可能性が高い。
パターンに注目
ガス状物質はしばしば共有結合または極性共有結合を含み、非極性またはわずかに極性の分子として存在し、分子量が比較的低く、1または2期の原子が5つ以下であることがある。
気体にはさまざまな用途があるが、気体物質の特に厳しい使い方は、紀元3世紀にペルシャ人が東シリアのローマ都市ドゥーラに採用したとされるものである。 ペルシャ人は城壁の下にトンネルを掘り、この都市に侵入して征服した。 考古学的な証拠によると、ローマ軍が包囲を阻止するために対抗トンネルで応戦すると、ペルシャ軍はアスファルトと硫黄の結晶に点火して濃い毒ガスを発生させたという。 鞴(ふいご)か煙突で有毒ガスを拡散させたと思われる。 高さ2m、長さ11m弱のトンネルの入り口である城壁の下から、約20人のローマ兵の遺骨が発見された。 ペルシャ人がこのような狭い空間の入り口でこれほど多くのローマ人を虐殺したとはとても考えられないので、考古学者は古代ペルシャ人が化学兵器を使って都市征服に成功したと推測しています。
例 10.1.1
室温と圧力で気体だと予測できる化合物はどれか。
- シクロヘキセン
- 炭酸リチウム
- シクロブタン
- 酸化三バナジウム
- 安息香酸(C6H5CO2H)
与えられたものです。 compounds
A Asked for: physical state
Strategy:
A それぞれの化合物がイオン性か共有性かを決定する。 イオン性化合物は室温・圧力下で固体である可能性が高く、共有結合性化合物は固体、液体、気体のいずれでもよい。
B 共有結合性化合物のうち、比較的非極性で分子量の小さいものは、室温・圧力下で気体である可能性が最も高い。
解答:
A 炭酸リチウムはLi2CO3で、Li+とCO32-イオンを含み、酸化バナジウム(III)はV2O3で、V3+とO2-イオンを含んでいます。 どちらも主にイオン性の化合物で、固体になることが予想されます。 残りの3つの化合物はすべて共有結合である。
B 安息香酸は炭素原子が4個以上あり極性があるので、気体である可能性はないだろう。 シクロヘキセンもシクロブタンも基本的に非極性分子ですが、シクロブタン(C4H8)はシクロヘキセン(C6H10)より分子量がかなり低く、やはり炭素原子が4個以上あるためです。 そのため、シクロブタンは常温常圧で気体である可能性が高く、シクロヘキセンは液体であると予測される。 実際、沸点はシクロヘキセンの83℃に対して12℃しかなく、シクロブタンは常温常圧で確かに気体である。
練習問題
室温常圧で気体と予測する化合物はどれか。
- n-ブタノール
- フッ化アンモニウム(NH4F)
- ClF
-
酸化エチレン
- HClO4
答えなさい。 c; d
まとめ
バルク物質は気体、液体、固体の3つの状態で存在することができます。 気体は3つの中で最も密度が低く、非常に圧縮性が高く、容器を完全に満たす。 常温常圧で気体として存在する元素は、周期表の右側に集まっており、単原子ガス(希ガス)または2原子分子(一部のハロゲン、N2、O2)として存在する。 また、水素以外の原子が4個以下の無機・有機化合物の多くも、室温・圧力下では気体である。 すべての気体物質は、構成分子または原子間の弱い相互作用によって特徴づけられる。
Key Takeaway
- 気体物質の分子はしばしば共有結合または極性共有結合を含み、非極性分子またはわずかに極性分子であり、比較的低い分子量を持っています。
Conceptual Problems
-
物質の微視的性質と巨視的性質の違いについて説明しなさい。 化合物の沸点はミクロな性質かマクロな性質か? 分子量か?
-
融点、双極子モーメント、電気伝導度は物質のマクロな性質かミクロな性質かを判断し、その理由を説明せよ。
-
物質のミクロ的性質はマクロ的性質にどう影響するか? 分子量と沸点を関連づけることができるか。 その理由またはそうでない理由を教えてください。
-
気相、液相、固相を持つ物質について、これらの相を
- 密度の大きい順、
- 分子間相互作用の強い順に並べよ。
- 圧縮性.
- 分子運動.
- 分子または原子の配置の順序.
-
この文章のどこが間違っているかを説明しなさい。 “The state of matter largely determines the molecular properties of a substance.”
-
与えられた化合物の状態を決定する最も重要な要因を説明しなさい。
-
周期表のどの元素が室温と圧力で気体として存在するか? このうち、2原子分子であるものと単原子であるものはどれか。 室温、常圧で液体である元素はどれか。 周期表のどの部分に、二元水素化物が室温で気体である可能性が最も高い元素が含まれているか。
-
以下の観察は正しいか。 “非金属の二元水素化物はほとんどすべて室温で気体であるが、金属水素化物はすべて固体である。” 理由を説明せよ。
-
以下の観察は正しいか? “カルコゲンの水素化物は、酸素の二元水素化物以外は常温常圧で気体であり、液体である。” その根拠を説明せよ。 1-クロロプロパンは気体でしょうか? ヨードプロパンでしょうか? その理由は?
-
イオン化合物が通常の条件下で気体でない理由を説明しなさい。
答え
-
-
-
-
物質の分子特性は、与えられた条件の下でその物質の状態を制御します。 その逆ではありません。 分子間力が強いと凝縮状態(液体または固体)になり、分子間相互作用が非常に弱いと気体状態になります。 さらに、分子の形状によって、凝縮相が液体か固体かが決まる。
-
-
気体として存在する元素は主に周期表の右上と右側に存在する。 気体として存在する元素は次の通りである。 H、He、N、O、F、Ne、Cl、Ar、Kr、Xe、Rnである。 したがって、ハロゲンの半分、希ガスのすべて、そして最も軽いカルコゲンとピクノゲンが気体である。 このうち、希ガス以外はすべて2原子分子として存在する。 20℃〜25℃の常温で液体として存在するのは、水銀と臭素の2元素だけである。 また、周期表の右上には、二元水素化物が気体である元素のほとんどが含まれている。 さらに、14~16族の元素の二元水素化物は気体である。
-
-