2型糖尿病が発見されるまでに、多くの人が5年から10年の高血糖状態にあり、その時点ですでに微小・大血管障害性合併症の証拠があることを確認するデータがある。 例えば、Harrisらの研究によると、網膜症は糖尿病と診断される数年前から存在することが分かっています。 研究者らは、米国とオーストラリアの独立した2つの集団において、糖尿病の期間と関連した網膜症の有病率を調べました。 糖尿病診断時の網膜症有病率は、米国グループ20.8%、オーストラリアグループ9.9%であった。 網膜症の有病率と糖尿病罹病期間の間に線形関係があることから、研究者らは、横軸に網膜症発症がゼロになる時期までデータを外挿した。 この分析に基づき、糖尿病は診断前に米国グループで6.5年、オーストラリアグループで4.2年存在していたと推定される。

歴史的背景
糖尿病の症状はおよそ3500年前から知られていましたが、病気に対する正確な知識と適切な臨床治療が確立されたのは前世紀に入ってからのことです。 1921年にインスリンが単離され、1型糖尿病の重要な治療薬となり、2型糖尿病では経口薬で十分なコントロールができない場合に使用されるようになった。
インスリンの発見により、糖尿病には、β細胞のほとんどが破壊され、診断時からインスリンに依存する自己免疫疾患の1型糖尿病と、インスリン抵抗性が高まり、膵β細胞がそれを補うだけのインスリンを分泌できない2型糖尿病があると認識されるようになりました。
1956年、2型糖尿病のコントロールにスルホニル尿素のトルブタミドが最初の経口血糖降下剤として使用され、その後、長時間作用型のスルホニル尿素のグリベンクラミドやメトホルムなどのビグアニジンが上市されました。
有病率
多くの発展途上国と新興工業国では、糖尿病は流行の比率に達しています。 1995年、全世界で1億1800万人の成人が糖尿病と診断され、2010年には2億2000万人の患者に増加すると予想されています。 この劇的な増加は、長寿と将来の社会で予想される肥満と運動不足のレベルに関連した原因による2型糖尿病が原因である。 2型糖尿病は、通常、人生の後半に診断されますが、最近の報告では、若年層に影響を与えていることが示されています。
2型糖尿病は、スペインで200万人に影響を与えている深刻かつ共通の問題ですが、診断を受けているのはその半数のみです。
糖尿病患者の総有病率は5.5%と推定され、そのうち46%は男性、51%は女性となっています。 2型糖尿病は高齢者に多く、年間人口1万人あたり15~30人の患者がいると推定されています。
病因と診断
2型糖尿病は、標的組織のインスリン抵抗性と膵臓β細胞の機能異常という2つの主要代謝異常によって特徴づけられ、進行性の機能障害と高血糖をもたらし、高価な長期微小血管および大血管の合併症を引き起こすとされています。
2型糖尿病の個人的・経済的負担の軽減、持続的な血糖コントロール、合併症予防のための疾患進行の遅延
2型糖尿病は通常40歳以降に診断され、ゆっくりと陰湿に発症する進行性の代謝異常症です。 非糖尿病患者においては、インスリンなどの糖代謝に関わる循環代謝ホルモンと、インスリンのシグナル変換やグルコースの取り込み・排出に関わる細胞内タンパク質との相互作用により、正常な血糖値が維持されています。 このプロセスの標的臓器は、肝臓、骨格筋、脂肪組織で、いずれも血糖値を比較的一定の値に保つために極めて重要である。 内因性インスリンは膵臓のβ細胞から分泌され、細胞膜内に存在する特定の細胞受容体を介して作用します。 3552>
2型糖尿病は、インスリン抵抗性の増加と進行性のβ細胞機能障害という2つの病態生理学的欠陥の組み合わせによって特徴づけられます。
2型糖尿病では、グルコースの重要な利用部位(脂肪組織、肝臓、骨格筋)が、通常の循環血中濃度のインスリンに対して生物学的反応に障害を示します。 このインスリン抵抗性は、高血糖や2型糖尿病の発症につながる欠陥である。 このインスリン抵抗性を克服するために、膵臓のβ細胞はインスリン分泌を代償的に増加させ(高インスリン血症)、血糖値は安定したままである。 しかし、遺伝的素因のある人では、膵臓のβ細胞が、悪化したインスリン抵抗性を補うだけのインスリン分泌を無制限に維持することができず、相対的にインスリン不足となり、グルコースの増加や耐糖能異常の原因となるのです。 インスリン抵抗性の維持に膵臓β細胞の機能低下が加わり、さらなるインスリン不足と高血糖の悪化を招き、2型糖尿病の進行につながります。

血糖コントロール
インスリン抵抗性は、第3のミレニアムにおいて我々が直面する最大の健康脅威の一つです。
厳しい血糖コントロールは、微小血管合併症のリスク軽減につながることが確認されました。 このことは、1型糖尿病におけるDCCT(Diabetes Control and Complications Trial)、UKPDS(United Kingdom Prospective Diabetes Study)、2型糖尿病における日本の熊本試験の長期成績が証明しています。 3552>
最近の経口糖尿病薬やインスリン製剤の登場は、より良い血糖コントロールを実現するための大きな進歩であり、血糖測定技術の進歩により患者の自己測定が可能になり、インスリン投与システムにより治療へのアドヒアランスが促進されている。
2型糖尿病は、自覚症状がないため「軽い病気」と誤解されていますが、合併症を引き起こすため、75%の患者さんが早死にする可能性があると言われています。
この疾患による主な合併症は、脳卒中、神経障害、末梢血管疾患、網膜症、心血管疾患、腎症です。
2型糖尿病の理想的な治療法は、疾患の根本原因となるインスリン抵抗性とβ細胞機能不全に向けられ、疾患コントロールに大きく貢献するものであるべきです。 理想的な治療法は、インスリン抵抗性を低下させ、β細胞機能を維持することにより、血糖コントロールを維持し、微小血管合併症を減少させることです。 このような治療により、2型糖尿病の進行を遅らせ、患者さんや医療制度への影響を軽減することができます。

治療の選択肢
糖尿病患者さんの治療全体の目標は、低血糖のリスクを高めずにできるだけ低い血糖値を実現することです。
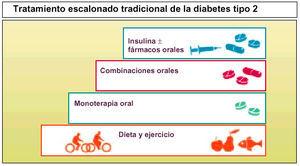
2型糖尿病の初期治療は、通常、食事管理、体重減少、運動が中心となりますが、長期的には十分ではありません。
2型糖尿病患者の管理方法は段階的な戦略で、まず経口薬物療法を行い、通常、非肥満患者にはメトホルミンやスルホニル尿素を使用します。
経口単独療法が十分でない場合は、経口配合剤を使用し、これらの薬剤が耐えられない場合は、インスリンによる非経口治療を開始すべきである。
スルホニル尿素
スペインでは最も処方されている経口抗糖尿病薬である。 スルフォニル尿素は、膵臓のβ細胞からのインスリン分泌を促進することにより、標的細胞でのグルコースの取り込みを促進するために、追加のインスリンを供給します。
β細胞の劣化は病気の自然の進行の一部であるため、インスリン不足を治療するだけでは、いつまでも刺激を維持できません。 50〜60%の患者はスルフォニル尿素に初期反応を示すが、それにもかかわらず、二次的な病勢コントロール不能が7%の頻度で発生する。 スルフォニル尿素の効かない原因はβ細胞の機能低下にあるとされており、β細胞の機能低下を促進する可能性すら認められているため、β細胞の機能が著しく低下している患者には適さず、肥満の患者にも適さない薬剤である。
スルホニルウレア剤で治療した患者の20~30%が低血糖を起こすことが分かっている。
メトホルミン
ビグアニジンクラスに属す。 3552>
本剤は、他の薬剤に比べ体重増加が少ないため、一般に肥満患者に投与される。
メトホルミンは、患者の20~30%に消化器系の望ましくない作用をもたらし、腎機能障害、心不全、心筋梗塞、呼吸不全、肝不全では禁忌である。
アカルボースは、アルファグルコシダーゼ阻害剤で、腸内で複合糖質の加水分解速度を遅らせ、その結果、吸収速度を遅くする作用を持っています。 インスリン分泌やインスリン抵抗性には直接作用しない。 アカルボースは他の経口糖尿病薬と比較して効果が限定的である。
経口併用療法
併用療法は、より高いコントロールが必要となった時点で開始する必要がある。 スペインでは経口糖尿病薬の併用は少なく、スルホニル尿素とα-グルコシダーゼ阻害剤の併用が最も多く、次いでスルホニル尿素とメトホルミンの併用が多い。
ロシグリタゾン
インスリン抵抗性を改善しβ膵細胞機能を維持し持続的に血糖コントロールを良好にする新薬です。 本薬は、2型糖尿病の進行を遅らせ、最終的には糖尿病に関連する合併症を減少させることが期待されます。 また、安全性プロファイルが良好で、忍容性が高く、薬物相互作用もほとんどありません。
1日1回の投与であるため、治療へのアドヒアランスに貢献します。 つまり、ロシグリタゾンは2型糖尿病治療の基本的なニーズを満たしている。
ロシグリタゾンは安全性プロファイルが良好で、忍容性が高く、薬物間相互作用もほとんどない。