細胞にはたくさんの水が含まれています。 水の役割の1つは、さまざまな物質を溶かすことです。 例えば、細胞内にはさまざまなイオン性化合物(塩)が存在します。 イオンは細胞の電位を維持するために使われ、細胞のシグナル伝達や筋肉の収縮に重要です。
ある化合物がイオン性か共有性かは、どのようにして見分けるのでしょうか?
この質問に対する答えは、単純なものではありません。 多くの結合はその中間にあります。 極性共有結合では、2つの原子の間で1組の電子が共有され、その八分値を満たしますが、電子は結合の一方の端に他方よりも近いところに位置しています。
異なる原子の電気陰性度の値を見ることで、結合中の一対の電子がどの程度均等に共有されているかを判断することができます。 周期表の右上に行くほど電気陰性度が高くなるのは、核電荷と遮蔽要因の組み合わせによるものです。 周期表の右上にある原子は共有結合電子に対する引力が強く、左下にある原子は共有結合電子に対する引力が弱い。
炭素-酸素結合では、周期表で炭素の右側にある酸素に多くの電子が引き寄せられるだろう。 ジメチルエーテル(CH3OCH3)のような化合物は、少し極性があります。 ホルムアルデヒド(CH2O)はさらに極性が強い。 量子力学的な理由から、π結合の電子はシグマ結合の電子よりも緩やかに保持されています。

周期表をちらっと見ただけでは、すべての極性を簡単に決められるわけではないのです。 ホウ素-水素結合の双極子の向きは、ホウ素は右側にあるが水素は上側にあるので、電気陰性度の値を調べないと予測するのは難しいだろう。
原子の電気陰性度の差が、一方の原子がもう一方の原子から電子を完全に引き離すことができるほど大きい場合、結合はイオン性である。 そのような状況は、周期表の左端の元素 (ナトリウム、カリウム、カルシウムなど) と周期表の極端な右上の元素 (最も一般的には酸素、フッ素、塩素) を組み合わせた化合物によく見られます。 塩化ナトリウムはイオン化合物である。
多くの結合は、ある状況では共有結合であり、別の状況ではイオン結合であることがある。 たとえば、塩化水素(HCl)は気体では水素と塩素が共有結合していますが、HClを水中にバブリングすると完全に電離して塩酸溶液のH+とCl-が得られます。 気体の塩酸でも、電荷は均等に分布していない。
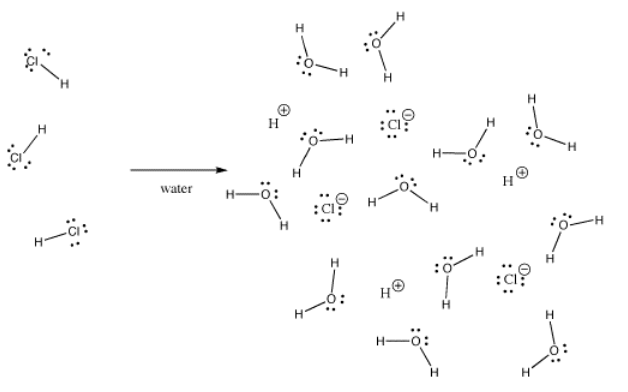
水酸化カリウム(KOH)は、共有結合(O-H)とイオン結合(K-O)を1つずつ持っています。 水素が厄介なのは、周期表の一番上と左側にあることです。 水素は、場合によってはイオン結合を形成するのに十分な電気陰性度を持っています。
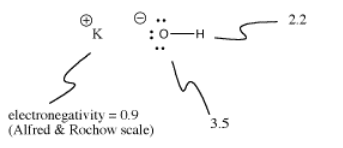
KOHでは、カリウムと酸素の電気陰性度の差が大きいので、K-O結合はイオン結合になります。 酸素と水素の電気陰性度の差は小さくない。 O-H結合はイオン化することもありますが、すべての場合ではありません。
イオン化は分子内で何が起こっているかに依存することがあります。 水酸化カリウムのK-O結合はイオン性であるため、O-H結合はあまりイオン化しません。 酸素にはすでに負の電荷があります。 電荷分離にはエネルギーが必要なので、O-H結合をイオン化して酸素に2つ目の負の電荷をつける方が難しいのです。 分子内の最初のイオン化は、2回目のイオン化よりはるかに簡単なことがよくあります。
演習 ୧⃛(๑⃙⃘◡̈︎๑⃙⃘)
次の組の原子間の結合の極性の向きを予測せよ。
a) 硫黄-酸素 b) ケイ素-フッ素
c) 水素-ナトリウム d) 塩素-アルミニウム
Answer
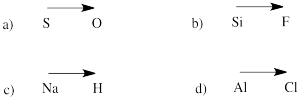
周期表の左端の元素は陽イオンとして存在することが非常に多いため、陽イオンとして存在するのは左端の元素であると考えられる。 また、右端の元素は負の電荷を帯びているため、それぞれの元素を含む化合物は少なくとも1つのイオン結合を持つと考えることができる場合が多い。
練習問題
以下の化合物の構造を描きなさい。 それぞれ少なくとも1つのアニオンとカチオンを含む。
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g)LiClO4h)NaClO3i)KNO2j) Ca(ClO2)2 k) Ca2SiO4 l)。 Na3PO3
m) NaOCl n) Mg2SnO4
Answer
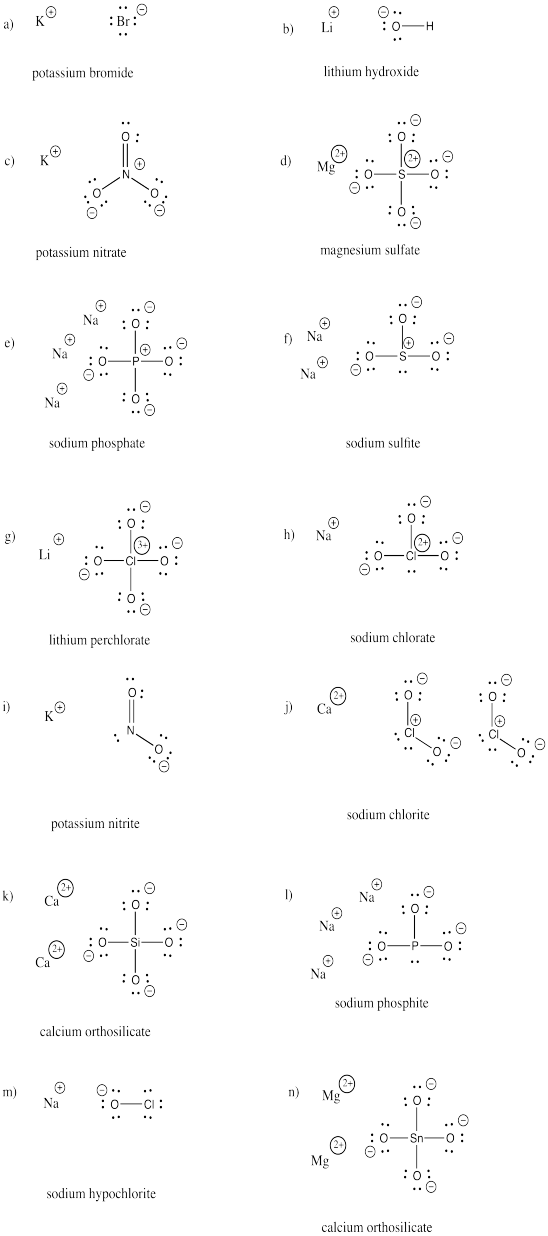
練習問題 \(\PageIndex{3})
アンモニウムイオン.Ammoniumは、アンモニウムの一種である。 NH4+は、一般的な分子イオンである。
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Answer
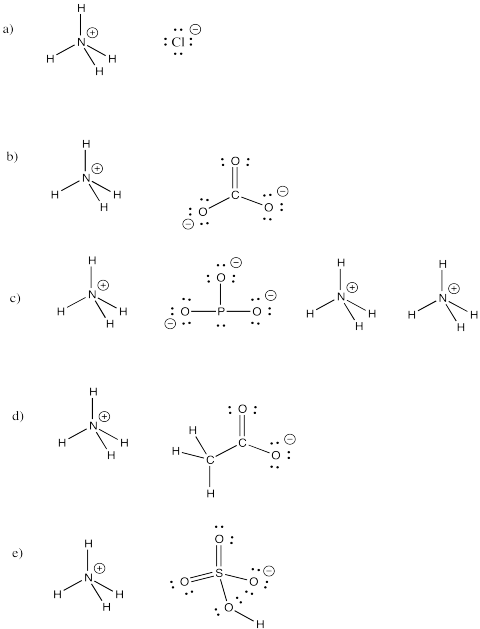
練習問題 \(\PageIndex{4})
多くのアニオンにはその構造について何かを伝える名前が付けられています。
| prefix- or -suffix |
共通の意味 |
名前の例 | 式の例 |
| -の例ide | atom is present as anion | chloride | Cl – |
| -ate | atom is present as oxyanion.This is anion as anion; 通常、一般的な形態 | chlorate | ClO3- |
| -ite | atom is present as an oxyanion, しかし、別の一般的な形態 | chlorite | ClO2- |
| per- | 原子より少ない酸素(または低い「酸化状態」)がオキシアニオンとして存在する。 しかし、「-ate」型よりもさらに多くのオキシゲンを持つ | perchlorate | ClO4- |
| hypo- | 原子がオキシアニオンとして存在する。 しかし、「-ite」型よりもさらに酸素数が少ない | hypochlorite | ClO- |
表を参考に、次のアニオンの名前を提案しなさい。
a) Br- b) O2- c) F- d) CO32-(一般的なオキシアニオン) e) NO3-(一般的なオキシアニオン) f) NO2-
g) S2- h) SO42-(一般的なオキシアニオン) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43-(一般的なオキシアニオン)o)。 PO33- p) I- q) IO3- (一般的なオキシアニオン) r) IO4-
Answer a)
bromide
Answer b)
oxide
Answer c)
fluoride
Answer d)
carbonate
Answer e)
nitrate
Answer f)
nitrite
Answer g)
sulfide
の答え。 回答 h)
sulfate
回答 i)
sulfite
回答 j)
persulfate
回答 k)
carbide
回答 l)
nitride
回答 m)
arsenide
回答 n)
phosphate
回答 o)
persulfate 回答 j)
persulfite 回答 n)
sulfate 回答 n)
sulfate 回答 n)
sulfatephosphite
Answer p)
iodide
Answer q)
iodate
Answer r)
periodate
帰属
Chris P Schaller, Ph.D, (College of Saint Benedict / Saint John’s University)