周期的傾向
まず、個々の原子に注目し、周期表での元素の位置に関連した傾向について考える。 最初のモデルとして、単純な有機化合物のエタン、メチルアミン、エタノールを使用しますが、この概念は、同じ機能性を持つより複雑な生体分子、例えばアミノ酸のアラニン(アルカン)、リジン(アミン)、セリン(アルコール)の側鎖にも同様に適用できます。
酸性と塩基性の水平方向の周期的傾向:
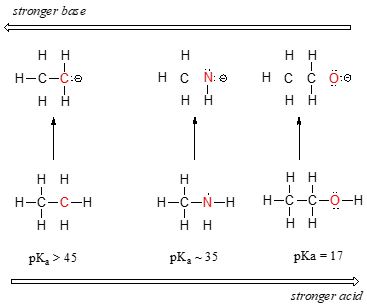
周期表の2行目に沿って左から右へ、炭素から窒素、酸素へと進むにつれて、酸性の傾向がはっきりと見て取れるようになる。 この傾向を理解する鍵は、それぞれのケースで仮想的な共役塩基を考えることです。共役塩基がより安定(弱い)であればあるほど、酸はより強くなるのです。 それぞれの共役塩基の負電荷の行き着く先を見てみよう。 エタンの共役塩基では、負の電荷は炭素原子が担っており、メチルアミンとエタノールの共役塩基では、負の電荷はそれぞれ窒素と酸素に位置していることがわかる。 つまり、酸素は3つの原子の中で最も電気陰性度が高く、炭素は最も電気陰性度が低いのです。
注
電気陰性度が高い原子ほど、負の電荷をよく帯びることができる。
したがって、メトキシドアニオンは3つの共役塩基の中で最も安定(最低エネルギー、最低塩基性)で、エチルカルバニオンアニオンは最も安定(最高エネルギー、最高塩基性)である。 逆に、エタノールは最も強い酸であり、エタンは最も弱い酸である。
周期表のある列の中を垂直に移動すると、再び酸性の明確な周期的傾向が観察される。 これはハロゲン酸とハロゲン化物で最もよくわかる。電気陰性度と同様に、塩基度は列が上がるにつれて高くなる。
酸性度と塩基度の垂直周期傾向:

逆に、ハロ酸の酸性度は列が下に行くほど増加する。
この傾向を理解するために、もう一度共役塩基の安定性を考えてみることにする。 フッ素は最も電気陰性度の高いハロゲン元素なので、フッ化物は最も塩基性の低いハロゲンイオンであると予想されるかもしれない。 しかし実際には、フッ化物は最も安定で、最も塩基性が高いのです。 周期表を縦に並べると、塩基性に関しては原子の大きさが電気陰性度に勝ることがわかる。 ヨウ素の原子半径はフッ素の約 2 倍であるため、ヨウ化物イオンでは、負の電荷はかなり大きな体積に広がります。

これは、有機化学における基本概念を示しています:
正または負の静電気は、大きな面積に「広がる」ときにより安定します。
この考え方は、有機反応性の研究を通じて、さまざまな文脈で何度も表現されることになります。 今のところ、塩基強度に対する原子半径の影響にのみ、この概念を適用しています。 フッ化物はハロゲン化物共役塩基の中で最も安定性が低い(最も塩基性が高い)ので、HFはハロゲン酸の中で最も酸性度が低く、カルボン酸よりわずかに強いだけである。 HIは-9程度で、硫酸とほぼ同じ強さである。
生物有機化学の研究にとってより重要なことは、この傾向が、チオールがアルコールよりも酸性であることを教えてくれることである。 例えば、システイン側鎖のチオール基のpKは約8.3、セリン側鎖のアルコール基のpKは17のオーダーである
6.2節で紹介した「駆動力」という概念を覚えているだろうか。 反応の駆動力は通常、相対的な電荷の安定性と相対的な全結合エネルギーの2つの要素に基づいていることを思い出してください。 これが塩酸とフッ化物イオンの単純な酸塩基反応にどう適用されるか見てみましょう:
HCl (\(pK_a) -7) は HF (\(pK_a) 3.2)なので、反応の平衡は生成物側にある。反応は発熱性で、「駆動力」が反応物を生成物に押しやるのである。 先程学んだように、塩化物イオン(生成物側)はフッ化物イオン(反応物側)よりも安定である。 このことは、この反応における反応物から生成物への駆動力を部分的に説明します:私たちは安定性の低いイオンからより安定性の高いイオンへと移動します。
駆動力のもう一つの要因である結合エネルギーはどうでしょうか。 結合エネルギーの表を見ると、生成物側のH-F結合は反応物側のH-Cl結合よりエネルギーが高い(強い)ことがわかります(それぞれ570 kJ/mol vs 432 kJ/mol)。 このことも駆動力の一因となって、弱い(安定性の低い)結合から強い(安定性の高い)結合に移行しているのです
。