Introduction
慢性腎臓病(CKD)は世界中で非常に広く蔓延しています。 中国では、10人に1人近くが何らかの腎機能障害を持ち、合計で約1億5千万人の患者がいます(1)。 貧血と二次性副甲状腺機能亢進症は、CKDに関連する最も一般的な2つの合併症です(2、3)。 実際、進行したCKD(ステージ4および5に分類されるCKD)患者の90%近くが貧血に苦しんでいると報告されています(4)。 また、貧血の発症や重症度は、糸球体濾過量の低下とよく相関していることが示されています(4)。
二次性副甲状腺機能亢進症は、血清副甲状腺ホルモン(PTH)濃度の上昇を特徴とします。 過剰なPTHは、赤血球前駆細胞に対する直接的な毒性作用と、骨髄線維化の誘導による間接的な作用によって、赤血球生成に障害を与える可能性があります(5, 6)。 また、尿毒症患者におけるヘモグロビン濃度の低下は、高PTH濃度による赤血球の浸透圧脆化作用の亢進に起因している可能性があります(7)。 PTHとヘモグロビン濃度との間には逆相関が成立している(8-10)。 Meytesらは、尿毒症患者の血清PTH濃度に匹敵する7.5-30 U/mL以内のPTH濃度が、マウス骨髄培養におけるBFU-Eの成長を著しく阻害することを見出し、尿毒症貧血の発生に過剰PTHが関与する経路があることを示唆した(11)。
赤血球造血刺激因子製剤(ESA)はCKD患者の貧血治療の特徴となっており、中国では>95%の使用率で、透析患者に最もよく処方される薬剤となっています(1)。 最初の遺伝子組換えヒトエリスロポエチン製剤であるエポエチンアルファは、1988年に米国で認可されました(12)。 エポエチンアルファとエポエチンベータは短時間作用型で費用対効果の高い治療薬であり、大多数のCKD患者に週1~3回投与されている。 しかし、目標ヘモグロビン値を達成または維持するためには、投与間隔が長くなると投与量が増加します。 Epiao®(3,000μ/本)は中国で広く使用されているエポエチンアルファ、Recormon®(2,000μ/本)は欧州で広く使用されているエポエチンベータで、中国では4年前から使用されています。 Andrewsらは、全群でヘマトクリットが同様に高いにもかかわらず、高用量群で投与回数を増やすと、低用量群で投与回数の少ない動物に比べて血栓性毒性の発生率が高まることを見出しました(17)。これは、高ヘマトクリットがESA関連毒性を導く唯一の原因因子ではなく、用量レベル、投与回数、投与期間にも関連していることを示唆するものです。 5407>
現在、定期的に血液透析を受けている尿毒症患者において、ESAの投与量とPTHの関係については、限られたデータしかない。 本研究は、当院のコンピュータデータベースシステムの臨床データに基づいて、血液透析患者におけるESAsの投与量とインタクトPTH(iPTH)値の関連性を調査することを目的としたレトロスペクティブ研究である
材料と方法
患者と手順
このレトロスペクティブ・コホート研究は、中国・厦門大学中山病院において2015年2月から5月まで実施したものである。 本研究は、3ヶ月以上維持血液透析を受けている尿毒症患者で、貧血治療のためにESAを使用した患者を対象とした。 以下の基準に該当する患者は、本研究から除外した。 (1)年齢<18歳、(2)活動性感染症、悪性腫瘍、鉄欠乏性貧血(フェリチン<100ng/mLおよび飽和<20%と定義)、または3ヶ月以内の活動性出血のある患者、(3)データが不完全である患者。 対象患者は、使用したESAによって2群に分類された。 5407>
Data Collection
データは厦門中山病院のコンピュータデータベースシステムJinshidaから入手し、376人の血液透析患者の臨床データを再コード化したものであった。 収集したデータは、年齢、性別、乾燥体重、原疾患の診断、血中尿素窒素(BUN)、血清クレアチニン(Scr)、ヘモグロビン、カルシウム、リン、アルブミン、iPTH、血清フェリチン、トランスフェリン飽和度、ESAの投与量などであった。 これらのデータは、血液透析当日の朝(透析前)に測定されました。 Kidney Disease Improving Global Outcomes(KDIGO)ガイドラインに基づき、血液透析を維持している尿毒症患者において、ヘモグロビン値は110〜130g/Lを正常値と定義した(8)。 血清カルシウムとリンの基準値は、それぞれ2.1〜2.54mmol/Lと1.1〜1.78mmol/L以内と定義された(18)。 さらに、iPTH値に基づいて、150、300、600、1,500pg/mLに分類した(19、20)。
研究倫理
この研究は、当院の電子患者記録システムから得られたレトロスペクティブデータを分析することによって行われた。 ヒト研究に関する研究計画書は厦門大学中山病院倫理委員会の承認を得た。 5407>
統計解析
SPSS for Windowsソフトウェアバージョン17.0を使用して統計解析を実施した。 データはパーセンテージまたは平均±標準誤差(SEM)で表した。 群間の人口統計学的データおよび臨床検査値の比較は、Pearsonのカイ二乗検定、Fisherの正確検定、またはYateの連続性補正により行った。 P値<0.05を統計的に有意とした。
結果
通常の血液透析を維持している尿毒症患者の特徴
この研究には、通常の血液透析を維持している合計240名の尿毒症患者が含まれていた。 患者さんのベースライン特性を表1に示す。 年齢、性別、乾燥体重、原疾患、BUN、Scr、ヘモグロビン、血清リン酸、カルシウム、アルブミン、血清フェリチン、トランスフェリン飽和度はレコーモン群とエピオ群で有意差はなかった(表1、P > 0.05)

Table 1.血液透析患者を対象とした。 患者のベースライン特性。
全対象者の平均ヘモグロビン値は103.15±1.07g/Lであった。 ヘモグロビン値が110~130g/Lの患者は30.4%(n=84)であった。 貧血は,貧血の重症度に応じてヘモグロビン値により5クラスに分類した(21,22):ヘモグロビン値<3129>60 g/L(2.1%,n = 5),ヘモグロビン値≧60および<3129>90 g/L(21.7%,n = 52),ヘモグロビン値<90および<3129>110g/L(38.7%、n=93)、ヘモグロビン値≧110および<130g/L(30.4%、n=73)、ヘモグロビン値≧130g/L(7.1%、n=17)。
Relationship between the Degree of Anemia and iPTH
異なる程度の貧血とiPTHの関係について分析されました。 その結果、ヘモグロビン値はiPTHと負の相関を示した(図1A、表2、P < 0.05)。 しかし、貧血と血清カルシウム値やリン値との間に有意な関連は認められなかった(図1B;表2;いずれもP<1026>0.05)
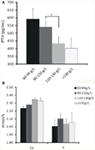
FIGURE 1. ヘモグロビン濃度とiPTH、血清カルシウムまたはリン値との関係。 (A)層別によりiPTH値が低下するとヘモグロビン濃度は上昇した。 (B)ヘモグロビン濃度と血清カルシウム値またはリン値との間に有意な関連は認められなかった。 データはt検定により算出。 *P < 0.05.

TABLE 2

表 2. 層別化によるヘモグロビン値に基づく血清カルシウム,リンおよびiPTH値の測定値。
iPTHが150-300pg/mLの患者はヘモグロビン、血清フェリチン、トランスフェリン飽和度が最も高かった
iPTH値が150-300pg/mL以内では、血液透析患者はヘモグロビン、血清フェリチン、トランスフェリン飽和度の平均値が高く、その値は106.25 g/L、248.98 μg/L、30.97%であった(図2)。 iPTH値が150-300pg/mL以内の患者は、ヘモグロビン、血清フェリチン、トランスフェリン飽和度が最高値であった。 データはパーセントまたは平均±SEMで表した。
貧血治療におけるレコーモンとエピオの比較
レコーモンとエピオで治療した患者のヘモグロビン値は同等であった(103.54 ± 1.72 g/L, n = 98 対 102.59 ± 1.38 g/L, n = 142, P > 0.05; 図3A)。 しかし、貧血治療のためのレコーモン(3,853.66 ± 225.13 μ/週、n = 98)の投与量は、エピオ(7,083.33 ± 264.93 μ/週、n = 142、P < 0.05; 図3B、表1)より著しく少なかった. 5407>
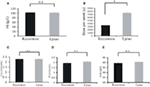
Figure3. 貧血治療におけるレコルモンとエピオの比較。 (A)レコーモンとエピオで治療した患者のヘモグロビン値は同等であった(103.54 ± 1.72 g/L, n = 98 vs. 102.59 ± 1.38 g/L, n = 142, P > 0.05). (B)貧血治療のためのレコーモンの投与量は、3,853.66 ± 225.13 μ/week, n = 98 vs. 7,083.33 ± 264.93 μ/week, n = 142とEpiaoより有意に少なかった。 (C-E)カルシウム(C)、リン(D)、アルブミン(E)値にはレコルモン群とエピアオ群の間に有意差はなかった。 データはt-testで算出。P > 0.05。
カルシウム、リン、アルブミンの血清レベルはレコルモン群とエピオ群で有意差はなかった(それぞれ、2.0%、2.0%、2.0%)。27 ± 0.47 vs. 2.29 ± 0.01 mmol/L, P > 0.05; 1.94 ± 0.10 vs. 2.06 ± 0.04 mmol/L, P > 0.05; 39.5 ± 0.44 vs. 40.2 ± 0.01mmol/L,P>0.05。35 g/L, P > 0.05; Figures 3C-E; Table 1)。
The Relationship Between the Doses of ESAs and iPTH Levels
For all hemodialysis patients, Recormon group were lower than Epiao group (336.0 ± 0.0 mmol/L, P > 0.05; The Doses of the iPTH Levels of the Emodialysis for the ESAs) the Reformon group were low in the Epcs of the Epcs and iPTH Levels in the Epiao group.66 ± 57.76 pg/mL, n = 98 vs. 531.05 ± 39.57 pg/mL, n = 142; P < 0.05; Figure 4A; Table 1)であった。 同様の傾向は、ヘモグロビン値が110~130g/Lの血液透析患者でも見られた(レコルモン群319.50±74.9pg/mL、n=28 vs エピオ群499.5 ± 64.38 pg/mL、n=45;P < 0.05; Figure 4A)。 ESAの投与量とiPTH値との関連性。 (A)レコルモン群とエピアオ群のiPTH値。 (B)レコーモン群では、レコーモンを2,000μ/週と4,000μ/週で投与した患者におけるiPTH値。 (C)エピオ投与群:エピオ3,000μ/weekと>6,000μ/weekにおけるiPTH値。 データはt-testで算出。*P < 0.05。
ヘモグロビン値が110〜130g/Lの患者では、iPTH値は201.54±42.0。67 pg/mL(n=10)であり、4,000μ/週のレコーモンで治療した患者(348.16 ± 117.9 pg/mL、n=13;P<3129>0.05、図4B)より有意に低かった。 同様に、3,000μ/weekのEpiaoで治療した患者の平均iPTHレベルは、Epiao >6,000 μ/weekで治療した患者より有意に低かった(347.15 ± 75.94 pg/mL, n = 12 vs 661.01 ± 198.45 pg/mL, n = 27; P < 0.05, Figure 4C).
考察
このレトロスペクティブ研究は、通常の血液透析を維持する尿毒症患者において、ESA(エポエチンアルファおよび-β)の高用量がiPTHの高値と関連しているかもしれないという証拠を初めて提供するものである。 さらに、iPTH値が150-300pg/mL以内の患者は、ヘモグロビン、血清フェリチン、トランスフェリン飽和度が最も高く、KDIGOガイドライン(9)に基づくiPTHの推奨値と一致することがわかった。
貧血はCKDに最もよく見られる合併症の一つである。 世界保健機関では、男性および閉経後の女性ではヘモグロビン濃度が13.0g/dl未満、それ以外の女性ではヘモグロビン濃度が<12.0g/dLであることを貧血と定義しています。 ESAの使用により、CKDの多くの貧血患者の生活は著しく改善された。 しかし、ESAの高用量投与は、成人および小児のCKD患者における有害な転帰のリスク上昇に関連することが明らかにされています。 ESAの高用量による治療を受けた患者は、死亡リスクが1.2-1.5増加します(23)。 今回、ESAを投与された血液透析患者において、iPTH値とヘモグロビン濃度の間に有意な逆相関が認められ、これまでの研究結果(8-10)と一致しました。
今回の研究では、レコルモン群とエピオ群ではヘモグロビン濃度は同等でしたが、レコルモンの使用量がエピオより有意に少なかったことがわかりました。 また,レコルモン群のiPTH値はエピオ群に比べ有意に低いことがわかった。 さらに、ESAの投与量とiPTH値との関連を明らかにするために、レコーモンとエピオを投与された患者さんの臨床データを別々に解析したところ、レコーモンの方がエピオより有意にiPTH値が低かった。 iPTH値は2,000μ/weekのレコーモン投与群の方が4,000μ/weekのレコーモン投与群より有意に低値であり、レコーモン投与群とエピオ投与群を比較すると、レコーモン投与群の方が低値であった。 同様の傾向は、3,000μ/週あるいは6,000μ/週の用量のエピアオを投与された患者でも認められ、ESAの高用量投与がiPTH高値と関係している可能性が示唆された。 これらの知見は、ESAの毒性はヘマトクリットの高さだけでは説明できないことを示している。 維持透析患者において、ESAの高用量がiPTHの高値と関連している可能性を考えると、末期腎臓病患者は、特に最近の心血管または脳血管イベント、高血圧緊急事態、または急性血栓塞栓イベントのある患者において、ESAの用量を最小限にするか差し控えることによって管理することが最善であるかもしれません。 実際、CKDではヘモグロビン濃度がほぼ正常でESAを高用量投与すると心血管イベントのリスクが高まることを考えると、台湾ではヘモグロビン値を100~110g/L以内にするために不相応に多量のESAを使用することは推奨されていない(24)。
CKDにおける貧血の病因は多因子性だが、CKD患者における貧血はエリスロポエチン不足が主因であるとされている(25)。 CKDに伴う貧血のその他の要因としては、鉄欠乏、炎症性貧血、赤血球造血の抑制、尿毒症による赤血球の生存期間の短縮、消化管出血などの失血などがある。 鉄欠乏も貧血の一般的な原因因子であるため、台湾では1996年にいち早く鉄剤の静脈内投与が奨励されました。 台湾でのCKD貧血管理の経験から、可能な限り低用量のESAを使用し、鉄分の静脈内補充を行うことで、妥当なヘモグロビン目標値を達成できる(24)
本研究にはいくつかの制約がある。 第一に、この観察研究は単一施設の研究である。 第二に,適応症による交絡と選択バイアスの可能性を考慮すると,これらのデータの解釈には慎重さが必要である。 実際,iPTHとESAsの関連に関する我々の観察結果は,縦断的なプロスペクティブ研究によってさらに調査する必要がある。 第三に、エピオが142例とロコルモンが98例と多く、これはエピオがロコルモンより比較的安価であったためと思われる(表1)。
結論として、本研究は、定期的に血液透析を受けている尿毒症患者において、ESAの高用量投与はiPTHの高値と関連しているかもしれないことを示している。 二次性副甲状腺機能亢進症の病態に高用量のESAが関与しているかどうかはまだ不明であり,さらなる調査が必要である。 今回の結果から、ESAの投与量をできるだけ少なくすることで、潜在的なリスクを最小限に抑えつつ、妥当なヘモグロビン目標値を達成できることが示唆されました。
利益相反声明
著者は、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究が行われたことを宣言する。
資金
この研究は、福建省の医療革新プログラム基金(第2011027号)の支援を受けました。
Abbreviations
BUN, blood urea nitrogen; CKD, chronic kidney disease; ESA, erythropoiesis-stimulating agent; Hb, hemoglobin; iPTH, intact-parathyroid hormone; Scr, serum creatinine.
1.BUN は血液中の血中ウレアーゼロゲン、CKD は慢性腎臓病、SCR は赤血球生成促進剤、HB はヘモグロビン、iPTH は副甲状腺ホルモン、SCR は血清クレアチニン。 中国における慢性腎臓病の有病率:横断的調査」(Zhang L, Wang F, Wang L, Wang W, Liu B, Liu J, et al. Lancet (2012) 379:815-22. doi: 10.1016/S0140-6736(12)60033-6
PubMed Abstract | CrossRef Full Text | Google Scholar
2.中国における慢性腎臓病の有病率:横断的調査(Prevalence of chronic kidney disease in China: cross-section survey). Martin KJ, Gonzalez EA. 慢性腎臓病における代謝性骨疾患。 J Am Soc Nephrol (2007) 18:875-85. doi:10.1681/ASN.2006070771
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Rodriguez M, Nemeth E, Martin D. The Calcium-sensing receptor: a key factors in the pathogenesis of secondary hyperparathyroidism. Am J Physiol Renal Physiol (2005) 288:F253-64. doi:10.1152/ajprenal.00302.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
4.カルシウム受容体:二次性副甲状腺機能亢進症の病因となる重要な因子。 このような場合、「腎臓病初期における左室肥満度の増加:ヘモグロビンの減少の影響」。 doi:10.1016/S0272-6386(99)70118-6
PubMed Abstract | CrossRef Full Text | Google Scholar
5.左心室質量指数の増加、腎臓病初期:ヘモグロビンの減少の影響。 Kwack C, Balakrishnan VS. エリスロポエチン低応答性の管理。 Semin Dial (2006) 19:146-51. doi:10.1111/j.1525-139X.2006.00141.x
PubMed Abstract | CrossRef Full Text | Google Scholar
6.エリスロポエチン低反応の管理。 腎不全における副甲状腺機能亢進症と貧血。 Am J Nephrol (2000) 20:89-96. doi:10.1159/000013563
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Wu SG, Jeng FR, Wei SY, Su CZ, Chung TC, Chang WJ, et al. Red blood cell osmotic fragility in chronically hemodialyzed patients. Nephron (1998) 78:28-32. doi:10.1159/000044878
PubMed Abstract | CrossRef Full Text | Google Scholar
8.赤血球の浸透圧の脆弱性(Fragility)。 血液透析患者における二次性副甲状腺機能亢進症による貧血の増悪。 Med J Islam Acad Sci (2001) 14(4):161-6.
Google Scholar
9. Sliem H, Tawfik G, Moustafa F, Zaki H. 末期腎不全における二次性副甲状腺機能亢進症と血清線維芽細胞増殖因子23の関連:ケースコントロール研究。 インドJ Endocrinol Metab(2011)15:105-9. doi:10.4103/2230-8210.81939
PubMed Abstract | CrossRef Full Text | Google Scholar
10.二次性副甲状腺機能亢進症を伴う、末期腎臓病における血清線維芽細胞増殖因子-23との関係。 Trovato GM, Carpinteri G, Spina S, Squatrito G, Catalano D, Iannetti E. Hyperparathyroidism, anaemia and erythropoietin: effects on systolic function of dialysis patients.副甲状腺機能亢進症、貧血とエリスロポエチン:透析患者における収縮機能への影響. 欧州腎臓協会/欧州透析ND移植協会の31 stの議会の抄録、9月5日〜8日、1999年マドリード。 Nephrol Dial Transpl (1999) 14:190.
Google Scholar
11. Meytes D, Bogin E, Ma A, Dukes PP, Massry SG. 副甲状腺ホルモンが赤血球造血に及ぼす影響。 J Clin Invest (1981) 67:1263-9. doi:10.1172/JCI110154
PubMed Abstract | CrossRef Full Text | Google Scholar
12.副甲状腺ホルモンの赤血球造血作用に対する影響。 エシュバックJW、アブドゥルハディMH、ブラウンJK、デラノBG、ダウニングMR、エグリーJC、その他、末期腎臓病の貧血患者における遺伝子組換えヒトエリスロポエチン。 第 III 相多施設共同臨床試験の結果。 Ann Intern Med (1989) 111(12):992-1000. doi:10.7326/0003-4819-111-12-992
PubMed Abstract | CrossRef Full Text | Google Scholar
13.邦訳:『医療大全知識』(日本経済新聞社)。 N Engl J Med (1998) 339:584-90. doi:10.1056/NEJM199808273390903
PubMed Abstract | CrossRef Full Text | Google Scholar
14.心筋梗塞の患者におけるヘモクリット値の正常値と低値の比較。 Singh AK. ヘモグロビン値を生存可能なアウトカム指標として維持すべきか? Nephrol News Issues (2010) 24(15-6):18.
PubMed Abstract | Google Scholar
15.Singhは、ヘモグロビン値をアウトカム指標として残すべきでしょうか? エリスロポエチンで治療した慢性腎臓病の貧血患者における死亡率と目標ヘモグロビン濃度:メタアナリシス。 Lancet (2007) 369:381-8. doi:10.1016/S0140-6736(07)60194-9
PubMed Abstract | CrossRef Full Text | Google Scholar
16.エリスロポエチン投与による貧血患者の死亡率、目標ヘモグロビン値。 Regidor D, McClellan WM, Kewalramani R, Sharma A, Bradbury BD. 米国の非透析慢性腎臓病患者における2005年から2009年までの赤血球造血刺激因子(ESA)投与量とヘモグロビン値の変化。 Nephrol Dial Transplant (2011) 26:1583-91. doi:10.1093/ndt/gfq573
PubMed Abstract | CrossRef Full Text | Google Scholar
17.米国における非透析慢性腎臓病患者における赤血球造血刺激因子(ESA)投与とヘモグロビン値の変化。 Andrews DA, Pyrah ITG, Boren BM, Tannehill-Gregg SH, Lightfoot-Dunn RM. 赤血球造血刺激因子投与による高ヘマトクリットは、前臨床種における死亡率や毒性を完全に予測するものではない。 Toxicol Pathol (2014) 42:510-23. doi:10.1177/0192623313486317
PubMed Abstract | CrossRef Full Text | Google Scholar
18.邦訳:「赤血球生成促進剤の投与に伴う高ヘモクリット血症は、前臨床種における死亡率や毒性を十分に予測できない。 腎臓病。 KDIGO)CKD-MBD 作業部会。 慢性腎臓病-ミネラルと骨の障害(CKD-MBD)の診断、評価、予防、治療のためのKDIGO臨床実践ガイドライン. Kidney Int Suppl (2009) 113:S1-130. doi:10.1038/ki.2009.188
CrossRef Full Text | Google Scholar
19.腎臓病と骨粗鬆症(CKD-MBD)ワークグループ。 Tentori F, Blayney MJ, Albert JM, Gillespie BW, Kerr PG, Bommer J, et al. 血清カルシウム、リン、PTHのレベルが異なる透析患者の死亡リスク:Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2008) 52(3):519-30. doi:10.1053/j.ajkd.2008.03.020
PubMed Abstract | CrossRef Full Text | Google Scholar
20.透析患者の死亡リスク(血清カルシウム、リン、PTHのレベルの違い)。 全米腎臓財団。 慢性腎臓病の K/DOQI 臨床実践ガイドライン:評価、分類、および層別化. Am J Kidney Dis (2002) 39(2 Suppl 1):S1-266.
Google Scholar
21.慢性腎臓病の臨床実践ガイドライン(K/DOQI):評価と層別化(Evaluation and stratification). Pisoni RL, Bragg-Gresham JL, Young EW, Akizawa T, Asano Y, Locatelli F, et al. Anemia management and outcomes from 12 countries in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2004) 44(1):94-111. doi:10.1053/j.ajkd.2004.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
22.貧血の管理。 腎臓病。 Improving Global Outcomes (KDIGO) Anemia Work Group. 慢性腎臓病における貧血に関する KDIGO 臨床実践ガイドライン. Kidney Int Suppl (2012) 2:279-335.
Google Scholar
23.腎臓病:グローバルアウトカムの改善(KDIGO)貧血作業部会。 赤血球造血刺激因子製剤の大量投与と死亡率:逐次Cox法と限界構造モデルによる解析」Suttorp MM, Hoekstra T, Mittelman M, Ott I, Krediet RT, Dekker FW, et al. Pharmacoepidemiol Drug Saf (2015) 24(10):1068-75. doi:10.1002/pds.3855
PubMed Abstract | CrossRef Full Text | Google Scholar
24.赤血球造血刺激因子製剤の高用量投与と死亡率:逐次Coxアプローチと周辺構造モデルによる解析(Pharmacoepidemiol Drug Saf) 24.10.10(10):10667-75. を、Hung SC, Kuo KL, Tarng DC, Hsu CC, Wu MS, Huang T-P. 慢性腎臓病患者における貧血管理。 台湾の診療ガイドライン。 Nephrology (Carlton) (2014) 19:735-9. doi:10.1111/nep.12332
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Randolph JF, Scarlett JM, Stokol T, MacLeod JN. また、このような場合にも、「痒み」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」、「痒み止め」などを使用する。 J Vet Intern Med (2004) 18:81-91. doi:10.1111/j.1939-1676.2004.tb00139.x
CrossRef Full Text | Google Scholar
.