デング熱はかつて、長い間隔で流行する定期的な病気でしたが、今日では世界で最も重要な蚊媒介性のウイルス性疾患と考えられています … 続きを読む 年間、世界中で約5000万から1億のデング熱の症例が記録されています。 このうち50万人はデング出血熱(DHF)と呼ばれる最も重症のデング熱になります。 DHFは15歳以下の小児が主に罹患する疾患で、発熱、血小板減少、血管漏出症候群が突然発症するのが特徴です。 デング熱は、フラビウイルス科に属するデングウイルスに感染することで発症します。 このウイルスは正二十面体のエンベロープ型一本鎖ポジティブセンスRNAである。 正20面体のコアは直径40〜50ナノメートルで、ウイルスゲノムを包むCタンパク質が含まれている。 脂質エンベロープを構成する2つのウイルスタンパク質、MとEがコアを取り囲んでいる。 デング熱は、デングウイルス(DENV)の4つの血清型のうちの1つによって引き起こされます。 DENV-1、DENV-2、DENV-3、DENV-4 の4つの血清型のいずれかによって引き起こされる。
過去に感染した人が再び感染した場合、血管が弱くなり破裂して内出血するデングショック症候群(DSS)やDHFを発症するリスクが高くなります … 続きを読む 非中和抗体は、Fc受容体を発現する細胞によるウイルスの取り込みを促進するため、抗体依存的なDHFの亢進を可能にする . 様々な種類のAedesmosquitoがデングウイルスのベクターであり、ヒトの宿主に噛み付くことでウイルスを感染させます。 中央アメリカ、ラテンアメリカ、東南アジア、西太平洋に生息する小型の白黒の熱帯・亜熱帯の蚊であるAedes aegyptiは、主要な媒介者です。 世界100カ国以上、特に熱帯・亜熱帯地域の風土病である。 米国では、DHFを引き起こすAedes aegyptispeciesは、ルイジアナ、フロリダ南部、ニューメキシコ、アリゾナ、テキサス、ジョージア、アラバマ、ミシシッピ、ノースおよびサウスカロライナ、ケンタッキー、オクラホマ、テネシーで季節ごとに見つけることができます。 過去50年間で、デング熱の発生率は30倍に増加しました。
世界保健機関(WHO)によると、デング熱の感染者数は年間5000万から1億人と推定されています。 このうち50万人がデング熱に移行し、22,000人が死亡しており、そのほとんどが小児であるとされています。 WHOに提出された公式データによると、アメリカ大陸、東南アジア、西太平洋地域におけるデング熱の患者数は、2008年に120万人を超え、2013年には300万人を超えました。 2013年には、アメリカ大陸だけで235万人のデング熱患者が報告され、そのうち37,687人がDHFの患者でした。 1953年から1954年にかけてフィリピンで初めてDHFの流行が確認された後、この病気は東南アジア全域に広がり続けました。
1950年代、1960年代、および1970年代の大部分において、デング熱の流行は中南米の大部分でまれでした。 しかし、駆除が中止されると、イエネコは再びこれらの地域に侵入するようになった。 WHOによると、現在、デング熱・DHFが流行している地域には25億人以上の人々が住んでおり、デング熱ウイルスに感染する危険性があるとされている。 気温、降水量、農村から都市への移動、人口増加、貯水量、固形廃棄物の増加など、イエネコによるウイルス感染にはいくつかの要因があり、これらがベクターの幼虫の生息地となる。 また、渡航に伴うDHFの発生もあります。 デング熱は世界で最も広く蔓延しているアルボウイルス感染症です。
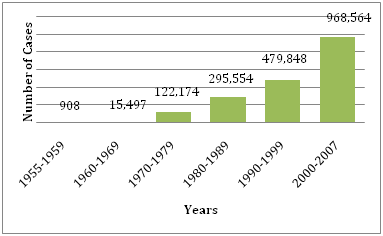
図1: WHOに報告されたDF/DHFの平均数。
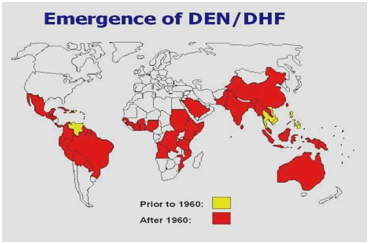
図2:アメリカ大陸、カリブ海、アフリカ、中東におけるデング熱/デング出血熱の分布
デング熱の危険因子とデングウイルス伝播
デング熱は節足動物が媒介するウイルス疾患の重要性.Den.De……D…F..です。 研究によると、イエネコ属の蚊、主にイエネコとイエネコ・アルボピクタスは、人が住む場所の近くに住むように適応し、デング熱の感染に関与していることが分かっています。 この蚊は、日中に餌を食べ、他の動物よりも人間を好みます。 ヒトスジシマカが76.9%と最も多く、次いでイエネコが75%、イエネコが33.3%となっている。 デング熱の発生率は、植生、樹木被覆、住宅の質、周囲の土地面積と関連しています。13 気温は、ベクターの発生率、死亡率、行動に影響を与え、ベクター内でのウイルス複製を制御するのに役立ちます。 温暖な気候は幼虫の発育を促し、ウイルスの複製を加速させますが、寒冷な気候はウイルスの発育を遅らせ、蚊の生存時間を短縮させるため、感染媒介となる可能性が低く、デング熱の伝播を減少させることができます。 気温はまた、蒸発の主な調節因子として降雨量と相互作用するため、水の生息地の利用可能性に直接影響を与え、間接的に土地被覆や土地利用に影響を与え、ベクター集団の成長を促進または阻害することができます。
人口増加、都市化、近代的な交通機関などの人口動態および社会変化は、デング熱活動の発生率と地理的広がりに大きく貢献しています。 旅行者は流行地域から移動するため、さらなる拡大のための乗り物となる傾向があります。 デングウイルスのウイルス株の毒性および遺伝的変異も、DHFの流行拡大の可能性を高める要因となっています。
デング出血熱の病原体
蚊がヒトを捕食する際に、デングウイルス(DENV)を血流および周囲の表皮と真皮に注入する。 この結果、受容体を介したエンドサイトーシスにより、未熟なランゲルハンス細胞やケラチノサイトに感染する。 表面タンパク質であるEタンパク質は再構成され、膜融合とウイルスRNAの感染細胞内への放出を可能にする。 非構造タンパク質であるNS1およびNS2Aは、ウイルスRNAの複製を制御し、NS1は補体カスケードの活性化にも関与していると考えられる。 感染細胞は、アポトーシスやネクローシスによって死滅するか、リンパ節に移動してマクロファージが動員される(図3)。 デング熱の4つの血清型(DENV-1からDENV-4)のいずれかに感染しても、宿主の免疫系が局所的に中和することができるため、ほとんどの場合無症状ですが、さまざまな臨床症状を引き起こすこともあります。最も重症のものはDHFで、DSSや死に至ることもあります . DHFは臨床的には、粘膜や皮膚の出血を伴う2日から7日間の発熱が続き、血小板減少(<10万個/mm3)とヘマトクリットが患者または同年齢集団の基準値より20%以上高い状態と定義されます。 DHFの病理学的特徴は、胸膜または腹膜表面からの血漿漏出と内因性凝固障害であり、臨床的には、止血テスト陽性、または点状出血や斑状出血、歯肉出血や鼻出血、消化管出血などの自然出血の証拠によって測定されます …

図3:保菌者のヒトスジシマカに刺された後、未熟なランゲルハンス細胞やケラチノサイトがDENVに感染している。 感染した細胞はリンパ節に移動し、マクロファージが動員される。 ここから肝臓、脾臓、骨髄など様々な臓器に感染し、播種される。 DENVによる骨髄の壊死は、造血の抑制や血液中の血栓形成の減少をもたらすことがある。 肥満細胞、マクロファージ、リンパ球からのケモカインやサイトカイン放出による炎症反応は、血管透過性の亢進、血小板機能不全、血小板減少や血漿漏出を引き起こします. そのメカニズムはよく分かっていないが、このカスケードは自然出血も引き起こすようで、点状出血、歯肉出血、消化管出血の臨床症状を引き起こす。
この病気の重症型は、しばしば、宿主が第2の血清型に感染して、ウイルスと宿主の免疫反応の間の複雑な相互作用を生じる二次感染の結果である . この反応を引き起こすメカニズムはよく分かっていませんが、先行感染によって、新しい血清型に結合するものの、それを中和することができない交差反応性抗体が作られる可能性があることを示唆しています。 これは抗体依存性増強(ADE)説と呼ばれています。 DENVの構造タンパク質であるEタンパク質やprMに対する先行感染で形成された抗体は、新しい病原体を中和できず、代わりにFcγ受容体陽性細胞への結合を増強し、ウイルスの複製を増幅させると考えられている。 これに対して、免疫系は過剰なサイトカイン反応を放出し、血管透過性の亢進や凝固障害を引き起こす。
マスト細胞もDHFの発症に関与しているとされている。 あるケースでは、肥満細胞は抗ウイルス分子を放出し、T-リンパ球やナチュラルキラー(NK)細胞などの他の免疫細胞を動員して、ウイルスを中和する保護機能を提供するようである。 しかし、局所制御機構ではウイルスを抑えきれず、血液やリンパ液の流れに乗って、肝臓、脾臓、リンパ節などの他の臓器の肥満細胞を活性化する場合もあります。 これらの臓器で肉芽形成が起こると、プロテアーゼが放出され、ロイコトリエンや血管内皮増殖因子(VEGF)などの炎症メディエーターが合成され、毛細血管の透過性が高まり、血漿の漏出が起こる . このことは、肉芽形成の過程で異なるグループの肥満細胞が異なるメディエーターを放出することから、重要である。 デングウイルスのNS1抗原を介したウイルス抗体複合体やサイトカインの産生も補体の活性化を引き起こす。 C3aおよびC5a断片の放出は、血管透過性を高めることが知られており、血漿漏出の一因となる。
放出されるサイトカインの種類と量は、疾患の重症度を決定する上で重要な役割を果たす。 マクロファージ炎症性タンパク質1β(MIP-1)は、感染した単核細胞や活性化したNK細胞から放出されるため、重症度が低いことの指標となるようである。 これは、より多くのNK細胞に対する化学的誘引剤として働き、炎症部位に誘い込み、ウイルスの複製と下流のサイトカイン効果を制限する。 一方、インターフェロンγ(IFN-γ)は、血漿漏出を誘発し、標的細胞上のFc受容体を増加させることによりデング粒子の取り込みを増加させることが示されており、したがって、より重度の臨床症状および予後不良に関連する。 DHFで増加する他のサイトカインには、インターロイキン2(IL-2)、腫瘍壊死因子α(TNF-α)、マクロファージ遊走阻止因子(MIF)、単球化学戦術タンパク質-1(MCP-1)、インターロイキン8(IL-8)、high mobility group box-1 (HMGB-1) があり、血小板の漏出を誘発することが明らかにされている ……このようなサイトカインがDHFでは増加する。 サイトカイン放出の影響は、血管透過性や血漿漏出にとどまらず、DHFの出血性症状にも関与している。 しかし、DHFの出血を引き起こす根本的なメカニズムはよく分かっていない。 感染した細胞の多くはアポトーシスにより死滅するが、一部の細胞は壊死し、毒素が放出され、凝固および線溶系が活性化される。 ウイルス量が多いために骨髄で高いレベルの壊死が起こると、造血が抑制され、血栓溶解ペニアが生じる。 その結果、血栓形成の低下と血小板の機能低下が起こり、毛細血管が脆弱化してDHFに見られるような臨床症状を引き起こす可能性があります。 また、DENV感染における肝臓の関与は、肝酵素値の上昇と出血傾向の増加との相関を示し、自然出血傾向に関与している可能性を指摘する研究もある。
臨床症状
臨床症状には、無症状感染、軽度のデング熱(DF)、デング出血熱(DHF)、毛細血管透過性異常と血漿漏出により重症化しやすいデングショック症候群(DSS)、などがあります . 重症デング熱は、通常、以前にデングウイルスに感染したことのある患者(二次感染)の間で起こります。 また、デングウイルスに感染したことのある母親から生まれたデングウイルス一次感染児が、高い確率で重症化することも報告されています。
DHFの初期段階は、デング熱として現れます。 この初期段階の症状は患者の年齢によって異なり、突然の高熱(2つのピークを持つこともある)、激しい頭痛、食欲低下、激しい筋肉痛、関節痛などである。 発熱から3〜4日後に出現する黄斑状皮疹、眼窩後部の痛み、羞明、リンパ節症、軽い出血(鼻出血、歯肉出血、消化管出血、血尿、月経痛)、止血剤テスト陽性。 DHFは、高熱、出血現象、しばしば肝腫大、循環不全の4つの主要な臨床症状で特徴付けられる。 初期に特徴的な急性熱性疾患は、39℃以上の発熱で、2〜7日間その状態が続く。
前述した初期症状は、発熱と頭痛が続き、激しい腹痛や圧痛、持続する嘔吐、吐血、下血、点状出血、易打撲性、落ち着きがない、無気力、眠気、イライラ、皮下出血や打撲など徐々に悪化する。 2-7 日間の発熱の後、体温が急速に低下し、多くの場合、様々な重症度の循環障害の徴候を伴います。 患者は汗をかき、落ち着きがなく、四肢が冷たくなり、脈拍と血圧の変化を示すことがあります。 DHF特有の症状として、発症から24〜48時間後には、止血異常と血漿漏出が観察されます。
これらの進行の良い指標は、肝臓の2cm以上の肥大で、肝腫大は血漿漏出に先行する傾向があるからである 。 多くの患者は、水分や電解質の治療で、あるいは治療なしで回復する。 重症例では、血漿漏出がショックに進行し、未治療の場合は死に至ることもある。 デング熱の二次感染とサイトカイン免疫系反応の誇張された報復が、患者のDHF発症の傾向を高めることが研究で示唆されています。
NS1糖タンパクなどのウイルス産物は、補体の活性化や血管の透過性に影響を与え、腹水や胸水に発展する血漿漏出が生じると考えられています。 また、サイトカイン反応も血管透過性を増加させ、その結果、血管内圧が低下し、血管外への体液の流出が促進される(図4)。 止血の異常は、ヘマトクリット値の上昇を伴う血小板減少、フィブリノゲン濃度の低下を伴う部分トロンボプラスチン時間の延長、前述の点状出血、消化管出血、斑状出血、鼻出血などで構成されています。
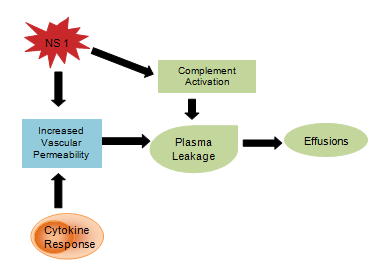
図4:サイトカインによる免疫系反応
DHFの発熱性ウイルス期には、骨髄抑制により血小板減少やその後の症状発現が起こると考えられています。 先に述べたように、骨髄の抑制は、骨髄がウイルスの複製場所であり、特に造血前駆細胞を攻撃する結果である 、しかし、DHF患者の血小板表面にウイルス-抗体複合体が発見されたことから、免疫による血小板の破壊も示唆されている。
まれな臨床症状として、急性肝炎、肝不全、急性腎不全、脳症、心筋症(急性心筋炎)などがある 。 成人の致死性デング熱に関する研究では、重症デング熱患者のデングショック症候群(DSS)以外の致死原因を調べ、低体温、白血球増加、帯状疱疹が重症デング熱のトリガーサインになり得ると結論付けています。 さらにこの研究では、特に初期の意識変容、深い血小板減少、PTの延長、白血球増加を有する患者において、大量の消化管出血が発生する可能性があることを意識するよう臨床医に助言しています。 デング熱の診断には多くの方法がある。 ウイルスの分離、ウイルス核酸、抗体および抗原、またはこれらすべての技術の組み合わせによって診断することができます。 培養によるデングウイルスの検出は決定的な診断法であるが、実用的な配慮からその使用は制限されている。 ウイルスRNAの検出はより迅速であるが、汚染により偽陽性となる可能性がある。 また、血清学的検査では、交差反応性抗体により偽陽性となる可能性がある。
急性感染症は、症状が出てから5〜8日の回復期初期に、血清、血漿、循環血球から検出される。 この時、一次感染では103 RNA粒子/ml、二次感染では106 RNA粒子/ml以上のウイルス量が検出されることがある。 現在では、NS1抗原と抗体検査の組み合わせや、リアルタイム逆転写ポリメラーゼ連鎖反応(RT-PCR)などの分子的手法が、迅速かつ高感度に診断できるため、より多く利用されるようになってきています。 また、免疫組織化学分析や免疫蛍光法では、ウイルス抗原によってウイルスの存在を確認することができます。 IgM抗体は、感染後3~5日以内に最初に出現します。
症状が現れてから2週間後にピークに達し、30-60日後には検出不可能なレベルまで低下します。 IgG抗体は、より交差反応性が高く、症状が出てから7-9日後に低レベルで検出され、ゆっくりと4倍まで増加し、数ヶ月後、場合によっては一生検出可能なままである。 ヒトの抗原および抗体反応は、宿主の免疫状態に依存し、一次感染時または二次感染時にのみ存在する。 デング熱に対する特異的な治療法や抗ウイルス剤はありません。 デング熱の病態は、血管透過性を高め、血管内コンパートメントから血管外スペースへの血漿の著しい喪失をもたらす。
この体液の喪失はショックにつながり、適切な修正なしでは低酸素症、代謝性アシドーシス、そして最終的には死に至ることになります。 したがって、一次管理としては、入院して体液と電解質のバランスをとる支持療法が必要である。 パックドセル量は、4~6時間ごとに1時間単位でモニターする必要がある。 著しい血漿減少とは、充填細胞量またはヘマトクリットが>20%増加することと定義される。 患者がこのレベルに達したら、迅速かつ積極的な容量補充が必要である。
輸液の交換速度は、充填細胞量と尿量に依存します。 生理食塩水、乳酸リンゲル液、酢酸リンゲル液、希釈5%ブドウ糖液、血漿またはデキストリン40などの血漿代替物、新鮮全血など、血漿喪失の補充に使われる液体は複数ある … 続きを読む 静脈内補液に加えて、発熱による喉の渇きと脱水を緩和するために、電解質を経口的に導入することができます。 アセトアミノフェンなどの支持的な鎮痛剤は、発熱やその他の症状の治療に使用することができます。 NSAIDsやアスピリンは、ライ症候群を誘発する可能性があるため、避ける必要があります。
DHF患者の回復には、退院前に以下の基準を満たす必要がある:目に見える臨床的改善、>24時間解熱剤を使用しない無熱、食欲増進、ヘマトクリットの安定、適切な尿量、重度の代謝性アシドーシスからの回復後3日、>5万/mm3血小板数、胸水や腹水による呼吸困難がないこと 。
イエネコの予防と根絶
イエネコはデング熱ウイルスの最も一般的なベクターであり、監視と制御活動の主な対象である。 イエネコなど他のベクターもデング熱を発生させることができるが、異なるベクターに対する監視・制御活動は、それらのベクターがデング熱感染の伝播に疫学的に重要な役割を果たしているという信頼できる証拠がある場合にのみ検討されるべきである 。 イエネコを駆除するための最初の取り組みは、1901年にキューバで行われました。 燻蒸と放置された容器の破壊による蚊の生息地の除去が、この媒介動物を根絶するための最初の一歩となりました。 1928年と1932年にブラジルで黄熱病が発生した後、都市住民を完全に保護するには、イエネコを完全に根絶する必要があることが明らかになりました。このため、汎米保健機構(PAHO)は、都市部の黄熱病と戦うための大陸イエネコ根絶計画を1947年に承認しました。 1947年以降、汎米衛生局(PASB)はすべての感染国でキャンペーンを展開し、1962年には大陸の18カ国とカリブ海の多くの島々で根絶を達成することができました。 こうした努力の結果、現在残っているデング熱ウイルスは、アメリカのDENV-2遺伝子型Vのみである。
媒介動物を根絶するための努力にもかかわらず、イエネコはキューバ、米国、ベネズエラ、およびいくつかのカリブ海諸国では根絶されなかった。 イエネコを根絶するための数十年にわたる前例のない人間の努力は、非常に急速にバラバラになり、すぐに蔓延するようになった。 サーベイランスの欠如と根絶プログラムの構造の悪化、不十分な環境衛生、不十分なコミュニティ参加などが、ベクター根絶の努力の衰退を招いた要因であった 。 現在、デング熱を予防するワクチンはありません。 武田ワクチンは、弱毒化したDENV-2株(TDV-2)と、DENV-1、-3、-4のprMおよびEタンパク質遺伝子を、弱毒化したTDV-2ゲノムに発現させた3つのキメラウイルス(それぞれTDV-1、TDV-3、TDV-4)からなる4価デングワクチンを開発中であります。 このワクチンは、デング熱流行国での第2相臨床試験において、成人および小児に対する忍容性および免疫原性が確認されています。
このワクチンは現在、第3相の開発段階にあります。 さらに、サノフィパスツールは、組換え、生消化、4価のデングワクチン(CYD-TDV)を開発し、流行国の9歳以上の個人で一貫した安全性と有効性を示しましたが、これは開発の後期段階にあります。 サノフィパスツールのDengvaxia(CYD-TDV)は、2015年12月にメキシコで初めて登録され、第III相臨床試験で0/6/12ヶ月スケジュールの3回投与シリーズとして評価されている 。 臨床試験で評価中の追加のワクチン候補は約5種類あります . デング熱流行地域への旅行者はデング熱に感染するリスクがあるため、予防のために、窓やドアに十分な網戸がある宿泊施設を選び、虫除け剤を使用し、適切な衣服を着用し、蚊の繁殖場所になる可能性のある立水を空にして蓋をするよう奨励する必要があります。
世界の現状
現在、デング熱は社会経済状況、継続的な気候変動、旅行、グローバル化など多くの要因により、今後も発生率が上昇すると予測されています。 ワクチンはまだ開発中であり、拡大するデング熱の脅威に対処するための特定の抗ウイルス療法は現在存在しない。 デング熱の発症数は、世界全体で5,000万人から2億人と推定されています。 しかし、最近、地図上のアプローチにより、デング熱の発生数は4億人に近いことが示唆されています。 2012年、WHOはデング熱を蚊が媒介する重要なウイルス性疾患の1つに分類しました。 この分類は、ウイルスとその媒介者が、これまで感染していなかった地域に地理的に大きく広がっていることから、正当化されています(図5)。
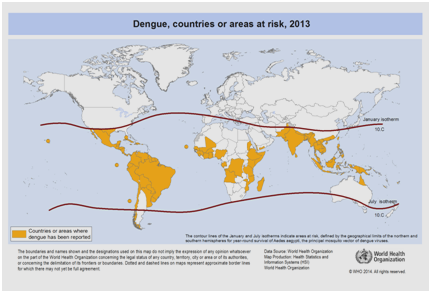
図5: 2013年にデング熱が報告された世界の国または地域(世界保健機関の収集データによる) .
また、この疾患がもたらすコストによっても支持されています。 デング熱と他の伝染病の負担を比較すると、デング熱は他の媒介性疾患よりもはるかに多くの人的被害をもたらし、負担が大きいことがわかります。 WHO によれば、デング熱は東南アジアの小児の入院および死亡の第一の原因となっている。 Hammondらの研究によると、この病気による罹患率と死亡率の大部分は、他のどの年齢層よりも小児に関連していることが報告されています。 生後4〜9ヶ月の乳幼児と5〜9歳の小児がデング熱に最も多く感染しています(図6)。 これらの小児における疾患の重症化は、多くの場合、DENVの二次感染に起因しています。 Dııaz-Quijano と Waldman がラテンアメリカとカリブ海で行った生態学的研究によると、これらの集団におけるデング死亡率の決定要因は、流行が認められている期間、人口密度、雨量などであることがわかりました .
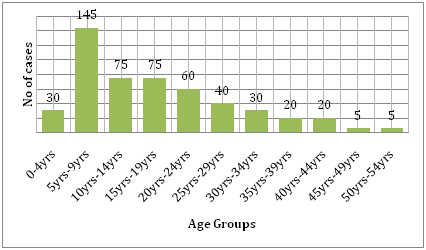
図6: レオンの研究コホートの年齢層別分布 .
罹患率と死亡率の影響に加えて、デング熱ウィルスは感染地域に高い財政負担をかけていますが、多くの地域ではこれらの費用を負担できる環境が整っていないのが実情です。 2010 年、デングウイルスの経済的負担は、南北アメリカ大陸の平均で年間 21 億ドル(2010 年米ドル)と推定され、感度分析では 10 ~ 40 億ドルの幅があり、年によってかなりの変動がありました 。 WHOによると、デング熱は今や世界的な問題であり、アジア太平洋地域はデング熱に感染している人が世界で最も多い(75%)地域であるとされています。 西太平洋地域でも、過去10年間にデング熱の報告数が増え続けています。
20世紀半ばにはデング熱の感染がなかったにもかかわらず、現在ではアメリカ大陸で土着のデング熱の流行が増加しています。 アメリカ大陸だけで、2010年には160万人以上のデング熱患者が報告され、そのうち49,000人が重症デング熱であった 。 アフリカでは、デング熱の発生規模や頻度が増加していますが、WHOへの報告は一貫して行われていません。 1960年から2010年の間に、アフリカの22カ国から散発的な症例が報告されていることが、入手可能なアウトブレイクデータから示唆されています。 ヨーロッパでは、1928年にギリシャで発生したDFの伝染病以来、報告されたことはありません。 現在、ヨーロッパでは、この病気の流行国からの旅行によるAedes albopictusに起因する流行の脅威がある。 今後、多因子危険因子により発症が増加することが予想される。