Buňky obsahují velké množství vody. Jednou z úloh vody je rozpouštět různé materiály. V buňkách se například nachází mnoho různých iontových sloučenin (solí). Ionty se používají k udržování buněčných potenciálů a jsou důležité pro buněčnou signalizaci a svalovou kontrakci.
Jak poznáte, zda je sloučenina iontová nebo kovalentní?
Na tuto otázku neexistuje jednoduchá odpověď. Mnoho vazeb je někde mezi nimi. V polární kovalentní vazbě je pár elektronů sdílen mezi dvěma atomy, aby se naplnil jejich oktet, ale elektrony leží blíže k jednomu konci vazby než k druhému. Směrem k jednomu konci vazby je více záporného náboje, a proto na druhém konci zůstává více kladného náboje.
Pohled na hodnoty elektronegativity různých atomů nám pomáhá rozhodnout, jak rovnoměrně je pár elektronů ve vazbě sdílen. Elektronegativita se zvyšuje směrem k pravému hornímu rohu periodické tabulky kvůli kombinaci jaderného náboje a stínících faktorů. Atomy v pravém horním rohu periodické tabulky mají větší přitažlivost pro sdílené vazebné elektrony, zatímco atomy v levém dolním rohu mají slabší přitažlivost pro elektrony v kovalentních vazbách.
Ve vazbě uhlíku s kyslíkem by bylo více elektronů přitahováno ke kyslíku, protože je v periodické tabulce ve své řadě napravo od uhlíku. Sloučeniny jako , dimethylether, CH3OCH3, jsou trochu polární. Formaldehyd, CH2O, je ještě polárnější. Elektrony ve vazbách typu pí jsou drženy volněji než elektrony ve vazbách typu sigma, a to z důvodů souvisejících s kvantovou mechanikou. To umožňuje kyslíku přitahovat k sobě elektrony v násobné vazbě snadněji než ve vazbě sigma.

Ne všechny polarity lze snadno určit pohledem do periodické tabulky. Směr dipólu ve vazbě boru s vodíkem by bylo obtížné předpovědět bez nahlédnutí do hodnot elektronegativity, protože bór je více vpravo, ale vodík je výše. Jak se ukázalo, vodík je mírně záporný.
Vazba je iontová, pokud je rozdíl elektronegativit mezi atomy dostatečně velký, aby jeden atom mohl zcela odtrhnout elektron od druhého. Tato situace je běžná ve sloučeninách, které kombinují prvky z levého okraje periodické tabulky (sodík, draslík, vápník atd.) s prvky v krajním pravém horním rohu periodické tabulky (nejčastěji kyslík, fluor, chlor). Chlorid sodný je iontová sloučenina.
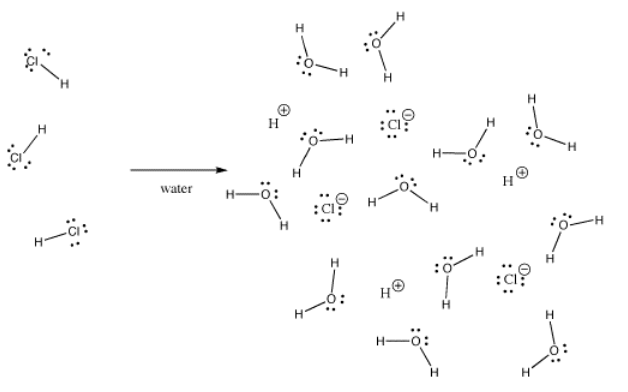
Mnoho vazeb může být v jedné situaci kovalentních a v jiné iontových. Například chlorovodík, HCl, je plyn, ve kterém jsou vodík a chlor kovalentně vázány, ale pokud HCl probublá do vody, zcela se ionizuje a vznikne roztok kyseliny chlorovodíkové H+ a Cl-. Ani v plynné HCl není náboj rozložen rovnoměrně. Chlor je částečně záporný a vodík částečně kladný.
Hydroxid draselný, KOH, obsahuje jednu vazbu kovalentní (O-H) a jednu iontovou (K-O). Vodík je záludný, protože se nachází v horní části periodické tabulky i na její levé straně. Je právě natolik elektropozitivní, že v některých případech vytváří iontové vazby. V jiných případech je právě tak elektronegativní, aby tvořil kovalentní vazby.
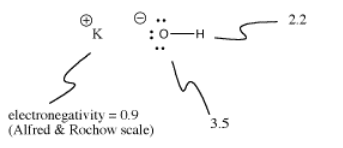
V KOH je vazba K-O iontová, protože rozdíl v elektronegativitě draslíku a kyslíku je velký. Rozdíl v elektronegativitě mezi kyslíkem a vodíkem není malý. Vazba O-H může někdy ionizovat, ale ne ve všech případech.
Někdy ionizace závisí na tom, co jiného se v molekule děje. Protože vazba K-O v hydroxidu draselném je iontová, není příliš pravděpodobné, že by vazba O-H ionizovala. Na kyslíku je již záporný náboj. Oddělení náboje stojí energii, takže je obtížnější přidat kyslíku druhý záporný náboj tím, že se ionizuje i vazba O-H. Často jsou první ionizace v molekulách mnohem snazší než druhé ionizace.
Cvičení \(\PageIndex{1}\)
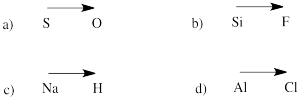
Předpovězte směr polarity ve vazbě mezi atomy v následujících dvojicích:
a) síra-kyslík b) křemík-fluor
c) vodík-sodík d) chlor-hliník
Odpověď
Protože je tak běžné, že se prvek z krajní levé ruky periodické tabulky vyskytuje jako kationt, a že prvky z krajní pravé strany nesou záporný náboj, můžeme často předpokládat, že sloučenina obsahující příklad každého z nich bude mít alespoň jednu iontovou vazbu.
Cvičení \(\PageIndex{2}\)
Nakreslete struktury následujících sloučenin. Každá z nich obsahuje alespoň jeden aniont a kationt.
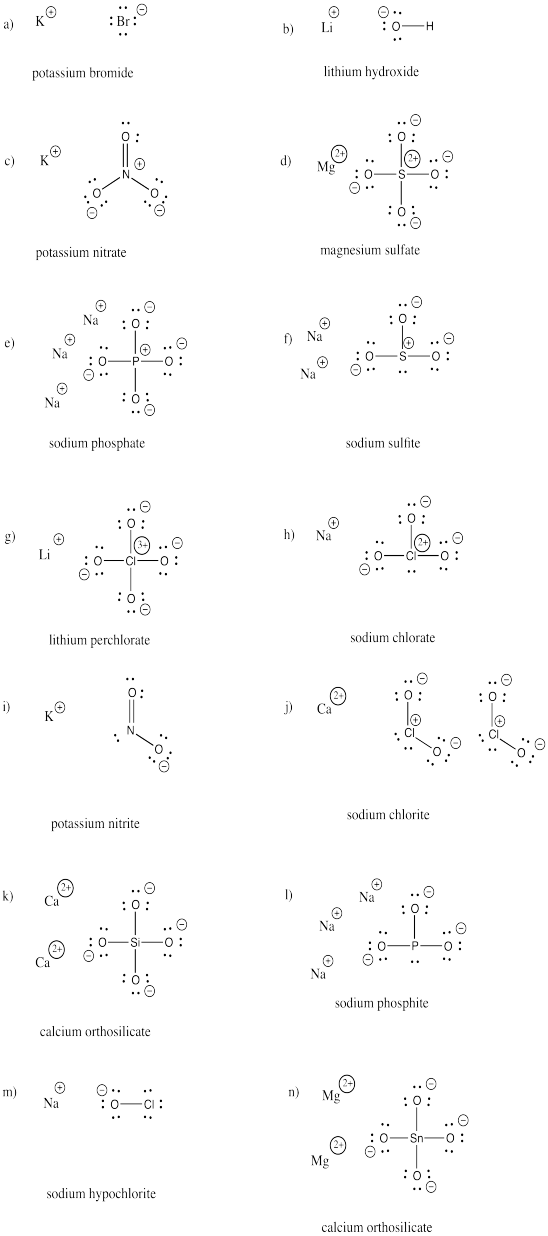
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Odpověď
Cvičení \(\PageIndex{3}\)
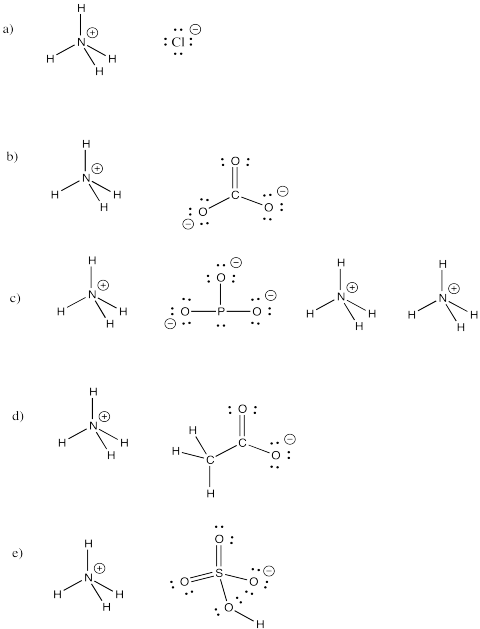
Amonný ion, NH4+ je běžný molekulární iont. Nakreslete struktury následujících sloučenin, které obsahují tento ion.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Odpověď
Cvičení \(\PageIndex{4}\)
Mnohé anionty mají názvy, které něco vypovídají o jejich struktuře.
| předpona- nebo -sufix |
obvyklý význam |
příklad názvu | příklad vzorce |
| -ide | atom je přítomen jako aniont | chlorid | Cl – |
| -ate | atom je přítomen jako oxyaniont; obvykle běžná forma | chloran | ClO3- |
| -it | atom je přítomen jako oxyaniont, ale s menším počtem kyslíků (nebo nižším „oxidačním stavem“) než jiná běžná forma | chloritan | ClO2- |
| per- | atom je přítomen jako oxyaniont, ale s ještě více oxygeny než „-átová“ forma | perchlorát | ClO4- |
| hypo- | atom je přítomen jako oxyaniont, ale s ještě menším počtem oxygenasů než „-itová“ forma | hypochloritan | ClO- |
Navrhněte podle tabulky názvy pro následující anionty:
a) Br- b) O2- c) F- d) CO32- (běžný oxaniont) e) NO3- (běžný oxaniont) f) NO2-
g) S2- h) SO42- (běžný oxaniont) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (běžný oxyaniont) o) PO43- (běžný oxaniont) PO33- p) I- q) IO3- (běžný oxyaniont) r) IO4-
Odpověď a)
bromid
Odpověď b)
oxid
Odpověď c)
fluorid
Odpověď d)
uhličitan
Odpověď e)
nitrát
Odpověď f)
nitrit
Odpověď g)
sulfid
. Odpověď h)
sulfát
Odpověď i)
sulfit
Odpověď j)
persulfát
Odpověď k)
karbid
Odpověď l)
nitrid
Odpověď m)
arsenid
Odpověď n)
fosforečnan
Odpověď o)
fosfit
Odpověď p)
jodid
Odpověď q)
jodičnan
Odpověď r)
periodičnan
Příspěvek
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)