Emisní spektra atomů
Elektrony v atomu mají tendenci být uspořádány tak, aby energie atomu byla co nejnižší. Základní stav atomu je stav atomu s nejnižší energií. Když se těmto atomům dodá energie, elektrony ji absorbují a přejdou do vyšší energetické hladiny. Tyto energetické hladiny elektronů v atomech jsou kvantované, což opět znamená, že elektron musí přecházet z jedné energetické hladiny na druhou v diskrétních krocích, nikoli plynule. Excitovaný stav atomu je stav, kdy je jeho potenciální energie vyšší než základní stav. Atom v excitovaném stavu není stabilní. Když se vrátí zpět do základního stavu, uvolní energii, kterou předtím získal, ve formě elektromagnetického záření.
Jak tedy atomy vůbec získávají energii? Jedním ze způsobů je průchod elektrického proudu uzavřeným vzorkem plynu při nízkém tlaku. Vzhledem k tomu, že energetické hladiny elektronů jsou pro každý prvek jedinečné, bude každý plynový výboj zářit charakteristickou barvou v závislosti na identitě plynu (viz níže).

„Neonové“ nápisy jsou známým příkladem plynových výbojek. Avšak pouze značky, které září červenooranžovou barvou, jak je vidět na obrázku, jsou skutečně naplněny neonem. Značky jiných barev obsahují jiné plyny nebo směsi plynů.
Vědci studovali výraznou růžovou barvu plynového výboje, kterou vytváří plynný vodík. Když úzký paprsek tohoto světla pozorovali přes hranol, světlo se rozdělilo na čtyři čáry velmi specifických vlnových délek (a frekvencí, protože \(\lambda\) a \(\nu\) jsou nepřímo úměrné). Atomové emisní spektrum je vzorec čar, který vznikne, když světlo projde hranolem a rozdělí se na různé frekvence světla, které obsahuje. Následující obrázek ukazuje atomové emisní spektrum vodíku.
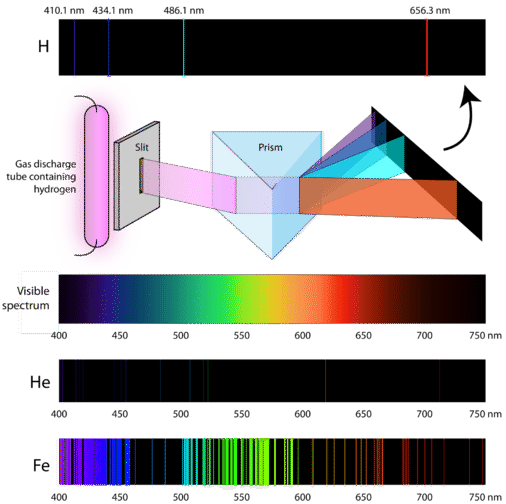
Klasická teorie nebyla schopna vysvětlit existenci atomových emisních spekter, známých také jako čárová emisní spektra. Podle klasické fyziky by atom v základním stavu byl schopen absorbovat libovolné množství energie, nikoli pouze diskrétní množství. Stejně tak, když se atomy uvolní zpět do nižšího energetického stavu, může se uvolnit libovolné množství energie. Výsledkem by bylo tzv. spojité spektrum, v němž jsou zastoupeny všechny vlnové délky a frekvence. Bílé světlo pozorované přes hranol a duha jsou příklady spojitého spektra. Atomová emisní spektra byla dalším důkazem kvantované povahy světla a vedla k novému modelu atomu založenému na kvantové teorii
.