Periodické trendy
Nejprve se zaměříme na jednotlivé atomy a zamyslíme se nad trendy souvisejícími s polohou prvku v periodické tabulce. Jako první modely použijeme jednoduché organické sloučeniny ethan, methylamin a ethanol, ale pojmy platí i pro složitější biomolekuly se stejnými funkcemi, například postranní řetězce aminokyselin alanin (alkan), lysin (amin) a serin (alkohol).
Horizontální periodický trend kyselosti a zásaditosti:
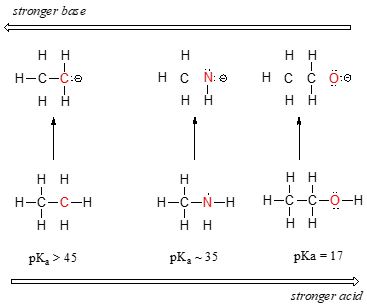
Při pohybu zleva doprava po druhé řadě periodické tabulky od uhlíku přes dusík ke kyslíku můžeme pozorovat jasný trend kyselosti. Klíčem k pochopení tohoto trendu je zvážit hypotetickou konjugovanou zásadu v každém případě: čím stabilnější (slabší) je konjugovaná zásada, tím silnější je kyselina. Podívejte se, kde končí záporný náboj v každé konjugované zásadě. V konjugované bázi ethanu nese záporný náboj atom uhlíku, zatímco v konjugované bázi methylaminu a ethanolu se záporný náboj nachází na dusíku, resp. kyslíku. Z oddílu 2.4A si pamatujte, že elektronegativita se také zvyšuje s postupem zleva doprava po řádku periodické tabulky, což znamená, že kyslík je ze všech tří atomů nejvíce elektronegativní a uhlík nejméně.
Poznámka
Čím je atom elektronegativnější, tím lépe je schopen nést záporný náboj. Slabší báze mají záporné náboje na elektronegativnějších atomech, silnější báze mají záporné náboje na méně elektronegativních atomech.
Methoxidový aniont je tedy nejstabilnější (má nejnižší energii, je nejméně bazický) ze tří konjugovaných bází a ethylkarbaniontový aniont je nejméně stabilní (má nejvyšší energii, je nejvíce bazický). Naopak ethanol je nejsilnější kyselinou a ethan je nejslabší kyselinou.
Při vertikálním pohybu v daném sloupci periodické tabulky opět pozorujeme jasný periodický trend kyselosti. Nejlépe je to vidět na halogenidových kyselinách a halogenidech: zásaditost, stejně jako elektronegativita, se zvyšuje s postupem do vyššího sloupce.
Vertikální periodický trend v kyselosti a zásaditosti:

Naopak kyselost u halokyselin roste, jak se pohybujeme po sloupci dolů.
Abychom tento trend pochopili, budeme se opět zabývat stabilitou konjugovaných zásad. Protože fluor je nejvíce elektronegativní halogenový prvek, mohli bychom očekávat, že fluorid bude také nejméně zásaditý halogenový ion. Ve skutečnosti je však nejméně stabilní a nejbazičtější! Ukazuje se, že při vertikálním pohybu v periodické tabulce převažuje velikost atomu nad jeho elektronegativitou, pokud jde o bazicitu. Atomový poloměr jódu je přibližně dvakrát větší než poloměr fluoru, takže v jodidovém iontu je záporný náboj rozložen na podstatně větší objem:

To ilustruje základní koncept v organické chemii:
Elektrostatické náboje, ať už kladné nebo záporné, jsou stabilnější, když jsou „rozloženy“ na větší plochu.
S touto myšlenkou se budeme setkávat opakovaně během našeho studia organické reaktivity, a to v mnoha různých souvislostech. Prozatím tento koncept aplikujeme pouze na vliv atomového poloměru na sílu báze. Protože fluorid je nejméně stabilní (nejbazičtější) z halogenidových konjugovaných bází, je HF nejméně kyselá z halogenidových kyselin, jen o málo silnější než karboxylová kyselina. HI s \(pK_a\) přibližně -9 je téměř stejně silná jako kyselina sírová.
Pro studium biologické organické chemie je důležitější, že tento trend nám říká, že thioly jsou kyselejší než alkoholy. Například \(pK_a\) thiolové skupiny na postranním řetězci cysteinu je přibližně 8,3, zatímco \(pK_a\) pro alkoholovou skupinu na postranním řetězci serinu je řádově 17.
Pamatujete si pojem „hnací síla“, který byl zaveden v oddíle 6.2? Vzpomeňte si, že hnací síla reakce je obvykle založena na dvou faktorech: relativní stabilitě náboje a relativní celkové energii vazby. Podívejme se, jak to platí pro jednoduchou acidobazickou reakci mezi kyselinou chlorovodíkovou a fluoridovým iontem:
\
Víme, že HCl (\(pK_a\) -7) je silnější kyselina než HF (\(pK_a\) 3).2), takže rovnováha reakce leží na straně produktu: reakce je exergonická a „hnací síla“ tlačí reaktant k produktu.
Co vysvětluje tuto hnací sílu? Uvažujme nejprve faktor náboje: jak jsme se právě dozvěděli, chloridový ion (na straně produktu) je stabilnější než fluoridový ion (na straně reaktantu). To částečně vysvětluje hnací sílu přechodu od reaktantu k produktu v této reakci: přecházíme od méně stabilního iontu ke stabilnějšímu iontu.
Co celková vazebná energie, další faktor hnací síly? Pokud se podíváte do tabulky vazebných energií, zjistíte, že vazba H-F na straně produktu je energeticky silnější (silnější) než vazba H-Cl na straně reaktantu: 570 kJ/mol oproti 432 kJ/mol). To také přispívá k hnací síle: přecházíme od slabší (méně stabilní) vazby k silnější (stabilnější) vazbě.
.