Lipofilita je pravděpodobně nejdůležitější fyzikálně-chemickou vlastností potenciálního léčiva, hraje roli v rozpustnosti, absorpci, průniku do membrán, vazbě na plazmatické proteiny, distribuci, průniku do CNS a rozdělení do jiných tkání nebo orgánů, jako jsou játra, a má vliv na způsoby clearance. Je důležitý při rozpoznávání ligandů, a to nejen k cílovému proteinu, ale také při interakcích s CYP450, vazbě na HERG a indukci enzymů zprostředkovaných PXR.
LogP je součástí Lipinského pravidla 5, pravidla pro předpověď rozpustnosti a propustnosti, které se stalo náhradou za podobnost s léčivem.
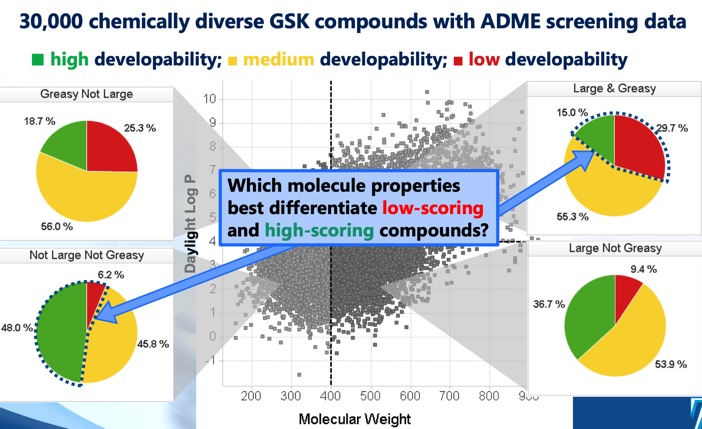
Skóre vyvinutelnosti DOI identifikuje čtyři odlišné oblasti cLog P/molekulová hmotnost, které vymezují optimální a suboptimální chemický prostor, a skóre vyvinutelnosti odvozené z regresních modelů využívajících údaje o rozpustnosti, propustnosti, vazbě na proteiny a screeningu inhibice 3A4. Zatímco sektor MWt <400, cLogP <4 naznačuje největší šanci na úspěch, bylo zjištěno, že i sektor MWt >400, cLogP >4 zahrnuje některé vyvinutelné molekuly, i když s mnohem menší šancí na úspěch.
Nejčastěji používaným měřítkem lipofility je LogP, což je rozdělovací koeficient molekuly mezi vodnou a lipofilní fází, obvykle oktanolem a vodou.
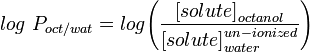
Měření LogP lze provádět různými způsoby, nejběžnější je metoda třepací baňky, která spočívá v tom, že se část dané rozpuštěné látky rozpustí v objemu oktanolu a vody, po určitou dobu se třese a pak se změří koncentrace rozpuštěné látky v každém rozpouštědle. To může být časově náročné, zejména pokud neexistuje rychlá spektroskopická metoda pro měření koncentrace molekuly v jednotlivých fázích. Rychlejší metoda stanovení log P využívá vysokoúčinnou kapalinovou chromatografii. Log P rozpuštěné látky lze určit korelací jejího retenčního času s podobnými sloučeninami se známou hodnotou log P doi.
Výpočet lipofility
Obvykle není praktické experimentálně stanovit logP každé vyrobené sloučeniny (a může být zajímavé vypočítat logP před syntézou), a proto se používají vypočtené výsledky, k dispozici je řada softwarových nástrojů jak stolních, tak online (nepoužívejte pro důvěrné sloučeniny).
Mnohé z těchto aplikací pracují s použitím velkého souboru trénovacích dat se známými hodnotami pro určení příspěvků fragmentů pro dílčí struktury a funkční skupiny, avšak logP není jednoduchá aditivní vlastnost a jsou zapotřebí korekční členy, aby se zohlednily efekty blízkosti, H-vazby, elektronické efekty atd. jak je uvedeno v příkladech níže.
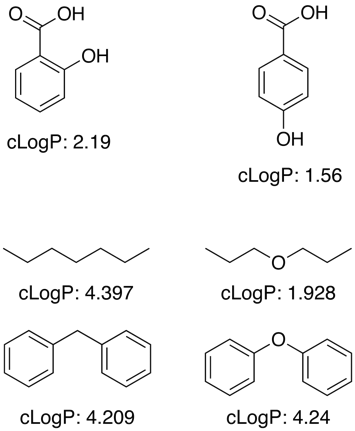
Pro neznámé funkční skupiny programy často aproximují pomocí příspěvků jednotlivých atomů.
Různé metodiky výpočtu logP lze rozdělit do tří různých přístupů.
Atomové (např. „AlogP“, ) & Rozšířené atomové / hybridní („XlogP“, „SlogP“)
Fragmentové („ClogP“, KlogP, ACD/logP)
Metody založené na vlastnostech („MlogP“, „VlogP“, „MClogP“, „TlogP“)
Atomický logP uvažuje, že každý atom má příspěvek k logP a že příspěvky ke konečné hodnotě jsou čistě aditivní. Je však zřejmé, že dusík v amidu se liší od dusíku v aminu nebo pyridinu, rozšířený Atomic bere v úvahu typ atomu.
Fragmentové metody používají velký soubor trénovacích dat známých hodnot k určení příspěvků fragmentů pro dílčí struktury a funkční skupiny spolu s korekčními členy k zohlednění efektů blízkosti. Tyto metody se často vracejí k atomovým modelům pro nové funkční skupiny.
Metody založené na vlastnostech bývají výpočetně náročné a nejsou příliš vhodné pro testování velkých souborů dat.
Protože se trénovací soubory a algoritmy v jednotlivých aplikacích liší, je velmi důležité nekombinovat vypočtené výsledky pomocí různých nástrojů.
Některé nástroje umožňují uživateli rozšířit trénovací sadu pomocí vlastních naměřených hodnot, což může být rozhodující při zkoumání nových funkčních skupin nebo scaffoldů.
LogD
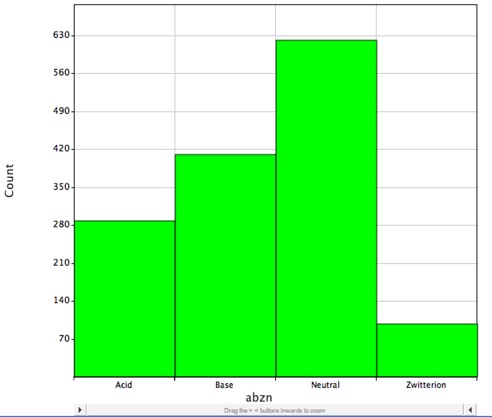
Většina známých léčiv však obsahuje ionizovatelné skupiny, jak ukazuje histogram níže, ten ukazuje distribuci malých molekul léčiv s DrugBank a pravděpodobně jsou při fyziologickém pH nabité a LogP správně popisuje pouze rozdělovací koeficient neutrálních (nenabitých) molekul.
LogD distribuční konstanta lépe popisuje lipofilitu molekuly. Lze ji stanovit podobně jako LogP, ale místo vody se vodná fáze upraví na určité pH pomocí pufru. Log D je tedy závislý na pH, a proto je třeba uvést pH, při kterém byl log D změřen. Zvláště zajímavý je log D při pH = 7,4 (fyziologické pH krevního séra).
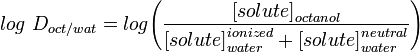
Aplikace jako Marvin umožňují uživateli vypočítat log D, ale také zobrazit profil distribuce pH, jak je uvedeno níže pro Warfarin.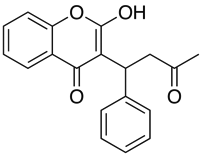
U sloučenin s pKa blízkým fyziologickému pH může být rozhodující zvážit, jaká může být ve skutečnosti převažující ionizovaná forma.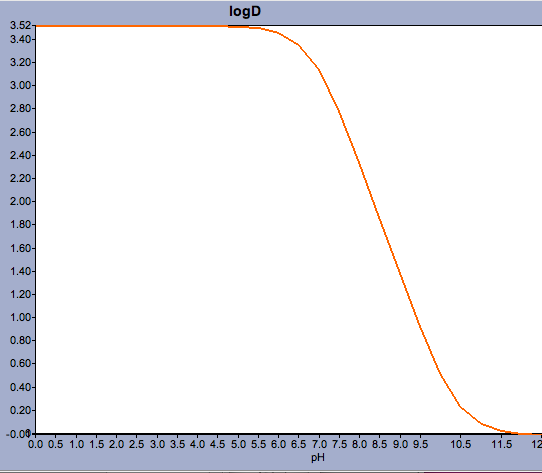
To může být cenné i při úvahách o absorpci z různých oblastí trávicí trubice, kde se pH pohybuje od 1-3 v žaludku po 7-8 v ileu.
Příspěvky různých funkčních skupin k LogD byly zkoumány „LogD contributions of substituents commonly used in medicinal chemistry“ DOI, tato studie použila analýzu odpovídajících molekulárních párů experimentálních hodnot LogD z několika tisíc sloučenin získaných metodou shake-flask při pH = 7,4. „LogD contributions of substituents commonly used in medicinal chemistry“. Uváděli průměrný rozdíl deltaLogD pro jednotlivé molekulové páry a výsledky jsou uvedeny níže pro případ, kdy se funkční skupina nachází v libovolné poloze na fenylovém kruhu. Přiložil jsem také vypočtené LogD pomocí softwaru Chemaxon.
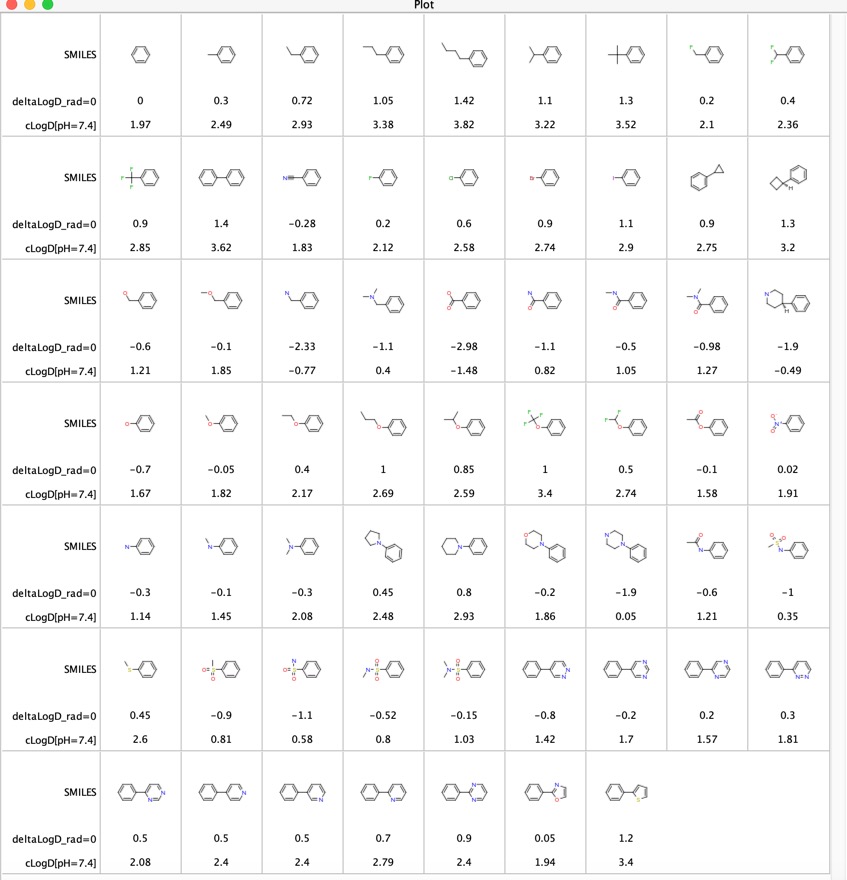
Tato tabulka je užitečná pro porovnání funkčních skupin, zejména posledních 11 položek porovnává vliv různých heterocyklů na LogD. Tyto heterocykly se často používají jako bioizosterické náhrady fenylového kruhu.
Myslel jsem si, že by mohlo být zajímavé porovnat rozdíly LogD určené pomocí odpovídajících molekulových párů (deltaLogD_rad=0) s hodnotami určenými pomocí Chemaxonem vypočteného LogD (deltacLogD). Jak můžete vidět níže, je zde docela dobrá shoda.
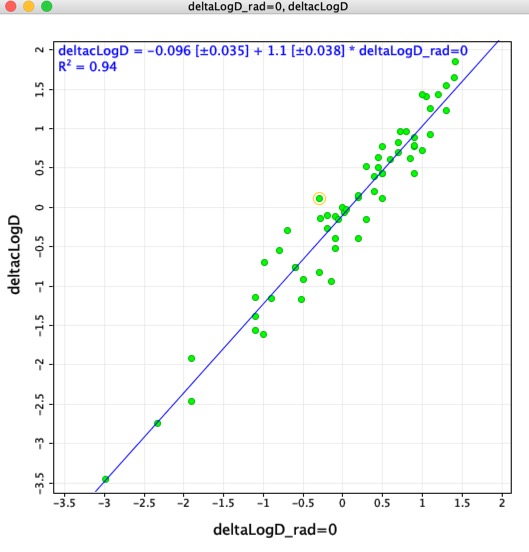
Pamatujte Protože se trénovací sady a algoritmy v jednotlivých aplikacích liší, je velmi důležité nekombinovat výsledky vypočtené pomocí různých nástrojů.
Je důležité být obezřetný, aby jakékoli zlepšení vazebné afinity nebylo zcela způsobeno zvýšením LogD, často je užitečné jednoduše vykreslit vazebnou afinitu versus LogD. Zajímavější modifikace sloučenin nejsou nutně ty, které poskytují největší zvýšení afinity, ale mohou to být ty, které poskytují zvýšení afinity bez odpovídajícího zvýšení lipofility. Při pohledu na níže uvedenou tabulku je zde řada sloučenin s velmi vysokou afinitou.
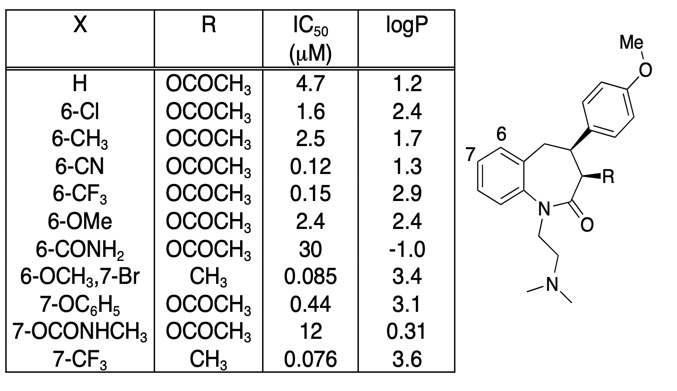
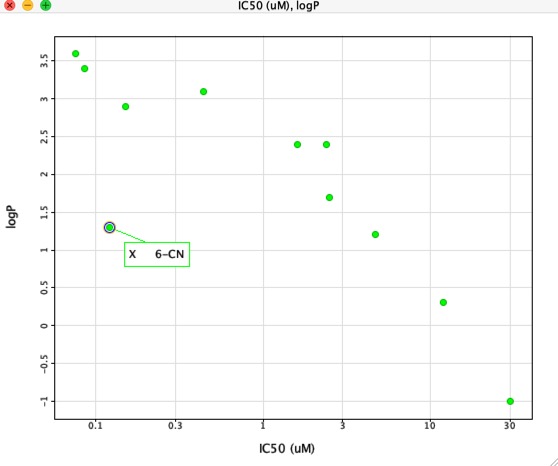
Pokud však vyneseme graf IC50 versus LogP, jak je uvedeno níže, je zde velmi jasná korelace mezi LogP a IC50, avšak jedna sloučenina se zřetelně liší. Substituent 6-CN poskytuje zvýšení afinity bez odpovídajícího zvýšení LogP.
Lipofilita je také důležitou složkou mnoho z off-target závazků, včetně vazby na plazmatické bílkoviny (zejména albumin), HERG, interakce s CYP, transportéry, má silnou korelaci s lipofilitou a existuje řada studií, které spojují vysoký LogP s pravděpodobností neúspěchu sloučenin při vývoji v důsledku špatných vlastností ADMET (absorpce, distribuce, metabolismus, vylučování a toxicita). Naproti tomu je často zřejmé, že k dosažení rozumné úrovně afinity je nutná určitá velikost a lipofilita. Vyvážení těchto požadavků je klíčovou výzvou při objevování léčiv a chemici by se měli zaměřit na sladkou oblast MWt 250-500 a LogP 2-4. Jedním z důsledků tohoto přístupu je potřeba upřednostnit při screeningu nízkomolekulární, méně lipofilní sloučeniny. Lékařská chemie by se měla zpočátku zaměřit na výběr kvalitních výchozích látek a následně na účinnou kontrolu posunů fyzikálně-chemických vlastností během procesu optimalizace.
Zajímavé čtení
Finding the sweet spot: the role of nature and nurture in medicinal chemistry DOI
Lipophilic efficiency: the most important efficiency metric in medicinal chemistry DOI
Poslední aktualizace 12. ledna 2019
.