Strukturální nestabilita enzymů
Skutečnost, že aktivní místa jsou tak dobře uzpůsobena k zajištění specifických podmínek prostředí, také znamená, že podléhají vlivům místního prostředí. Je pravda, že zvýšení teploty prostředí obecně zvyšuje rychlost reakcí, ať už enzymově katalyzovaných nebo jiných. Zvýšení nebo snížení teploty mimo optimální rozsah však může ovlivnit chemické vazby v aktivním místě tak, že jsou méně vhodné pro vazbu substrátů. Vysoké teploty nakonec způsobí, že enzymy, stejně jako jiné biologické molekuly, denaturují, což je proces, který mění přirozené vlastnosti látky. Podobně může funkci enzymů ovlivnit i pH místního prostředí. Aminokyselinové zbytky v aktivním místě mají své vlastní kyselé nebo zásadité vlastnosti, které jsou optimální pro katalýzu. Tyto zbytky jsou citlivé na změny pH, které mohou zhoršit způsob vazby molekul substrátu. Enzymy jsou uzpůsobeny k tomu, aby nejlépe fungovaly v určitém rozmezí pH, a stejně jako v případě teploty mohou extrémní hodnoty pH (kyselé nebo zásadité) prostředí způsobit denaturaci enzymů.
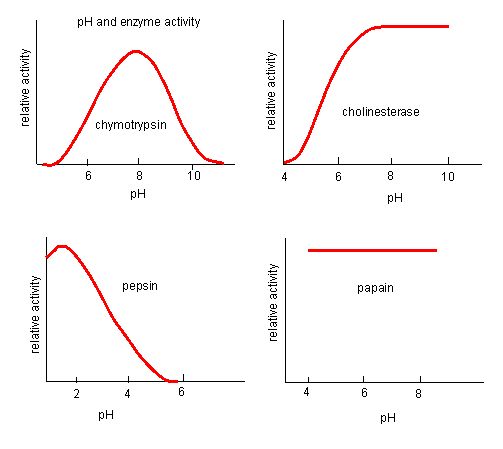
Obrázek 4. Jaké jsou hodnoty pH? Enzymy mají optimální pH. pH, při kterém je enzym nejaktivnější, bude pH, při kterém jsou skupiny R aktivního místa protonovány/deprotonovány tak, že substrát může vstoupit do aktivního místa a může začít počáteční krok reakce. Některé enzymy vyžadují velmi nízké pH (kyselé), aby byly zcela aktivní. V lidském těle se tyto enzymy s největší pravděpodobností nacházejí v dolní části žaludku nebo jsou umístěny v lysozomech (buněčná organela sloužící k trávení velkých sloučenin uvnitř buňky).
Zdroj: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Proces, při kterém enzymy denaturují, obvykle začíná rozvolněním terciární struktury destabilizací vazeb, které drží terciární strukturu pohromadě. Vodíkové vazby, iontové vazby a kovalentní vazby (disulfidové můstky a peptidové vazby) mohou být narušeny velkými změnami teploty a pH. Na základě níže uvedeného grafu aktivity enzymů a teploty sestavte energetický příběh pro červený enzym. Vysvětlete, co by se mohlo dít při teplotách od 37 °C do 95 °C.
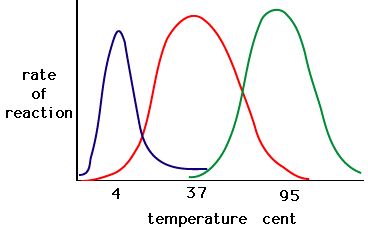
Obrázek 5. Enzymy mají optimální teplotu. Teplota, při které je enzym nejaktivnější, bude obvykle teplota, při které je struktura enzymu stabilní nebo neporušená. Některé enzymy vyžadují určitou teplotu, aby zůstaly aktivní a nedenaturovaly. Zdroj: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Indukované uložení a funkce enzymu
Po mnoho let se vědci domnívali, že vazba enzymu a substrátu probíhá jednoduchým způsobem „zámek a klíč“. Tento model tvrdil, že enzym a substrát do sebe dokonale zapadají v jednom okamžitém kroku. Současný výzkum však podporuje sofistikovanější pohled, který se nazývá indukované spojení. Model indukované shody rozšiřuje model „lock-and-key“ tím, že popisuje dynamičtější interakci mezi enzymem a substrátem. Když se enzym a substrát spojí, jejich interakce způsobí mírný posun ve struktuře enzymu, který potvrdí produktivnější vazebné uspořádání mezi enzymem a přechodným stavem substrátu. Tato energeticky výhodná vazba maximalizuje schopnost enzymu katalyzovat svou reakci.
Když enzym naváže svůj substrát, vytvoří se komplex enzym-substrát. Tento komplex snižuje aktivační energii reakce a podporuje její rychlý průběh jedním z mnoha způsobů. Na základní úrovni enzymy podporují chemické reakce, které zahrnují více než jeden substrát, tím, že substráty spojují v optimální orientaci. Vhodná oblast (atomy a vazby) jedné molekuly je postavena vedle vhodné oblasti druhé molekuly, s níž musí reagovat. Dalším způsobem, jak enzymy podporují reakci svých substrátů, je vytvoření energeticky příznivého prostředí v aktivním místě pro průběh reakce. Některé chemické reakce mohou nejlépe probíhat v mírně kyselém nebo nepolárním prostředí. Chemické vlastnosti, které vyplývají z konkrétního uspořádání aminokyselinových zbytků v aktivním místě, vytvářejí energeticky příznivé prostředí pro reakci specifických substrátů enzymu.
Aktivační energie potřebná pro mnoho reakcí zahrnuje energii spojenou s mírným zkroucením chemických vazeb tak, aby mohly snadněji reagovat. Enzymatické působení může tomuto procesu napomoci. Komplex enzym-substrát může snížit aktivační energii tím, že zkroutí molekuly substrátu tak, že usnadní přerušení vazby. Nakonec mohou enzymy snížit aktivační energii také tím, že se účastní samotné chemické reakce. Aminokyselinové zbytky mohou poskytovat určité ionty nebo chemické skupiny, které skutečně tvoří kovalentní vazby s molekulami substrátu jako nezbytný krok reakčního procesu. V těchto případech je důležité si uvědomit, že enzym se po dokončení reakce vždy vrátí do původního stavu. Jednou z charakteristických vlastností enzymů je, že reakce, které katalyzují, zůstávají v konečném důsledku nezměněny. Poté, co enzym ukončí katalýzu reakce, uvolní svůj produkt (své produkty).
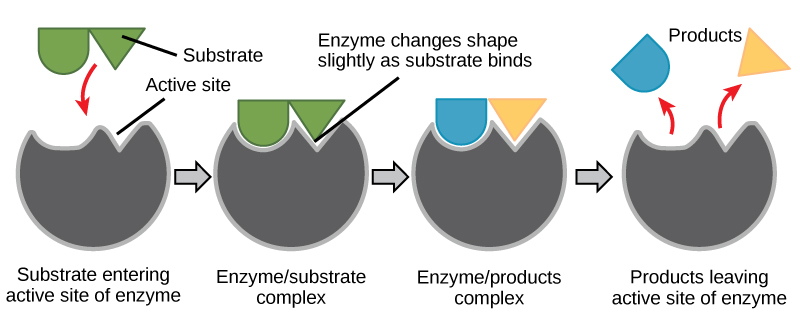
Obrázek 6: Jaký je stav enzymu? Podle modelu indukovaného přizpůsobení prochází enzym i substrát po navázání dynamickými konformačními změnami. Enzym konformuje substrát do svého přechodného stavu, čímž zvyšuje rychlost reakce.
Vytvořte energetický příběh pro výše uvedenou reakci
Na základě obrázku 6 odpovězte na otázky uvedené v energetickém příběhu.
1. Jaké jsou reaktanty? Jaké jsou produkty?
2. Jakou práci vykonal enzym?
3. V jakém stavu je energie na počátku? Do jakého stavu se energie přeměnila v konečném stavu? Tohle může být ještě záludné, ale zkuste určit, kde je energie v počátečním a konečném stavu.
.