Fotoheterotrofové vytvářejí ATP pomocí světla, a to jedním ze dvou způsobů: používají reakční centrum na bázi bakteriochlorofylu nebo bakteriorhodopsin. Mechanismus založený na chlorofylu je podobný mechanismu používanému při fotosyntéze, kdy světlo excituje molekuly v reakčním centru a způsobuje tok elektronů přes elektronový transportní řetězec (ETS). Tento tok elektronů přes bílkoviny způsobuje přečerpávání vodíkových iontů přes membránu. Energie uložená v tomto protonovém gradientu se využívá k syntéze ATP. Na rozdíl od fotoautotrofů proudí elektrony pouze cyklicky: elektrony uvolněné z reakčního centra protékají ETS a vracejí se do reakčního centra. Nejsou využívány k redukci organických sloučenin. Fialové nesirné bakterie, zelené nesirné bakterie a heliobakterie jsou příklady bakterií, které provádějí toto schéma fotoheterotrofie.
Jiné organismy, včetně halobakterií a flavobakterií a vibrií, mají protonové pumpy na bázi fialového rodopsinu, které doplňují jejich zásobování energií. Archeální verze se nazývá bakteriorhodopsin, zatímco eubakteriální verze se nazývá proteorhodopsin. Čerpadlo se skládá z jediného proteinu navázaného na derivát vitaminu A, retinal. Čerpadlo může mít s bílkovinou spojené přídavné pigmenty (např. karotenoidy). Když je světlo absorbováno molekulou retinalu, molekula izomerizuje. To způsobí, že protein změní tvar a přečerpá proton přes membránu. Gradient vodíkových iontů pak může být využit k výrobě ATP, transportu rozpuštěných látek přes membránu nebo k pohonu bičíkového motoru. Jedna konkrétní flavobakterie nemůže redukovat oxid uhličitý pomocí světla, ale využívá energii ze svého rodopsinového systému k fixaci oxidu uhličitého prostřednictvím anaplerotické fixace. Tato flavobakterie je stále heterotrof, protože ke svému životu potřebuje redukované sloučeniny uhlíku a nemůže se živit pouze světlem a CO2. Nemůže provádět reakce ve formě
n CO2 + 2n H2D + fotony → (CH2O)n + 2n D + n H2O,
kde H2D může být voda, H2S nebo jiná sloučenina/sloučeniny poskytující redukční elektrony a protony; dvojice 2D + H2O představuje oxidovanou formu.
Může však vázat uhlík v reakcích jako:
CO2 + pyruvát + ATP (z fotonů) → malát + ADP +Pi
kde se malát nebo jiné užitečné molekuly jinak získávají rozkladem jiných sloučenin
sacharid + O2 → malát + CO2 + energie.
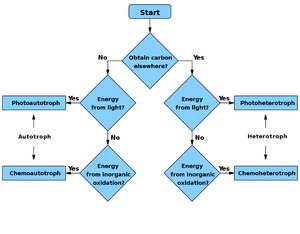
Tento způsob fixace uhlíku je užitečný, když je redukovaných sloučenin uhlíku málo a nemohou být zmařeny jako CO2 při interkonverzích, ale energie je dostatek ve formě slunečního světla.
.