Ačkoli byla dengue kdysi periodickým onemocněním, které způsobovalo dlouhodobé epidemie, dnes je považována za nejvýznamnější virové onemocnění přenášené komáry na světě . Ročně je na celém světě zaznamenáno přibližně padesát až sto milionů případů horečky dengue . Půl milionu z těchto případů vyústí v nejtěžší formu horečky dengue (DF) známou jako hemoragická horečka dengue (DHF) . DHF je onemocnění, které postihuje převážně děti mladší 15 let a je charakterizováno náhlým nástupem horečky, trombocytopenií a syndromem cévního úniku . DHF vzniká v důsledku infekce virem dengue, který patří do čeledi Flaviviridae . Virus je ikosaedrická, obalená, jednovláknová RNA s pozitivním smyslem . Jádro ikosaedru má průměr čtyřicet až padesát nanometrů a obsahuje protein C, který obaluje virový genom . Jádro obklopují dva virové proteiny M a E, které tvoří lipidový obal . Infekci způsobuje jeden ze čtyř sérotypů viru dengue (DENV): DENV-1, DENV-2, DENV-3 a DENV-4 . Infekce jedním ze sérotypů nezajišťuje imunitu proti infekci ostatními sérotypy .
Pokud se člověk, který byl dříve infikován, nakazí znovu, má zvýšené riziko vzniku šokového syndromu dengue (DSS) a DHF, což má za následek oslabení a prasknutí cév a vnitřní krvácení . Neneutralizační protilátky mohou zvýšit vychytávání viru buňkami, které exprimují Fc receptory, což umožňuje na protilátkách závislé zesílení DHF . Různé druhy komárů rodu Aedes jsou přenašeči viru dengue a přenášejí virus kousnutím lidského hostitele . Hlavním přenašečem je Aedes aegypti; malý, černobílý, tropický a subtropický komár, který se vyskytuje ve Střední Americe, Latinské Americe, jihovýchodní Asii a západním Pacifiku .
Epidemiologie
Dnes je DHF mezinárodně považována za nejvýznamnější virové onemocnění přenášené komáry. Endemicky se vyskytuje ve více než 100 zemích světa, zejména v tropických a subtropických oblastech . Ve Spojených státech se druh Aedes aegyptispecies způsobující DHF vyskytuje sezónně v Louisianě, na jihu Floridy, v Novém Mexiku, Arizoně, Texasu, Georgii, Alabamě, Mississippi, Severní a Jižní Karolíně, Kentucky, Oklahomě a Tennessee . Za posledních 50 let se výskyt horečky dengue zvýšil 30krát .
Podle Světové zdravotnické organizace (WHO) se odhaduje, že ročně dojde k 50 až 100 milionům případů nákazy horečkou dengue. Z těchto případů 500 000 přechází do DHF, což má za následek 22 000 úmrtí, většinou dětí . Na základě oficiálních údajů předložených WHO přesáhl počet případů horečky dengue v Americe, jihovýchodní Asii a západním Pacifiku 1,2 milionu v roce 2008 a více než 3 miliony v roce 2013. V roce 2013 bylo jen v Severní a Jižní Americe hlášeno 2,35 milionu případů horečky dengue, z toho 37 687 případů DHF . Po první známé epidemii DHF v letech 1953 až 1954 na Filipínách se nemoc dále šířila po celé jihovýchodní Asii .
V průběhu 50., 60. a většiny 70. let 20. století byla epidemie dengue ve většině Jižní a Střední Ameriky vzácná, protože primární komáří vektor, Aedes aegypti, byl eradikován. Jakmile však byla deratizace zastavena, Aedes aegypti začal tyto oblasti znovu obsazovat. V roce 1997 se Aedes aegypti a virus dengue opět rozšířily po celém světě , (obr. 1,2). podle WHO nyní žije v oblastech s endemickým výskytem horečky dengue/DHF více než 2,5 miliardy lidí, kteří jsou ohroženi nákazou virem dengue. K přenosu viru prostřednictvím Aedes aegypti přispívá několik faktorů; mezi ně patří teplota, srážky, migrace z venkova do měst, růst populace, skladovaná voda, nárůst pevného odpadu, který umožňuje vznik larválních stanovišť pro vektory . Mohou se také vyskytnout ohniska DHF spojená s cestováním. Horečka dengue je celosvětově nejrozšířenější arbovirovou infekcí .
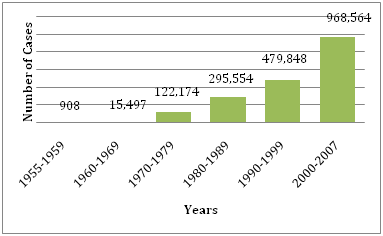
Obrázek 1: Průměrný počet DF/DHF hlášených WHO v uvedených letech .
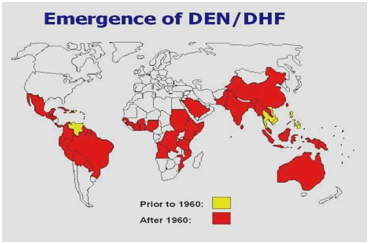
Obrázek 2: Rozšíření horečky dengue/hemoragické horečky dengue v Americe, Karibiku, Africe a na Středním východě.
Rizikové faktory DF a přenosu viru dengue
Horečka dengue je významné virové onemocnění přenášené členovci . Výzkumy ukazují, že komáři rodu Aedes, především Aedes aegypti a Aedes albopictus, se přizpůsobili životu v blízkosti oblastí lidských obydlí a jsou zodpovědní za přenos horečky dengue. Komáři se živí přes den a dávají přednost lidem před jinými živočichy . Komár Aedes aegypti má nejvyšší podíl krve, kterou se živí lidé, a to 76,9 %, následují komáři Aedes albopictus se 75 % a Aedes vittatus s 33,3 % . Výskyt DF souvisí s množstvím vegetace, stromovým pokryvem, kvalitou obydlí a okolní rozlohou .
Společně s lidmi vytvořenými místy rozmnožování bylo prokázáno, že ekologii horečky dengue ovlivňuje také klima, které ovlivňuje dynamiku vektorů, vývoj původců a interakci mezi komáry a lidmi.13 Teplota pomáhá ovlivňovat rychlost vývoje vektorů, jejich úmrtnost, chování a řídí replikaci viru ve vektoru. Teplé podnebí umožňuje vývoj larev a zvýšenou rychlost replikace viru, zatímco chladné podnebí zpomaluje vývoj viru a zkracuje dobu přežití komárů, čímž snižuje možnost infekčního přenašeče a snižuje přenos horečky dengue . Teplota také spolupůsobí se srážkami jako hlavní regulátor výparu, čímž přímo ovlivňuje dostupnost vodních stanovišť a nepřímo ovlivňuje půdní pokryv a využití půdy, což může podporovat nebo brzdit růst populací přenašečů .
Demografické a sociální změny, jako je populační růst, urbanizace a moderní doprava, významně přispívají ke zvýšení výskytu a geografickému rozšíření aktivity horečky dengue . Vzhledem k tomu, že se cestující přesouvají z endemických oblastí, mají tendenci sloužit jako prostředek dalšího šíření . Virulence virového kmene a genetická variabilita viru dengue rovněž přispívají k většímu potenciálu epidemického přenosu DHF .
Patogeneze hemoragické horečky dengue
Když se komár živí lidským hostitelem, vpravuje virus dengue (DENV) do krevního oběhu a okolní epidermis a dermis. Výsledkem je infekce nezralých Langerhansových buněk a keratinocytů prostřednictvím receptorem zprostředkované endocytózy . E protein, povrchový protein, je rekonfigurován a umožňuje fúzi membrán a uvolnění virové RNA do infikované buňky. Nestrukturální proteiny NS1 a NS2A řídí replikaci virové RNA a NS1 se může také podílet na aktivaci kaskády komplementu . Infikované buňky pak mohou zemřít apoptózou nebo nekrózou nebo migrovat do lymfatických uzlin, kde se rekrutují makrofágy (obrázek 3). Infekce některým ze čtyř sérotypů horečky dengue (DENV-1 až DENV-4) může být ve většině případů asymptomatická, protože imunitní systém hostitele je schopen ji lokálně neutralizovat, ale může také způsobit spektrum klinických projevů, přičemž nejzávažnější formou je DHF, která může přejít v DSS a smrt . DHF je klinicky definována jako nepřetržitá horečka trvající 2 až 7 dní se slizničními nebo kožními krvácivými projevy spojenými s trombocytopenií (<100 000 buněk/mm3) a hematokritem vyšším než 20 % nad výchozí hodnotou pacienta nebo stejně staré populace . Patologickými znaky DHF jsou únik plazmy z pleurálních nebo peritoneálních povrchů a vnitřní koagulopatie, která se klinicky měří buď pozitivním turniketovým testem, nebo průkazem spontánního krvácení, jako jsou petechie nebo ekchymózy, krvácení z dásní nebo epistaxe nebo krvácení z gastrointestinálního traktu .

Obrázek 3: Po kousnutí komárem přenašečem Aedes aegypti jsou nezralé Langerhansovy buňky a keratinocyty infikovány DENV. Infikované buňky se poté přesunou dolů do lymfy, kde se rekrutují makrofágy . Odtud se infekce šíří do různých orgánů, včetně jater, sleziny a kostní dřeně. Nekróza kostní dřeně způsobená DENV může vést k potlačení krvetvorby a snížení trombogeneze v krvi . Zánětlivá reakce způsobená uvolňováním chemokinů a cytokinů z žírných buněk, makrofágů a lymfocytů způsobuje zvýšenou propustnost cév, dysfunkci krevních destiček a trombocytopenii a únik plazmy . Ačkoli mechanismus není dobře objasněn, zdá se, že tato kaskáda také způsobuje spontánní krvácení, což vede ke klinickým projevům petechií, krvácení z dásní a krvácení do zažívacího traktu .
Tato závažná forma onemocnění je často důsledkem sekundární infekce, kdy je hostitel infikován druhým sérotypem a dochází ke složité interakci mezi virem a imunitní odpovědí hostitele . Ačkoli mechanismus, který tuto reakci způsobuje, není dobře znám, důkazy naznačují, že předchozí infekce může vytvořit zkříženě reagující protilátky, které vážou nový sérotyp, ale nejsou schopny ho neutralizovat . Tato teorie se nazývá teorie protilátkově závislého zesílení (antibody-dependent enhancement, ADE) . Předpokládá se, že protilátky vytvořené během předchozích infekcí proti strukturálním proteinům DENV, jako je protein E nebo prM, nejsou schopny neutralizovat nový patogen a místo toho vedou ke zvýšené vazbě na Fcγ receptor pozitivní buňky umožňující zesílenou replikaci viru . V reakci na to imunitní systém uvolňuje přehnanou cytokinovou odpověď, což vede ke zvýšené cévní propustnosti a koagulopatii .
Mastické buňky se rovněž podílejí na patogenezi DHF. V některých případech se zdá, že žírné buňky zajišťují ochrannou funkci, kdy se při de-granulaci uvolňují antivirové molekuly a rekrutují se další imunitní buňky, jako jsou T-lymfocyty a buňky přirozených zabíječů (NK), které pomáhají virus neutralizovat . V jiných případech však místní kontrolní mechanismy nedokážou virus zadržet a ten se šíří krevním oběhem nebo lymfatickým systémem, aby aktivoval žírné buňky v jiných orgánech, jako jsou játra, slezina a lymfatické uzliny . Při de-granulaci v těchto orgánech dochází k uvolňování proteáz a syntéze zánětlivých mediátorů, jako jsou leukotrieny a vaskulární endoteliální růstový faktor (VEGF), což zvyšuje propustnost kapilár a vede k úniku plazmy . To je důležité, protože různé skupiny žírných buněk uvolňují během procesu de-granulace odlišné mediátory . Komplex virus-protilátka, možná prostřednictvím antigenu NS1 viru dengue, a produkce cytokinů rovněž vede k aktivaci komplementu. Je známo, že uvolňování fragmentů C3a a C5a zvyšuje permeabilitu cév a přispívá tak k úniku plazmy .
Typ a množství uvolňovaných cytokinů hraje důležitou roli při určování závažnosti onemocnění. Makrofágový zánětlivý protein 1β (MIP-1β) se zdá být ukazatelem méně závažného onemocnění, protože je uvolňován infikovanými mononukleárními buňkami a aktivovanými NK buňkami. Působí jako chemický atraktant pro další NK buňky, láká je do místa zánětu, omezuje replikaci viru a následný cytokinový účinek. Na druhé straně bylo prokázáno, že interferon γ (IFN-γ) vyvolává únik plazmy a zvyšuje vychytávání částic horečky dengue prostřednictvím zvýšení Fc receptorů na cílových buňkách, a proto je spojen se závažnějšími klinickými projevy a špatnou prognózou . Mezi další cytokiny, u nichž bylo zjištěno zvýšení u DHF a které se podílejí na indukci úniku plazmy, patří interleukin 2 (IL-2), tumor nekrotizující faktor α (TNF- α), faktor inhibující migraci makrofágů (MIF), monocytární chemotaktický protein-1 (MCP-1), interleukin-8 (IL-8) a high mobility group box-1 (HMGB-1) . Účinky uvolňování cytokinů se neomezují pouze na vaskulární permeabilitu a únik plazmy, ale podílejí se také na hemoragických projevech DHF. Základní mechanismus, který způsobuje krvácení u DHF, však není dostatečně objasněn. Ačkoli většina infikovaných buněk je náchylná k zániku apoptózou, dochází k určité nekróze, která vede k uvolnění toxinů, jež aktivují koagulační systém a systém fibrinolýzy. Když se v kostní dřeni objeví vysoká míra nekrózy v důsledku vysoké virové nálože, dochází k útlumu krvetvorby, což vede k trombolyticképenii . Výsledný pokles trombogeneze a dysfunkce krevních destiček může způsobit křehkost kapilár a z toho vyplývající klinické projevy pozorované u DHF . Některé studie naznačují, že zapojení jater při infekci DENV se může podílet na spontánní krvácivé tendenci, přičemž existuje korelace mezi zvýšenými hladinami jaterních enzymů a zvýšenou tendencí ke krvácení .
Klinické příznaky a symptomy
Klinické projevy onemocnění zahrnují asymptomatickou infekci, mírnou horečku dengue (DF), hemoragickou horečku dengue (DHF) nebo šokový syndrom dengue (DSS), který je často závažný v důsledku abnormální kapilární permeability a úniku plazmy . Těžká dengue se obvykle vyskytuje u pacientů, kteří byli již dříve infikováni virem dengue (tj. sekundární infekce). Vysoký výskyt těžké infekce dengue byl zaznamenán také u kojenců s primární infekcí virem dengue, které porodily matky, jež byly dříve infikovány virem dengue .
Počáteční fáze DHF se projevuje jako horečka dengue. Symptomatologie této počáteční fáze závisí na věku pacienta a zahrnuje náhlou vysokou horečku (někdy se dvěma vrcholy – sedlem vzadu), silné bolesti hlavy, sníženou chuť k jídlu, těžké myalgie a artralgie, makulopapulózní kožní vyrážku, která se objevuje tři až čtyři dny po počátečním nástupu horečky, retroorbitální bolest, fotofobii, lymfadenopatii, mírné krvácení (epistaxe, krvácení z dásní, gastrointestinální krvácení, hematurie a menoragie) a pozitivní turniketový test. Případy DHF jsou charakterizovány čtyřmi hlavními klinickými projevy, kterými jsou vysoká horečka, hemoragické jevy a často také hepatomegalie a oběhové selhání. Akutní horečnaté onemocnění charakteristické pro počáteční fázi spočívá v teplotách vyšších než 39 °C, které přetrvávají 2-7 dní.
Výše uvedené příznaky počáteční fáze se postupně zhoršují s pokračující horečkou a bolestí hlavy, silnou bolestí nebo citlivostí břicha, přetrvávajícím zvracením, hematemezou, melénou, petechiemi, snadnou tvorbou modřin, neklidem, letargií, ospalostí, podrážděností, krvácením nebo modřinami pod kůží . Po 2-7denní horečce je rychlý pokles teploty často doprovázen známkami poruchy krevního oběhu různé závažnosti. Pacient se může potit, být neklidný, mít chladné končetiny a vykazovat změny tepové frekvence a krevního tlaku. Po 24-48 hodinách od začátku specifických rysů DHF jsou pozorovány abnormální hemostáza a únik plazmy jako charakteristické příznaky.
Dobrým ukazatelem těchto pokroků je zvětšení jater o více než 2 cm, protože hepatomegalie obvykle předchází úniku plazmy . Mnoho pacientů se zotaví s léčbou tekutinami a elektrolyty nebo bez ní. V závažných případech může ztráta plazmy přejít v šok a smrt, pokud není léčena . Výzkum naznačuje, že jak sekundární infekce horečkou dengue, tak přehnaná odvetná reakce cytokinového imunitního systému zvyšují náchylnost pacienta k rozvoji DHF .
Předpokládá se, že virové produkty, jako je glykoprotein NS1, ovlivňují aktivaci komplementu a cévní permeabilitu, což vede k úniku plazmy, který se vyvíjí v ascites nebo pleurální výpotek . Cytokinová reakce je také zodpovědná za zvýšení cévní propustnosti, v důsledku čehož se snižuje intravaskulární onkotický tlak a usnadňuje ztrátu tekutiny do mimotělních oddílů , (obr. 4). Abnormální hemostáza se skládá z trombocytopenie současně se zvýšením hematokritu , prodlouženého parciálního tromboplastinového času se sníženou koncentrací fibrinogenu, spolu s již zmíněnými petechiemi, závažným gastrointestinálním krvácením, ekchymózou a epistaxí .
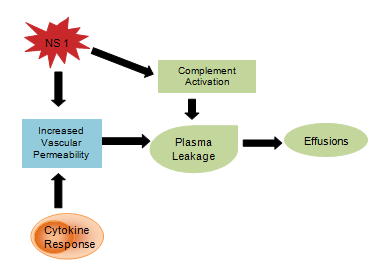
Obrázek 4: Cytokinová odpověď imunitního systému.
Předpokládá se, že během febrilní viremické fáze DHF dochází k trombocytopenii a následným projevům v důsledku suprese kostní dřeně. Jak již bylo uvedeno, suprese kostní dřeně je důsledkem toho, že je místem replikace viru a specificky napadá hematopoetické progenitorové buňky , avšak imunitně zprostředkovaná destrukce krevních destiček byla rovněž naznačena objevem komplexů viru a protilátek nalezených na povrchu krevních destiček pacientů s DHF.
Mezi neobvyklé klinické projevy patří akutní hepatitida, jaterní selhání, akutní selhání ledvin, encefalopatie nebo kardiomyopatie (akutní myokarditida) . Studie o fatální DHF u dospělých se zabývala jinými příčinami úmrtí než syndromem šoku z dengue (DSS) u pacientů s těžkou formou dengue a dospěla k závěru, že hypotermie, leukocytóza a bandémie mohou být spouštěcími příznaky těžké formy dengue. Studie dále radí klinickým lékařům, aby si byli vědomi možného rozvoje masivního krvácení do zažívacího traktu, zejména u pacientů s časnou změnou vědomí, hlubokou trombocytopenií, prodlouženým PT a/nebo leukocytózou .
Diagnostika, léčba a management
Včasná a přesná diagnóza je rozhodující pro správnou klinickou péči. Existuje mnoho metod, kterými lze diagnózu dengue stanovit. Diagnózu lze provést izolací viru, virové nukleové kyseliny, protilátek a antigenů nebo kombinací všech těchto technik. Detekce viru dengue pomocí kultivace je definitivním diagnostickým testem, ale praktické hledisko omezuje jeho použití. Detekce virové RNA je rychlejší, ale kontaminace může vést k falešně pozitivnímu výsledku. Také sérologický test může poskytnout falešně pozitivní výsledek v důsledku zkříženě reagujících protilátek .
Akutní infekce jsou detekovány v séru, plazmě a cirkulujících krevních buňkách během časné rekonvalescentní fáze, což je počátečních 5-8 dní příznaků. V této době může být primární virová nálož až103 částic RNA/ml nebo vyšší než 106 částic RNA/ml u sekundárních infekcí . V současné době se k diagnostice stále častěji používá kombinace testů na antigen NS1 a protilátky a také molekulární metody, jako je reverzní transkripčně-polymerázová řetězová reakce v reálném čase (RT-PCR), protože mohou poskytovat rychlejší výsledky a mohou být citlivější. Imunohistochemická analýza a imunofluorescence rovněž potvrzují přítomnost viru prostřednictvím virových antigenů. Protilátky IgM se jako první objevují během prvních 3-5 dnů po infekci .
Nejvyšší hladiny dosahují 2 týdny po objevení příznaků, poté klesají zpravidla na nedetekovatelné hladiny po 30-60 dnech . Protilátky IgG, které jsou více zkříženě reaktivní, jsou detekovány v nízkých hladinách po prvních 7-9 dnech příznaků, pomalu se zvyšují až na čtyřnásobek a zůstávají detekovatelné po několika měsících a možná i po celý život . Lidský antigen a protilátková odpověď závisí na imunitním stavu hostitele a jsou přítomny pouze během primární nebo sekundární infekce. Na horečku dengue neexistuje žádná specifická léčba ani protivirové léky. Patofyziologie horečky dengue zvyšuje cévní permeabilitu, což vede k významným ztrátám plazmy z intravaskulárního kompartmentu do mimotělního prostoru.
Tato ztráta tekutin může vést k šoku a bez náležité korekce povede k hypoxii, metabolické acidóze a nakonec ke smrti. Primární léčba proto vyžaduje hospitalizační podpůrnou péči s vyvážením tekutin a elektrolytů. Objem balených buněk by měl být monitorován každou hodinu každých 4-6 hodin. Významná ztráta plazmy je definována jako >20% zvýšení objemu balených buněk nebo hematokritu. Jakmile pacient dosáhne těchto hodnot, je nutná rychlá a agresivní náhrada objemu .
Rychlost infuzní náhrady tekutin závisí na objemu sbalených buněk a výdeji moči. K náhradě ztrát plazmy se používá více tekutin včetně fyziologického roztoku, Ringerova laktátu nebo Ringerova acetátu, zředěného 5% roztoku glukózy, plazmy nebo náhražek plazmy, jako je dextrin 40, a čerstvé plné krve . Kromě intravenózní náhrady tekutin lze elektrolyty zavádět perorálně, protože se tím částečně zmírní žízeň a dehydratace způsobená horečkou. K léčbě horečky a dalších příznaků lze použít podpůrná analgetika, jako je paracetamol. NSAID a aspirinu je třeba se vyhnout, protože by mohly urychlit Reyův syndrom.
Před propuštěním z nemocnice musí pacienti s DHF splňovat následující kritéria: viditelné klinické zlepšení, afebrilie bez použití antipyretik po dobu >24 hodin, zvýšená chuť k jídlu, stabilní hematokrit, přiměřený výdej moči, tři dny po zotavení z těžké metabolické acidózy, počet krevních destiček >50 000/mm3 a žádné respirační potíže z pleurálního výpotku nebo ascitu .
Prevence a eradikace Aedes aegypti
Aedes aegypti, nejrozšířenější přenašeč viru dengue, je hlavním cílem sledování a kontroly. Horečku dengue mohou vyvolat i jiní vektoři, například Aedes albopictus, ale činnosti v oblasti dozoru a kontroly různých vektorů by měly být zvažovány pouze tehdy, pokud existují spolehlivé důkazy, že tito vektoři hráli epidemiologicky významnou roli při přenosu infekce dengue . První iniciativa na eliminaci Aedes aegyptibyla na Kubě v roce 1901. Fumigace a likvidace ohnisek výskytu komárů zničením opuštěných kontejnerů byly prvními kroky k eradikaci tohoto vektoru . Po vypuknutí epidemií žluté zimnice v Brazílii v letech 1928 a 1932 bylo zřejmé, že úplná ochrana městského obyvatelstva závisí na absolutní eradikaci komára Aedes aegyptimosquito; to vedlo k tomu, že Panamerická zdravotnická organizace (PAHO) schválila v roce 1947 kontinentální plán eradikace komára Aedes aegyptie v boji proti žluté zimnici ve městech . Od roku 1947 Panamerický hygienický úřad (PASB) intenzivně podporoval kampaně ve všech postižených zemích a jejich úspěšnost se projevila v roce 1962, kdy se podařilo eradikace dosáhnout v 18 kontinentálních zemích a na řadě karibských ostrovů. Výsledkem těchto snah je, že americký virus DENV-2 genotypu V je jediným virem dengue, který dnes přetrvává .
I přes snahy o eradikaci přenašeče se Aedes aegypti nepodařilo vymýtit na Kubě, ve Spojených státech, Venezuele a několika karibských zemích . Desetiletí bezprecedentního lidského úsilí o eradikaci Aedes aegyptifell se velmi rychle rozpadlo a rychle vedlo k zamoření. Nedostatečný dohled a zhoršení struktury eradikačního programu, nedostatečná hygiena prostředí a nedostatečná účast komunity byly některé z faktorů, které vedly k poklesu úsilí o eradikaci vektoru . K dnešnímu dni není k dispozici žádná vakcína, která by infekci dengue zabránila . Společnost Takeda Vaccines Inc. vyvíjí živou atenuovanou kandidátní vakcínu známou jako tetravalentní vakcína proti horečce dengue (TDV), která se skládá z atenuovaného kmene DENV-2 (TDV-2) a tří chimérických virů obsahujících geny prM a E proteinu DENV-1, -3 a -4, které byly exprimovány v kontextu atenuované kostry genomu TDV-2 (TDV-1, TDV-3 a TDV-4). Vakcína se ukázala jako dobře snášená a imunogenní v klinické studii fáze 2 v zemích s endemickým výskytem horečky dengue u dospělých a dětí.
Vakcína je ve fázi 3 vývoje . Kromě toho společnost Sanofi Pasteur vyvinula rekombinantní, živou atenuovanou tetravalentní vakcínu proti horečce dengue (CYD-TDV), která prokázala konzistentní bezpečnost a účinnost u ≥ 9letých osob v endemických zemích; je v pozdní fázi vývoje . Vakcína Dengvaxia (CYD-TDV) společnosti Sanofi Pasteur byla poprvé registrována v Mexiku v prosinci 2015 a byla hodnocena jako třídávková série ve schématu 0/6/12 měsíců v klinických studiích fáze III . V klinických studiích je hodnoceno přibližně pět dalších kandidátů na vakcínu . Cestovatelé do oblastí s výskytem horečky dengue jsou vystaveni riziku nákazy horečkou dengue; v rámci prevence by proto měli být vyzváni, aby si vybírali ubytování s dobře stíněnými okny a dveřmi, používali repelenty proti hmyzu, nosili vhodné oblečení a vyprázdnili a zakryli veškerou stojatou vodu, která by se mohla stát místem rozmnožování komárů .
Současná celosvětová situace
V současné době se očekává, že výskyt horečky dengue bude nadále stoupat v důsledku mnoha faktorů včetně socioekonomického stavu, neustálých změn klimatu, cestování a globalizace. Vakcíny jsou stále ve vývoji a v současné době neexistuje žádná specifická antivirová terapie, která by řešila rostoucí hrozbu horečky dengue . Celosvětový odhad výskytu horečky dengue se pohybuje mezi 50 a 200 miliony. Použití kartografických přístupů však v poslední době naznačuje, že počet výskytu se blíží 400 milionům . V roce 2012 WHO zařadila horečku dengue mezi životně důležitá virová onemocnění přenášená komáry . Tato klasifikace je odůvodněna značným geografickým rozšířením viru spolu s jeho přenašečem do oblastí, které dříve nebyly postiženy (obr. 5).
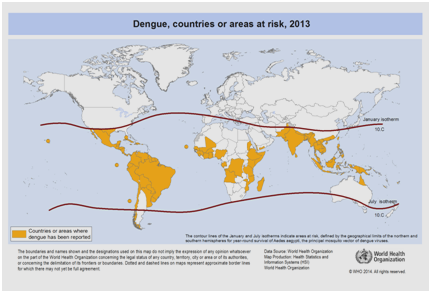
Obrázek 5: Země nebo oblasti světa, kde byla v roce 2013 hlášena horečka dengue, podle údajů shromážděných Světovou zdravotnickou organizací .
Podporuje to také náklady, které s sebou nemoc přináší. Při porovnání zátěže způsobené horečkou dengue a jinými přenosnými nemocemi v postiženém regionu způsobuje horečka dengue mnohem větší lidské utrpení a je větší zátěží než ostatní nemoci přenášené vektory . Podle WHO je horečka dengue hlavní příčinou hospitalizace a úmrtí dětí v jihovýchodní Asii . Studie Hammonda a kol. uvádí, že většina nemocnosti a úmrtnosti související s tímto onemocněním se týká spíše dětí než jiných věkových skupin. Největší zátěž dengue nesou kojenci ve věku 4-9 měsíců a děti ve věku 5-9 let (obr. 6). Závažnost onemocnění u těchto dětí je často způsobena sekundární infekcí DENV . Ekologická studie, kterou provedli Dıaz-Quijano a Waldman v Latinské Americe a Karibiku, zjistila, že mezi určující faktory úmrtnosti na dengue v těchto populacích patří délka uznané endemity, hustota osídlení a srážky .
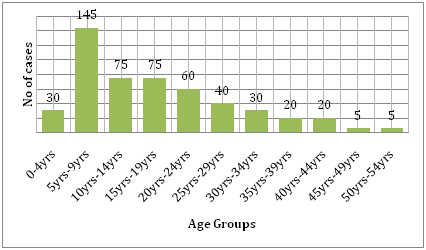
Obrázek 6: Věkové rozložení studijní kohorty v Leónu podle věkových skupin .
Kromě dopadu nemocnosti a úmrtnosti přináší virus dengue vysokou finanční zátěž pro postižené regiony, z nichž mnohé nejsou dostatečně vybaveny k tomu, aby tyto náklady nesly. V roce 2010 byla finanční zátěž způsobená virem dengue odhadnuta v průměru na 2,1 miliardy dolarů ročně v Severní a Jižní Americe (v amerických dolarech za rok 2010), přičemž v citlivostních analýzách se pohybovala v rozmezí 1-4 miliard dolarů a meziročně se značně lišila . Podle WHO je nyní horečka dengue považována za celosvětový problém, přičemž v asijsko-pacifické oblasti žije nejvíce (75 %) celosvětové populace vystavené viru dengue . Západní Tichomoří rovněž zaznamenalo v posledním desetiletí neustálý nárůst počtu hlášených případů DF .
I když v polovině 20. století nedocházelo k přenosu DF, v současné době je v Americe zaznamenán zvýšený výskyt endemického výskytu autochtonní DF. Jen v Americe bylo v roce 2010 hlášeno více než 1,6 milionu případů horečky dengue a 49 000 z nich bylo závažných . V Africe ohniska DF narůstají co do rozsahu a četnosti, ale nejsou důsledně hlášena Světové zdravotnické organizaci. V letech 1960-2010 byly sporadické případy hlášeny 22 africkými zeměmi, jak naznačují dostupné údaje o epidemiích . V Evropě nebyly od vypuknutí epidemie DF v Řecku v roce 1928 hlášeny žádné epidemie DF. V současné době hrozí vypuknutí epidemie v Evropě, které bylo přisuzováno Aedes albopictus v důsledku cestování ze zemí, kde je onemocnění endemické. Odhaduje se, že v příštích letech dojde k nárůstu výskytu onemocnění v důsledku multifaktoriálních rizikových faktorů .
.