Cíle učení
- Popsat vlastnosti plynu.
Tři běžné fáze (nebo stavy) hmoty jsou plyny, kapaliny a pevné látky. Plyny mají ze všech tří nejnižší hustotu, jsou vysoce stlačitelné a zcela vyplní jakoukoli nádobu, do které jsou umístěny. Plyny se takto chovají, protože jejich mezimolekulární síly jsou relativně slabé, takže se jejich molekuly neustále pohybují nezávisle na ostatních přítomných molekulách. Naproti tomu pevné látky jsou relativně husté, tuhé a nestlačitelné, protože jejich mezimolekulární síly jsou tak silné, že molekuly jsou v podstatě uzamčeny na svém místě. Kapaliny jsou stejně jako pevné látky relativně husté a nestlačitelné, ale podobně jako plyny snadno tečou a přizpůsobují se tvaru svých nádob. Můžeme tedy konstatovat, že součet mezimolekulárních sil v kapalinách je mezi silami plynů a pevných látek. Obrázek 10.1.1 porovnává tyto tři stavy látek a znázorňuje rozdíly na molekulární úrovni.
Obrázek 10.1.1 Diatomická látka (O2) v pevném, kapalném a plynném stavu
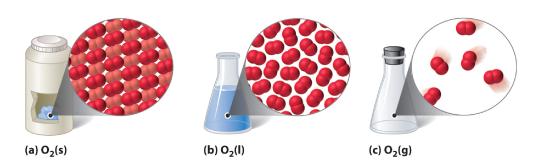
(a) Pevná látka O2 má pevný objem a tvar a molekuly jsou těsně u sebe. (b) Kapalný O2 se přizpůsobuje tvaru své nádoby, ale má pevný objem; obsahuje poměrně hustě nabalené molekuly. (c) Plynný O2 zcela vyplňuje svou nádobu – bez ohledu na její velikost a tvar – a skládá se z široce oddělených molekul.
Stav dané látky silně závisí na podmínkách. Například H2O se běžně vyskytuje ve všech třech stavech: pevný led, kapalná voda a vodní pára (její plynná forma). Za většiny podmínek se s vodou setkáváme jako s kapalinou, která je nezbytná pro život; pijeme ji, vaříme v ní a koupeme se v ní. Když je teplota dostatečně nízká na to, aby se kapalina změnila v led, můžeme na ní lyžovat nebo bruslit, balit ji do sněhových koulí nebo kornoutů, a dokonce z ní stavět obydlí. Vodní páraRozdíl mezi plynem a párou je jemný: pojem pára označuje plynnou formu látky, která je za normálních podmínek (25 °C, 1,0 atm) kapalinou nebo pevnou látkou. Dusík (N2) a kyslík (O2) se tedy označují jako plyny, ale plynná voda v atmosféře se nazývá vodní pára. je součástí vzduchu, který dýcháme, a vzniká vždy, když ohříváme vodu na vaření jídla nebo na přípravu kávy či čaje. Vodní pára při teplotě vyšší než 100 °C se nazývá pára. Pára se používá k pohonu velkých strojů, včetně turbín, které vyrábějí elektřinu. Vlastnosti tří stavů vody jsou shrnuty v tabulce 10.1.1
Geometrická struktura a fyzikální a chemické vlastnosti atomů, iontů a molekul obvykle nezávisí na jejich fyzikálním stavu; jednotlivé molekuly vody například v ledu, kapalné vodě a páře jsou totožné. Naproti tomu makroskopické vlastnosti látky silně závisí na jejím fyzikálním stavu, který je určen mezimolekulárními silami a podmínkami, jako je teplota a tlak.
Obrázek 10.1.2 ukazuje umístění prvků, které se běžně vyskytují v plynném, kapalném a pevném stavu, v periodické tabulce. S výjimkou vodíku jsou prvky, které se v přírodě vyskytují jako plyny, na pravé straně periodické tabulky. Z nich všechny vzácné plyny (skupina 18) jsou jednoatomové plyny, zatímco ostatní plynné prvky jsou dvouatomové molekuly (H2, N2, O2, F2 a Cl2). Kyslík může tvořit i druhý alotrop, vysoce reaktivní tříatomovou molekulu ozonu (O3), která je rovněž plynem. Naproti tomu brom (jako Br2) a rtuť (Hg) jsou za normálních podmínek (25 °C a 1,0 atm, běžně označovaných jako „pokojová teplota a tlak“) kapaliny. Gallium (Ga), které taje při teplotě pouhých 29,76 °C, lze přeměnit na kapalinu pouhým podržením nádoby s ním v ruce nebo jeho uchováváním v neklimatizované místnosti v horkém letním dni. Všechny ostatní prvky jsou za normálních podmínek pevné látky.
Obrázek 10.1.2 Prvky, které se přirozeně vyskytují jako plyny, kapaliny a pevné látky při 25 °C a 1 atm
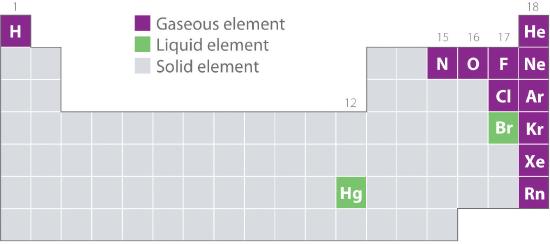
Ušlechtilé plyny a rtuť se vyskytují jako jednoatomové, zatímco všechny ostatní plyny a brom jsou dvouatomové molekuly.
Mnoho prvků a sloučenin, se kterými jsme se dosud setkali, se obvykle vyskytuje jako plyny; některé z těch nejběžnějších jsou uvedeny v tabulce 10.1.2 . Mezi plynné látky patří mnoho binárních hydridů, například halogenidy vodíku (HX); hydridy chalkogenů; hydridy prvků 15. skupiny N, P a As; hydridy prvků 14. skupiny C, Si a Ge; a diboran (B2H6). Kromě toho je mnoho jednoduchých kovalentních oxidů nekovů plynných, například CO, CO2, NO, NO2, SO2, SO3 a ClO2. Plyny jsou i mnohé organické sloučeniny s nízkou molekulovou hmotností, včetně všech uhlovodíků se čtyřmi nebo méně atomy uhlíku a jednoduchých molekul, jako je dimethylether , methylchlorid (CH3Cl), formaldehyd (CH2O) a acetaldehyd (CH3CHO). A konečně chladiva, jako jsou chlorfluoruhlovodíky (CFC) a hydrochlorfluoruhlovodíky (HCFC), jsou plyny, které lze snadno zkapalnit stlačením a naopak kapaliny lze přeměnit na plyny snížením tlaku na kapaliny. Fázová změna z kapaliny na plyn v trubkách uvnitř chladničky ochlazuje, zatímco komprese v cívkách ve spodní nebo zadní části chladničky ohřívá místnost. Čpavek a SO2 jsou další stlačitelné plyny, které se používaly jako chladiva, ale v domácnostech je nelze používat kvůli jejich jedovatosti. Čpavek se stále používá jako chladivo ve velkých komerčních zařízeních kvůli své účinnosti a nízké ceně.
Všechny dříve uvedené plynné látky (kromě jednoatomových vzácných plynů) obsahují kovalentní nebo polární kovalentní vazby a jsou nepolární nebo polární molekuly. Naproti tomu silné elektrostatické přitažlivosti v iontových sloučeninách, jako je NaBr (bod varu = 1390 °C) nebo LiF (bod varu = 1673 °C), jim brání existovat jako plyny při pokojové teplotě a tlaku. Kromě toho nejlehčí členové dané skupiny sloučenin jsou s největší pravděpodobností plyny a teploty varu polárních sloučenin jsou obecně vyšší než teploty varu nepolárních sloučenin s podobnou molekulovou hmotností. Proto jsou v dané řadě sloučenin nejlehčí a nejméně polární členy s největší pravděpodobností plyny. Až na poměrně málo výjimek jsou však sloučeniny s více než přibližně pěti atomy z periody 2 nebo nižší příliš těžké na to, aby za normálních podmínek existovaly jako plyny.
Všimněte si vzoru
Plynné látky často obsahují kovalentní nebo polární kovalentní vazby, existují jako nepolární nebo slabě polární molekuly, mají relativně nízké molekulové hmotnosti a obsahují pět nebo méně atomů z periody 1 nebo 2. V případě, že se jedná o plynné látky, je jejich molekulová hmotnost příliš nízká.
Plyny mají širokou škálu použití, ale předpokládá se, že obzvláště chmurné použití plynné látky použili Peršané na římské město Dura ve východní Sýrii ve třetím století našeho letopočtu. Peršané vykopali tunel pod městskými hradbami, aby se dostali do města a dobyli ho. Archeologické nálezy naznačují, že když Římané odpověděli protitankovým tunelem, aby obléhání zastavili, Peršané zapálili krystaly bitumenu a síry a vytvořili hustý jedovatý plyn. Je pravděpodobné, že jedovaté výpary rozváděly měchy nebo komíny. Pozůstatky asi 20 římských vojáků byly objeveny u paty městské hradby u vchodu do tunelu, který byl necelé 2 m vysoký a 11 m dlouhý. Protože je velmi nepravděpodobné, že by Peršané mohli povraždit tolik Římanů u vchodu do tak stísněného prostoru, archeologové spekulují, že starověcí Peršané použili k úspěšnému dobytí města chemickou válku.
Příklad 10.1.1
Které sloučeniny byste předpověděli jako plyny při pokojové teplotě a tlaku?
- cyklohexen
- karbonát lithný
- cyklobutan
- oxid vanadu(III)
- kyselina benzoová (C6H5CO2H)
Dáno: sloučeniny
Zadáno: fyzikální stav
Strategie:
A Rozhodněte, zda je každá sloučenina iontová nebo kovalentní. Iontová sloučenina je při pokojové teplotě a tlaku s největší pravděpodobností pevná látka, zatímco kovalentní sloučenina může být pevná látka, kapalina nebo plyn.
B Mezi kovalentními sloučeninami jsou při pokojové teplotě a tlaku s největší pravděpodobností plyny ty, které jsou relativně nepolární a mají nízké molekulové hmotnosti.
Roztok:
A Uhličitan lithný je Li2CO3, který obsahuje ionty Li+ a CO32-, a oxid vanadičitý(III) je V2O3, který obsahuje ionty V3+ a O2-. Obě jsou to primárně iontové sloučeniny, u nichž se předpokládá, že jsou v pevném stavu. Všechny zbývající tři sloučeniny jsou kovalentní.
B Kyselina benzoová má více než čtyři atomy uhlíku a je polární, takže se pravděpodobně nejedná o plyn. Cyklohexen i cyklobutan jsou v podstatě nepolární molekuly, ale cyklobutan (C4H8) má výrazně nižší molekulovou hmotnost než cyklohexen (C6H10), který má opět více než čtyři atomy uhlíku. Proto předpokládáme, že cyklobutan je při pokojové teplotě a tlaku s největší pravděpodobností plyn, zatímco cyklohexen je kapalina. Ve skutečnosti je cyklobutan s bodem varu pouhých 12 °C oproti 83 °C u cyklohexenu skutečně plyn při pokojové teplotě a tlaku.
Cvičení
Které sloučeniny byste předpověděli jako plyny při pokojové teplotě a tlaku?
- n-butanol
- fluorid amonný (NH4F)
- ClF
-
oxid ethylnatý
- HClO4
Odpověď: c; d
Souhrn
Objemové látky mohou existovat ve třech stavech: plynném, kapalném a pevném. Plyny mají ze všech tří nejmenší hustotu, jsou vysoce stlačitelné a zcela vyplňují své nádoby. Prvky, které existují jako plyny při pokojové teplotě a tlaku, jsou seskupeny na pravé straně periodické tabulky; vyskytují se buď jako jednoatomové plyny (vzácné plyny), nebo jako dvouatomové molekuly (některé halogeny, N2, O2). Mnohé anorganické a organické sloučeniny se čtyřmi nebo méně atomy, které nejsou atomy vodíku, jsou při pokojové teplotě a tlaku rovněž plyny. Všechny plynné látky se vyznačují slabými interakcemi mezi složkami molekul nebo atomů.
Klíčové poznatky
- Molekuly v plynných látkách často obsahují kovalentní nebo polární kovalentní vazby, jsou nepolární nebo slabě polární a mají relativně nízké molekulové hmotnosti.
Pojmové úlohy
-
Vysvětlete rozdíly mezi mikroskopickými a makroskopickými vlastnostmi látek. Je bod varu sloučeniny mikroskopickou nebo makroskopickou vlastností? molekulová hmotnost? Proč?
-
Určete, zda bod tání, dipólový moment a elektrická vodivost jsou makroskopické nebo mikroskopické vlastnosti hmoty, a vysvětlete své zdůvodnění.
-
Jak ovlivňují mikroskopické vlastnosti hmoty vlastnosti makroskopické? Dokážete dát do souvislosti molekulovou hmotnost s bodem varu? Proč nebo proč ne? Může polarita souviset s bodem varu?“
-
U látky, která má plynnou, kapalnou a pevnou fázi, seřaďte tyto fáze podle rostoucí
- hustoty.
- síly mezimolekulových interakcí.
- stlačitelnost.
- molekulární pohyb.
- pořádek v uspořádání molekul nebo atomů.
-
Vysvětlete, co je na tomto tvrzení špatně: „Stav látky do značné míry určuje molekulární vlastnosti látky.“
-
Popsat nejdůležitější faktory, které určují stav dané sloučeniny. Jaké vnější podmínky ovlivňují, zda látka existuje v některém ze tří stavů hmoty?“
-
Které prvky periodické tabulky existují při pokojové teplotě a tlaku jako plyny? Které z nich jsou dvouatomové a které jednoatomové? Které prvky jsou při pokojové teplotě a tlaku kapalné? Která část periodické tabulky obsahuje prvky, jejichž binární hydridy jsou při pokojové teplotě s největší pravděpodobností plyny?
-
Je následující pozorování správné? „Téměř všechny binární hydridy nekovů jsou při pokojové teplotě plyny, ale hydridy kovů jsou všechny pevné látky.“ Vysvětlete své zdůvodnění.
-
Je následující pozorování správné? „Všechny hydridy chalkogenů jsou při pokojové teplotě a tlaku plyny s výjimkou binárního hydridu kyslíku, který je kapalný.“. Vysvětlete své zdůvodnění. Očekávali byste, že 1-chlorpropan bude plyn, jodpropan? Proč?“
-
Vysvětlete, proč iontové sloučeniny nejsou za normálních podmínek plyny.
Odpovědi
-
-
-
-
.
-
-
Molekulární vlastnosti látky řídí její látkový stav za daných podmínek, ne naopak. Přítomnost silných mezimolekulárních sil upřednostňuje kondenzovaný stav látky (kapalný nebo pevný), zatímco velmi slabé mezimolekulární interakce upřednostňují plynný stav. Navíc tvar molekul určuje, zda je kondenzovaná fáze kapalinou nebo pevnou látkou.
-
-
Prvky, které existují jako plyny, se nacházejí především v pravém horním rohu a na pravé straně periodické tabulky. Následující prvky existují jako plyny: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe a Rn. Polovina halogenů, všechny vzácné plyny a nejlehčí chalkogeny a pikogeny jsou tedy plyny. Z nich všechny kromě vzácných plynů existují jako dvouatomové molekuly. Pouze dva prvky existují při běžné pokojové teplotě 20-25 °C jako kapaliny: rtuť a brom. Pravá horní část periodické tabulky zahrnuje také většinu prvků, jejichž binární hydridy jsou plyny. Kromě toho jsou plyny binární hydridy prvků ze skupin 14-16.
-
-
-
-
.