Rakovina je výsledkem selhání kontrolních mechanismů, které regulují buňky. Mezi příčiny rozpadu patří vždy změny v důležitých genech. Tyto změny jsou často výsledkem mutací, změn v sekvenci DNA chromozomů. Mutace mohou být velmi malé změny, které se týkají jen několika nukleotidů, nebo mohou být velmi rozsáhlé a vést k velkým změnám ve struktuře chromozomů.
Malé i velké mutace mohou ovlivnit chování buněk. Kombinace mutací v důležitých genech mohou vést ke vzniku rakoviny. Materiál uvedený na této stránce popisuje vztah mezi mutací a rakovinou, různé druhy mutací a jejich příčiny. Další informace k tématům uvedeným na této stránce naleznete také ve většině úvodních učebnic biologie, doporučujeme Campbell Biology, 11. vydání.1
Témata na této stránce:
- Mutace a rakovina
- Dědičné mutace a rakovina
- Typy mutací
- Bodové mutace
- Translokace
- Amplifikace genu
- Inverze, Delece a duplikace
- Aneuploidie
- Epigenetické změny
- Příčiny mutací
- Souhrn mutací
- Znát tok: Mutace
Mutace a rakovina
Normální chování, které vykazují rakovinné buňky, je výsledkem řady mutací v klíčových regulačních genech. Buňky se stávají postupně abnormálnějšími s tím, jak se poškozuje více genů. Často se geny, které řídí opravu DNA, samy poškodí, čímž se buňky stávají ještě náchylnějšími ke stále většímu genetickému chaosu.
Níže je animace, která ukazuje vztah mezi chromozomy, geny a DNA.
Předpokládá se, že většina rakovin vzniká z jediné zmutované prekurzorové buňky. Jak se tato buňka dělí, výsledné „dceřiné“ buňky mohou v průběhu času získat různé mutace a odlišné chování. Ty buňky, které získají výhodu v dělení nebo odolnosti vůči buněčné smrti, budou mít tendenci převzít populaci. Tímto způsobem jsou nádorové buňky schopny získat širokou škálu schopností, které se u zdravé verze zastoupeného typu buněk běžně nevyskytují. Změny v chování pozorované u nádorových buněk jsou hlavním tématem části webu věnované biologii rakoviny.
Mutace v klíčových regulačních genech (nádorových supresorech a protoonkogenech) mění chování buněk a mohou potenciálně vést k neregulovanému růstu pozorovanému u rakoviny.
Téměř u všech dosud studovaných typů rakoviny se zdá, že přechod od normální, zdravé buňky k buňce nádorové je postupný a vyžaduje mnoho genetických změn, které v součtu vedou ke vzniku nádorové buňky. Tyto mutace se vyskytují jak na onkogenech, tak na nádorových supresorech. To je jeden z důvodů, proč se rakovina mnohem častěji vyskytuje u starších osob. Aby vznikla nádorová buňka, musí v téže buňce dojít k řadě mutací. Vzhledem k tomu, že pravděpodobnost mutace jakéhokoli genu je velmi nízká, je logické, že možnost výskytu několika různých mutací v téže buňce je opravdu velmi nepravděpodobná. Z tohoto důvodu měly buňky v těle sedmdesátiletého člověka více času na nahromadění změn potřebných k vytvoření rakovinných buněk, ale buňky v těle dítěte mají mnohem menší pravděpodobnost, že potřebné genetické změny získaly. Některé děti samozřejmě rakovinou onemocní, ale mnohem častěji se vyskytuje u starších jedinců. Následující graf ukazuje výskyt rakoviny tlustého střeva ve Spojených státech v závislosti na věku. Graf byl získán z National Cancer Institute. 2
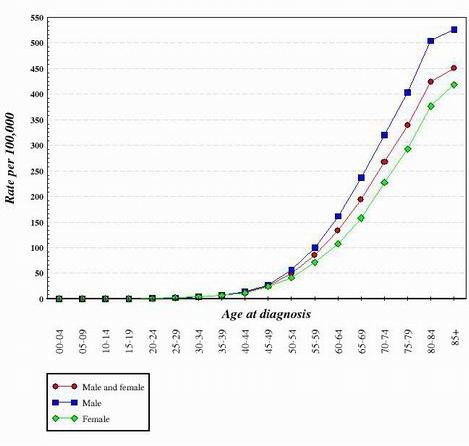
Při pohledu na tvar křivek, jaké jsou uvedeny výše, se dospělo k závěru, že k vytvoření buněk, které se stanou rakovinnými, je zapotřebí několika genetických změn.
Vědci se v laboratoři pokoušeli vytvořit nádorové buňky změnou nebo zavedením klíčových regulačních proteinů. Několik studií se pokusilo definovat minimální počet genetických změn potřebných k vytvoření nádorové buňky, a to se zajímavými výsledky.3
V přírodě se mohou mutace v buňkách v průběhu času hromadit, a pokud je zmutována „správná“ skupina genů, může vzniknout rakovina. Studie z roku 2012 ukázala, že kmenové buňky kostní dřeně zdravého jedince akumulují mnoho mutací s tím, jak člověk stárne. Stačí několik dalších změn v klíčových genech a může vzniknout rakovina. Výsledky naznačují, že „normální“ buňky a rakovinné buňky se v mnoha případech nemusí až tak lišit.4
Dědičné mutace u rakoviny
Aby to bylo ještě složitější, je zřejmé, že změn potřebných ke vzniku rakovinné buňky lze dosáhnout mnoha různými způsoby. Ačkoli všechny druhy rakoviny musí překonat stejné spektrum regulačních funkcí, aby mohly růst a postupovat, geny, které se na tom podílejí, se mohou lišit. Kromě toho se může lišit i pořadí, v jakém dochází k deregulaci nebo ztrátě genů. Jako příklad lze uvést nádory rakoviny tlustého střeva od dvou různých jedinců, které mohou zahrnovat velmi odlišné soubory nádorových supresorů a onkogenů, přestože výsledek (rakovina) je stejný.
Velká heterogenita pozorovaná u rakoviny, dokonce i u rakoviny stejného orgánu, znamená, že diagnostika a léčba jsou komplikované. Současné pokroky v molekulární klasifikaci nádorů by měly umožnit racionální návrh léčebných protokolů na základě skutečných genů zapojených v daném případě. Nové diagnostické testy mohou zahrnovat screening stovek nebo tisíců genů pro vytvoření personalizovaného profilu nádoru u jednotlivce. Tyto informace by měly umožnit přizpůsobení léčby rakoviny konkrétnímu člověku. Více informací o této problematice naleznete v části Genomika/Proteomika.
Genetické změny, které vedou k neregulovanému růstu buněk, lze získat dvěma různými způsoby. Je možné, že k mutaci může dojít postupně v průběhu několika let, což vede ke vzniku „sporadického“ případu rakoviny. Případně je možné zdědit nefunkční geny, což vede k rozvoji familiární formy určitého typu rakoviny. Mezi příklady rakoviny se známou dědičnou složkou patří:
- Rakovina prsu – dědičnost mutovaných verzí genů BRCA1 a BRCA2 jsou známé rizikové faktory. Ačkoli mnoho, ne-li většina jedinců s rakovinou prsu nemá detekovatelné změny v těchto genech, přítomnost mutované formy zvyšuje pravděpodobnost vzniku rakoviny prsu.
- Rakovina tlustého střeva – je známo, že defekty v DNA reparačních genech, jako je MSH2, predisponují jedince k hereditárnímu nepolypóznímu kolorektálnímu karcinomu (HNPCC).
- Retinoblastom – je známo, že defekty v Rb tumor supresorovém genu způsobují tuto rakovinu oka a několik dalších typů rakoviny. Více informací o tomto konkrétním onemocnění naleznete v části věnované Rb
Jedná se o neúplný seznam známých dědičných typů rakoviny a je jisté, že s objasňováním genetiky různých typů rakoviny budou identifikovány další dědičné formy rakoviny.
Více informací na toto téma lze nalézt v kapitolách 2 a 4 knihy The Biology of Cancer (Biologie rakoviny) od Roberta A. Weinberga.
Typy mutací
Proces, při kterém vznikají bílkoviny, translace, je založen na „čtení“ mRNA, která vznikla procesem transkripce. Jakákoli změna DNA, která kóduje gen, vede ke změně vytvořené mRNA. Změněná mRNA pak může vést k produkci proteinu, který již nefunguje správně. Dokonce i změna jediného nukleotidu podél DNA genu může vést ke vzniku zcela nefunkčního proteinu.
Existuje několik různých způsobů, jak lze DNA změnit. Následující část podrobněji popisuje různé typy genetických změn.
Bodové mutace
Genetické změny lze rozdělit do dvou obecných kategorií. Do první kategorie patří změny, které mění pouze jeden nebo několik nukleotidů podél vlákna DNA. Tyto typy změn se označují jako bodové mutace.
Při čtení molekuly messengerové RNA ribozomy interpretují každé tři nukleotidy jako jednu aminokyselinu. Tyto třípísmenné kódy se nazývají kodony. Pro analogii s anglickou větou: „Tlustá kočka snědla krysu“ by obsahovala 6 kodonů. Změny způsobené mutací mohou vést k věcem jako „Tlustá kočka snědla krysu.“ nebo „The fa“ nebo „The fat oca tat her at…“. Dopad na protein závisí na tom, kde ke změně dojde, a na druhu změny.
Třípísmenné kodony čtené ribozomy mohou být mutací změněny jedním ze tří způsobů:
Nonsensové mutace
Nový kodon způsobí předčasné ukončení proteinu, čímž vznikne protein, který je zkrácený a často nefunguje správně nebo vůbec.
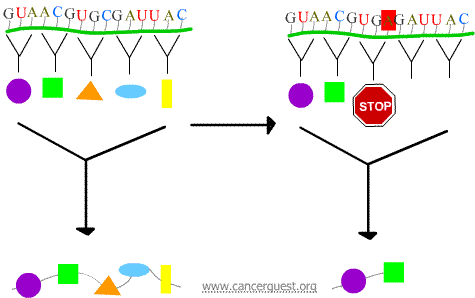
Missense mutace
Nový kodon způsobí, že se do proteinu vloží nesprávná aminokyselina. Účinky na funkci proteinu závisí na tom, co je vloženo na místo normální aminokyseliny.

Mutace s posunem rámce
Ztráta nebo zisk 1 nebo 2 nukleotidů způsobí nesprávné čtení postiženého kodonu a všech následujících kodonů. To vede k velmi odlišnému a často nefunkčnímu bílkovinnému produktu.
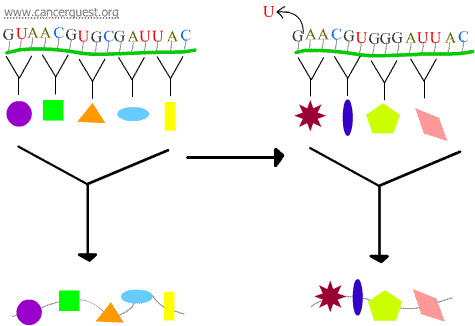
Chyby při transkripci
Některá poškození DNA vedou k modifikovanému nukleotidu nebo malé skupině nukleotidů, které nemůže polymeráza RNA „přečíst“. Když komplex RNA polymerázy dosáhne těchto míst, někdy poškození obejde přidáním nukleotidů ve snaze pokračovat v práci, i když to znamená vložení nesprávné věci. Tento proces se nazývá transkripční mutageneze a může hrát významnou roli při vzniku rakoviny.5
Translokace
Další kategorie mutací zahrnuje změny většího množství DNA, často na úrovni chromozomu. Nazývají se translokace a zahrnují přerušení a přesun fragmentů chromozomů. Často zlomy ve dvou různých chromozomech umožňují vznik dvou „nových“ chromozomů s novými kombinacemi genů.
Ačkoli by se mohlo zdát, že to nezpůsobí velké potíže, protože všechny geny jsou stále přítomny, tento proces může vést k deregulaci buněčného růstu několika způsoby-
1. Geny nemusí být na novém místě vhodně přepisovány a překládány.
2. Přesun genu může vést ke zvýšení nebo snížení úrovně jeho transkripce.
3. K přerušení a opětovnému spojení může dojít i uvnitř genu (jak je znázorněno zeleně výše), což vede k jeho inaktivaci.
U některých druhů rakoviny jsou konkrétní translokace velmi časté a mohou být dokonce použity při diagnostice onemocnění. Translokace jsou běžné u leukemií a lymfomů a méně často byly identifikovány u nádorů solidních tkání. Příkladem může být výměna mezi chromozomy 9 a 22, která je pozorována u více než 90 % pacientů s chronickou myelogenní leukémií (CML). Tato výměna vede ke vzniku zkrácené formy chromozomu 22 nazývané filadelfský chromozom (podle místa jeho objevení). Tato translokace vede ke vzniku onkogenu z protoonkogenu abl.67
Mezi další nádory, které jsou často (nebo vždy) spojeny s určitými translokacemi, patří Burkittův lymfom, B-buněčné lymfomy a několik typů leukemií.67
Amplifikace genů
Při tomto velmi neobvyklém procesu dochází k závažné poruše normálního procesu replikace DNA. Výsledkem je, že namísto vytvoření jediné kopie oblasti chromozomu vzniká mnoho kopií. To vede k tvorbě mnoha kopií genů, které se nacházejí v dané oblasti chromozomu. Někdy se vytvoří tolik kopií amplifikované oblasti, že vlastně mohou vytvořit vlastní malé pseudochromozomy zvané dvouminutové chromozomy.
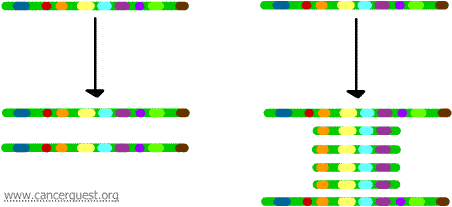
Geny na každé z kopií mohou být přepisovány a překládány, což vede k nadprodukci mRNA a bílkovin odpovídajících amplifikovaným genům, jak je uvedeno níže. Klikaté čáry představují mRNA, která je produkována prostřednictvím transkripce každé kopie genu.
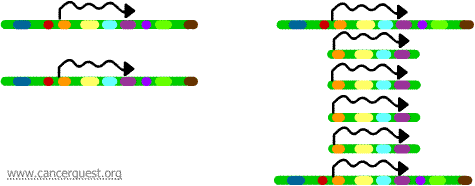
Ačkoli tento proces není pozorován v normálních buňkách, v nádorových buňkách k němu dochází poměrně často. Pokud je v amplifikované oblasti obsažen onkogen, pak výsledná nadměrná exprese tohoto genu může vést k deregulovanému růstu buněk. Příkladem může být amplifikace onkogenu myc u celé řady nádorů a amplifikace onkogenu ErbB-2 nebo HER-2/neu u rakoviny prsu a vaječníků. V případě onkogenu HER-2/neu byla navržena klinická léčba zaměřená na buňky s nadměrnou expresí tohoto proteinového produktu.
Amplifikace genu také přispívá k jednomu z největších problémů při léčbě rakoviny: rezistenci na léky. Nádory rezistentní na léky mohou pokračovat v růstu a šíření i v přítomnosti chemoterapeutik. Běžně zapojený gen se nazývá MDR pro mnohočetnou lékovou rezistenci. Proteinový produkt tohoto genu funguje jako pumpa umístěná v membráně buněk. Je schopen selektivně vypuzovat molekuly z buňky, včetně léků na chemoterapii. Tímto odstraněním se léky stávají neúčinnými.
Podrobněji o tom pojednává kapitola Rezistence vůči lékům. Zesílení různých genů může způsobit neúčinnost jiných chemoterapeutik.
Inverze, duplikace a delece
Inverze
Při těchto změnách dochází k uvolnění segmentů DNA z chromozomu a jejich opětovnému vložení v opačné orientaci. Stejně jako v předchozích příkladech může tato přestavba vést k abnormální genové expresi, a to buď aktivací onkogenu, nebo deaktivací nádorového supresorového genu.
Duplikace/delece
V důsledku replikačních chyb může být gen nebo skupina genů v rámci chromozomu zkopírována více než jednou. Od amplifikace genů se liší tím, že geny nejsou replikovány mimo chromozom a jsou kopírovány pouze jednou navíc, nikoliv stokrát nebo tisíckrát. Geny mohou být také ztraceny v důsledku selhání replikačního procesu nebo jiného genetického poškození.

Aneuploidie
Aneuploidie je genetická změna, která zahrnuje ztrátu nebo zisk celých chromozomů. V důsledku problémů v procesu buněčného dělení nemusí dojít k přesnému rozdělení replikovaných chromozomů do dceřiných buněk. Výsledkem mohou být buňky, které mají příliš mnoho chromozomů nebo příliš málo chromozomů. Příkladem poměrně častého aneuploidního stavu, který nesouvisí s rakovinou, je Downův syndrom, při kterém se ve všech buňkách postiženého jedince nachází jedna kopie chromozomu 21 navíc.
Na animaci níže jsou vytvořeny kopie dvou chromozomů, ale při dělení buňky nejsou chromozomy rovnoměrně rozděleny do dvou vzniklých buněk (dceřiných buněk). Výsledkem je, že jedna z buněk má příliš mnoho chromozomů a jedna jich nemá dost.
Nádorové buňky jsou velmi často aneuploidní. Lidé mají ve svých buňkách běžně 46 chromozomů, ale rakovinné buňky jich mají často mnohem více, někdy i více než 100. Přítomnost chromozomů navíc činí buňky nestabilními a vážně narušuje kontrolu buněčného dělení. V současné době probíhá diskuse o tom, zda jsou všechny druhy rakoviny aneuploidní. Bez ohledu na to, zda tomu tak je, je zřejmé, že aneuploidie je běžným znakem nádorových buněk.
Epigenetické změny
Kromě skutečných změn v sekvenci DNA může být genová exprese změněna změnami DNA a chromatinu, které nemění sekvenci. Protože tyto změny nemění sekvenci DNA v genech, označují se jako epigenetické změny. Níže jsou popsány dva typy epigenetických změn.
Metylace
Při této změně jsou některé nukleotidy v DNA modifikovány přidáním metylové (-CH3) skupiny k bázi. Metylace DNA je spojena s inaktivací dané oblasti DNA. Abnormální vzorce metylace DNA byly pozorovány u nádorových buněk. Stejně jako popsané změny mění metylace expresi postižených genů.
Acetilace
Při této epigenetické změně se histonové proteiny, kolem nichž je DNA navinuta, modifikují přidáním acetylových (-CH3CHO) skupin. Tato změna vede k rozvolnění interakce DNA:histon a je spojena se zvýšenou expresí genů. Modifikace procesů přidávání a odstraňování acetylových skupin k DNA je aktivní oblastí výzkumu léčby rakoviny.
Více o epigenetických změnách a léčbě rakoviny.
Příčiny mutací
Jak jsme viděli, rakovinné buňky vznikají z normálních prekurzorových buněk prostřednictvím nahromadění genetického poškození. Mechanismy, kterými jsou tyto změny vyvolány, jsou různé. V širším smyslu spadají původci genetických změn (mutací) především do níže popsaných kategorií, které jsou podrobně rozebrány v následující části.
Spontánní mutace
Spontánní mutace: Báze (A, T, G, C) v DNA se mění nebo ztrácejí v důsledku neopravených replikačních chyb nebo náhodných molekulárních událostí. Například ztráta aminoskupiny z cytosinu, normální báze vyskytující se v DNA, vede ke vzniku uracilu, báze, která se v DNA normálně nevyskytuje. Pokud tato změna není odhalena a zvrácena, může dojít k mutaci. Příležitostně může dojít ke ztrátě celé báze v důsledku rozštěpení vazby mezi páteří DNA a bází. To vede ke vzniku mezery v dvojité šroubovici DNA, která, pokud není opravena, může při příštím kopírování DNA (tj. při replikaci) vést k mutaci.
Indukované mutace
Indukované mutace: Mutace lze vyvolat vystavením organismů (nebo buněk) různým způsobům ošetření. Mezi nejčastější patří:
Radiace – jeden z prvních známých mutagenů, radiace je silným induktorem mutací. Různé typy záření způsobují různé typy genetických změn. Ultrafialové (UV) záření způsobuje bodové mutace. Rentgenové záření může způsobit zlomy v dvojité šroubovici DNA a vést k translokacím, inverzím a dalším typům poškození chromozomů. Vystavení UV záření ve slunečním světle je spojováno s rakovinou kůže. Všimněte si, že vlastnosti záření poškozující DNA byly využity v několika různých způsobech léčby rakoviny založených na záření.
Níže je uveden typ mutace, která je způsobena ultrafialovým zářením. V tomto příkladu způsobí bombardování dvojité šroubovice DNA UV zářením spojení dvou bází. Tím se změní struktura DNA, a pokud nedojde k nápravě, může to vést k trvalým změnám.
Dalším typem záření je energie vyzařovaná přirozeně se vyskytujícími radioaktivními prvky (jako je radon a uran) nebo lidmi vytvořenými zdroji, jako jsou ty, které se nacházejí (a vznikají) v jaderných reaktorech. Záření tohoto typu se vyskytuje v různých typech a může způsobovat různé typy poškození buněk a tkání. Záření může přímo poškodit DNA nebo může způsobit vznik chemických látek (tj. reaktivních forem kyslíku neboli ROS), které pak mohou poškodit DNA nebo jiné složky buněk.
Expozice záření z radioaktivních materiálů je dobře zdokumentována. Analýzy osob, které přežily svržení atomových bomb na Japonsko během druhé světové války, ukázaly velký nárůst leukemií krátce po ozáření a poté nárůst dalších typů rakoviny v následujících desetiletích.8
Nebezpečné množství radioaktivních materiálů se také náhodně uvolnilo z jaderných elektráren. Vystavení záření v důsledku náhodného úniku radioaktivních materiálů z jaderného reaktoru v Černobylu bylo spojeno s nárůstem výskytu rakoviny štítné žlázy a dalších zhoubných nádorů.9
Medicínské zobrazovací přístroje (např. rentgenové přístroje a CT) rovněž vystavují pacienty záření. Nepředpokládá se, že by množství používané při jednotlivých vyšetřeních způsobovalo významné množství rakoviny, ale dlouhodobý dopad mnoha vyšetření po dobu několika let není jasný.10 Stejně tak se nepředpokládá, že by vystavení cestujících letadlem skenování celého těla na letištích představovalo riziko vzniku rakoviny.11 Cestující v letadlech jsou také vystaveni záření z vesmíru, ale v nízké míře a nepředpokládá se, že by představovalo riziko vzniku rakoviny, a to ani pro členy posádky letadla.1112
Chemické mutageny – je známo, že mnoho různých chemických látek způsobuje mutace. Tyto chemické látky působí tak, že se vážou na DNA nebo na stavební kameny DNA a narušují replikační nebo transkripční procesy. Příkladem silných mutagenů je benzo-a-pyren, chemická látka obsažená v cigaretovém kouři, a aflatoxin, mutagen, který se nejčastěji vyskytuje u nesprávně skladovaných zemědělských produktů.
Chronický zánět – Chronický zánět může vést k poškození DNA v důsledku produkce mutagenních chemických látek buňkami imunitního systému. Příkladem může být dlouhodobý zánět způsobený infekcí virem hepatitidy. Více informací o virech a rakovině.
Kyslíkové radikály- Během získávání energie z potravy, ke kterému dochází v našich mitochondriích, mohou vznikat chemické látky, které jsou velmi reaktivní a jsou schopny poškodit buněčné membrány i samotnou DNA. Tyto reaktivní meziprodukty kyslíku (ROI) mohou vznikat také při vystavení buněk záření, jak je uvedeno níže.
Mutagenní aktivita ROI souvisí se vznikem rakoviny i s působením několika protinádorových léčebných postupů, včetně ozařování a chemoterapie. 131415
Normální buněčné dělení
Během mitózy se může stát, že proces buněčného dělení nedokáže přesně rozdělit replikované chromozomy na dvě dceřiné buňky. Chyba tohoto typu vede ke vzniku aneuploidních buněk. Buňkám budou buď chybět, nebo získají značný počet genů. Tento vzácný proces může vytvořit buňky, které jsou náchylnější k neregulovanému buněčnému dělení. Jak již bylo uvedeno, velké procento rakoviny izolované od lidí je aneuploidní.
Pokud má buňka mutaci v genu, jehož proteinový produkt je zodpovědný za „kontrolu“ procesu dělení, může se situace rychle vymknout kontrole a dceřiné buňky každého dělení mohou být stále více abnormální.
Viry jako mutageny
Předpokládá se, že viry jsou zodpovědné za významné procento případů rakoviny. Viry mohou způsobovat rakovinu různými způsoby a způsob, jakým každý typ viru působí, se pravděpodobně mírně liší. Některé viry (včetně mnoha retrovirů) mohou způsobit mutace vložením svých genů do genomu infikované buňky. Vložená DNA může zničit nebo změnit aktivitu postižených genů.161718
Viry mohou způsobit mutace také nepřímým způsobem. Jako příklad lze uvést např: Infekce virem hepatitidy může trvat mnoho let. Během této doby se obranný systém organismu snaží viru zbavit produkcí toxických chemických látek. Tyto chemikálie mohou poškodit jinak zdravé „vedlejší“ buňky a poslat je na cestu, která vede k rakovině. Existuje mnoho dalších způsobů, jak mohou viry způsobit rakovinu.1920
Vzhledem k významu virů při vzniku mnoha druhů rakoviny jsme vytvořili oddíl věnovaný virům a rakovině.
Transpozony jako mutageny
Transpozony jsou krátké sekvence DNA, které mají schopnost přesouvat se z jednoho místa v DNA na jiné místo. Transpozony kódují enzym, transpozázu, který působí tak, že transpozon zařadí na nová místa v genomu (viz schéma transpozonu vlevo dole) Transpozony objevila Barbara McClintocková a za svou práci získala Nobelovu cenu.2122 Lidský genom obsahuje mnoho neaktivovaných kopií transpozonů, které ztratily schopnost přesouvat se nebo „přeskakovat“ na nová místa. Přibližně 50 % lidského genomu tvoří „mrtvé“ transpozony.23
Přesun aktivních transpozonů může vést k mutacím, které mění aktivitu genů. Viditelným příkladem pohybu transpozonů (tzv. transpozice) je zbarvení zrn u indické kukuřice (viz níže vpravo). Předpokládá se, že transpozony, které jsou aktivní u člověka, se podílejí na vzniku lidských onemocnění, včetně rakoviny.242526


Shrnutí mutací
Genetické změny (mutace) Úvod
- Normální chování, které vykazují rakovinné buňky, je výsledkem řady mutací v klíčových regulačních genech (tj. genech pro opravu DNA).
- Předpokládá se, že většina rakovinných buněk vzniká z jedné prekurzorové buňky, která získá dostatečné množství mutací, aby se stala rakovinnou buňkou.
Mutace DNA
- Genetické změny mohou být malé, postihující pouze jeden nebo několik nukleotidů (bodové mutace), nebo mohou být poměrně velké, měnit strukturu chromozomu nebo chromozomů.
- Bodové mutace
- Translace je výroba proteinu pomocí enzymů, které „čtou“ tři nukleotidová „slova“ (kodony) podél messengerové RNA (mRNA).
- I změna jediného nukleotidu podél DNA genu může vést ke vzniku zcela nefunkčního proteinu. Mutace se rozdělují do skupin podle změn, které vytvářejí ve výsledném bílkovinném produktu postiženého genu.
- Nonsensové mutace – Nový (mutovaný) kodon způsobí předčasné zastavení syntézy bílkovin.
- Missense mutace – Změněný kodon vede k vložení nesprávné aminokyseliny do bílkoviny.
- Frameshift mutace – Ztráta nebo zisk 1 nebo 2 nukleotidů v mRNA způsobí chybné čtení kodonů. Často vede ke zkrácení a nefunkčnosti proteinů.
- Změny na úrovni chromozomu
- Translokace – Přerušení a (někdy) výměna fragmentů chromozomu.
- Amplifikace genu – Abnormální replikace vytváří více kopií oblasti chromozomu. V konečném důsledku to vede k nadprodukci příslušných proteinů.
- Inverze – Úseky DNA jsou uvolněny z chromozomu a poté znovu vloženy v opačné orientaci.
- Duplikace/delece – Gen nebo skupina genů mohou být v rámci chromozomu zcela ztraceny nebo vícekrát zkopírovány.
- Aneuploidie – Genetická změna, která zahrnuje ztrátu nebo zisk celých chromozomů.
- Spontánní mutace mohou vznikat v důsledku neopravené DNA nebo náhodných molekulárních událostí.
- Aneuploidie je velmi častá u nádorových buněk.
Epigenetické změny
- Exprese genu může být změněna změnami DNA a chromatinu, které nemění genetickou sekvenci. Příkladem je metylace DNA a acetylace histonů.
- Metylace – Některé nukleotidy v DNA jsou modifikovány přidáním metylové skupiny, což je spojeno s inaktivací dané oblasti DNA
- Acetilace – Přidání acetylových skupin uvolňuje DNA a zvyšuje genovou expresi.
Indukované mutace
- Mutace lze vyvolat vystavením organismů (nebo buněk) různým způsobům ošetření:
- Radiace – UV záření způsobuje bodové mutace a rentgenové záření způsobuje více forem poškození.
- Chemické mutageny – Mohou se vázat na DNA nebo stavební kameny DNA a zasahovat do procesů replikace nebo transkripce.
- Chronický zánět – Poškození DNA v důsledku produkce mutagenních chemických látek buňkami imunitního systému
- Kyslíkové radikály – Vznikají při produkci energie buňkou a mohou poškodit DNA.
Jiné genetické změny
- Aberantní buněčné dělení, které vede k nesprávnému dělení chromozomů, může vést k aneuploidii.
- Viry mohou způsobit genetické poškození několika různými způsoby a jsou spojeny s celou řadou druhů rakoviny.
Mutace a rakovina
- Zdá se, že přechod od normální, zdravé buňky k buňce nádorové je postupný.
- Vývoj rakoviny vyžaduje genetické změny v několika různých onkogenech a nádorových supresorech.
- Všechny nádory musí překonat stejné spektrum regulačních funkcí, aby mohly růst a postupovat, ale geny, které se na tom podílejí, se mohou lišit.
- Heterogenita nádorů komplikuje diagnostiku a léčbu.
- Je možné zdědit dysfunkční geny, které vedou ke vzniku familiární formy určitého typu rakoviny.
Poznejte tok: Mutace
Poznejte tok je interaktivní hra, ve které si můžete ověřit své znalosti. Jak hrát:
- Přetáhněte příslušné možnosti ze sloupce vpravo a umístěte je v pořadí do políček vlevo. Všimněte si, že k dokončení hry použijete pouze pět ze šesti možností.
- Po dokončení klikněte na „Zkontrolovat“, abyste zjistili, kolik odpovědí jste měli správně.
- Při nesprávných odpovědích klikněte na „Popis“, abyste si prohlédli informace o procesech.
- Chcete-li to zkusit znovu, zvolte „Obnovit“ a začněte znovu.
-
1
-
2
-
3
-
4
-
5
-
Více informacíBuňka je v procesu syntézy DNA
-
Více informacíVytváří se mnoho kopií oblasti chromozomu
- .
Zjistěte vícePřepisování amplifikovaných genů
-
Zjistěte vícePřepisování amplifikovaných genů
-
Zjistěte vícePřemnožení klíče proteinu vede k růstu nádoru odolného vůči lékům
-
Zjistěte víceDochází k duplikaci
Přehrajte si to znovu
- 1. Vyzkoušejte si, jak se vám to daří. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biology (11. vydání). Pearson.
- 2. vydání. Surveillance, Epidemioloy, and End Results (SEER) zastoupený National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. „Vytváření lidských nádorových buněk s definovanými genetickými prvky“. Nature 400: 464-468
- 4. Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. The origin and evolution of mutations in acute myeloid leukemia. Cell, 20. července 2012
- 5. Brégeon D, Doetsch PW. Transkripční mutageneze: příčiny a zapojení do vývoje nádorů. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. „Chromozomové studie normálních a leukemických lidských leukocytů“. J Natl Cancer Inst (1960). 25: 85-100.
- 7. Rowley JD. „Nová konzistentní chromozomální abnormalita u chronické myelogenní leukemie identifikovaná pomocí chinakrinové fluorescence a barvení podle Giemsy.“ Nature (1973). 243: 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. RIZIKO NÁDOROVÝCH A NENÁDOROVÝCH ONEMOCNĚNÍ U PŘEŽILÝCH ATOMOVÉ BOMBY. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. The Chernobyl accident–an epidemiological perspective. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 9. března.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Expozice nízkým dávkám ionizujícího záření z lékařských zobrazovacích postupů. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Airport Full-Body Screening: Jaké je riziko? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Cosmic radiation in commercial aviation [Kosmické záření v komerční letecké dopravě]. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. „Oxidativní stres, poškození DNA a rakovina prsu“. AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. „Oxidative stress and experimental carcinogenesis“. Indian J. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. „Oxidové radikály, peroxidace lipidů a poškození DNA“. (2002)181-182:219-222
- 16. Nair V. Retroviry indukovaná onkogeneze a bezpečnost retrovirových vektorů. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Epstein-Barrové virus a Burkittův lymfom. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogenous retroviruses and cancer. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV-related hepatocellular carcinoma: Od chronického zánětu ke karcinomu. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. The origin and behaviour of mutable loci in maize [Původ a chování mutabilních lokusů u kukuřice]. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Přednáška o Nobelově ceně
- 23. Burns KH, Boeke JD. Lidská transpoziční tektonika. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Mobilní genetické elementy a rakovina. Od mutací ke genové terapii. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Mobilní elementy v lidském genomu: důsledky pro onemocnění. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Natural mutagenesis of human genomes by endogenous retrotransposons [Přirozená mutageneze lidských genomů pomocí endogenních retrotranspozonů]. Cell. 2010 Jun 25;141(7):1253-61.