24. výroční zpráva o glaukomu
Podle odkazů níže si můžete přečíst další články z výroční zprávy o glaukomu:
Péče o glaukom s laserovou přesností
MIGS Madness: Atlas možností
Zvládnutí invazivních operací glaukomu
Glaukom: (Získejte 2 kredity CE)
Experti se dosud neshodli na všeobecně uznávané etiologii glaukomu. Shodují se však na jednom: snížení nitroočního tlaku (IOP) je jediným modifikovatelným rizikovým faktorem pro zpomalení jeho progrese. Tradičním přístupem první volby je lokální farmakoterapie a možností je více než kdy jindy.
Tento článek, třetí část našeho seriálu Převezměte kontrolu nad glaukomem, se zabývá mnoha léky, které mohou praktičtí lékaři použít, a radí, kdy kterou terapii použít u kterého pacienta.
Autonomní léčba
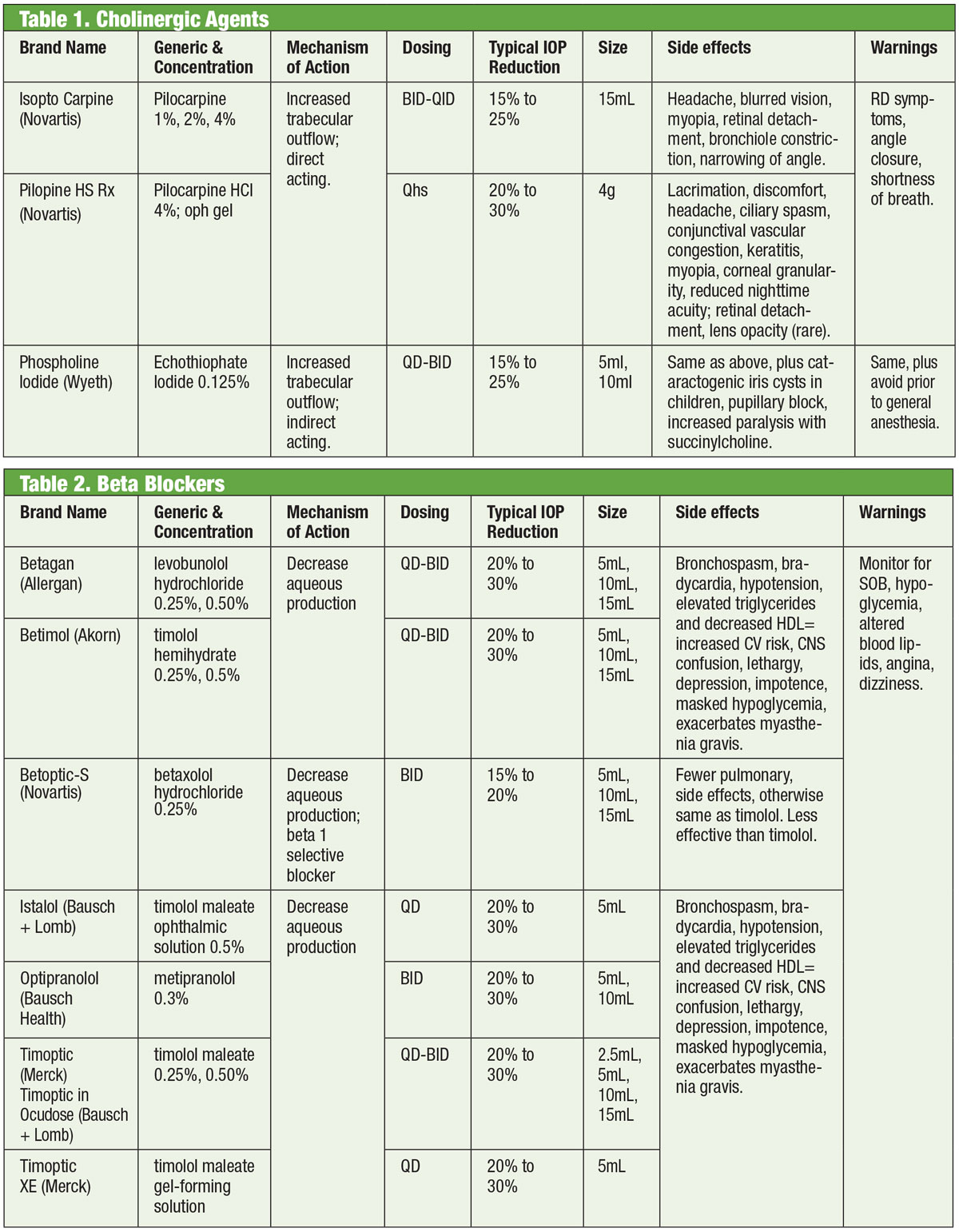
Léky, které působí na autonomní nervový systém (tj, cholinergikum a adrenergikum) jsou základem terapie glaukomu již od 19. století.1,2 Cholinergikum vyvolává miózu, která roztahuje a stimuluje trabekulární síťku (TM) a zvyšuje tak odtok vody do ní a do Schlemmova kanálku.3 Mezi zástupce této skupiny patří pilokarpin, karbachol, fysostigmin, neostigmin a ektofiát. Z nich se dosud rutinně používá pouze pilokarpin. Léčba vykazuje odpověď závislou na dávce s poklesem IOP přibližně o 20 % při předepisování QID.4
Převezměte kontrolu nad glaukomem
Podle odkazů níže si můžete přečíst další články z našeho čtyřdílného seriálu o glaukomu:
Díl první: Glaukom:
Díl druhý: Příprava diagnostické sady nástrojů
Čtvrtý: Křížová výprava v primární péči
Čtvrtá část: Play a Part in Postoperative Glaucoma Care
Ačkoli je použití cholinergik účinné, je omezeno jejich očními a systémovými vedlejšími účinky. Mezi ně patří spasmus ciliárních svalů (s přidruženou bolestí hlavy a indukovanou myopií), mióza, toxicita rohovky, zarudnutí, uveitida, možná tvorba katarakty, respirační deprese a gastrointestinální potíže. Navíc novější léky mají větší účinnost při snižování IOP, takže cholinergní látky zůstávají vyhrazeny pro specifické případy, kdy může mít miotický účinek další přínos, jako je akutní uzávěr úhlu.
Adrenergní agonisté naproti tomu ovlivňují alfa nebo beta adrenergní receptory (nebo oba, pokud nejsou selektivní). Epinefrin, primární neselektivní látka, snižuje IOP tím, že nejprve sníží produkci vody a poté zvýší odtok přes TM.5Naneštěstí má omezené použití kvůli významným systémovým nežádoucím účinkům. Dipivefrin, proléčivo epinefrinu vyvinuté v 70. letech 20. století, umožňuje použití mnohem nižších koncentrací mateřské sloučeniny s menšími systémovými účinky.6 Neselektivní adrenergní látky se dnes používají minimálně, s výjimkou případů, kdy mohou být jiné léky kontraindikovány.
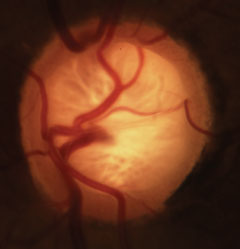
Glaukomatózní kuperóza s charakteristickou ztrátou neuroretinálního lemu, lamely a alterací vaskulatury. Klikněte na obrázek pro zvětšení.
Beta-blokátory
Adrenergní antagonisté neboli beta (β)-blokátory inhibují vodnatost a představují standard, podle kterého se porovnávají nové léky. Konkrétně β-blokátory snižují ultrafiltraci, což omezuje dostupnost substrátu vodnatého humoru, který je k dispozici pro přenos do zadní komory.1,7,8 Tyto léky mohou být neselektivní, což znamená, že inhibují obě izoformy β-adrenergních receptorů (β1 a β2), nebo kardioselektivní, které mají mnohem větší afinitu k β1 receptoru. β2 je převažující oční adreno-receptor, takže neselektivní látky budou mít větší vliv na kontrolu IOP.9,10
Mezi topické β-blokátory patří timolol, levobunolol, metipranolol, karteolol a betaxolol. Pouze betaxolol je kardioselektivní – což jej činí užitečným při určitých kontraindikacích, ale může být méně účinný při snižování IOP.11β-blokátory snižují IOP o 20 až 30 % a mohou být dávkovány dvakrát denně. Lze je také dávkovat jednou denně, zejména při použití roztoků ve formě gelu kvůli jejich delší době kontaktu s okem.12,13 Adrenergní antagonisté mohou mít menší účinek během spánku, proto je třeba dávat pozor při dávkování β-blokátorů v blízkosti doby spánku, zejména pokud jsou předepsány v režimu jednou denně.14,15 Pokud pacienti užívají systémové β-blokátory, snižuje se oční hypotenzní účinek lokálních β-blokátorů a je možné zvážit jiné třídy lokálních léků.16
Ačkoli by se tato třída léků měla většinou vyvarovat plicních nebo kardiálních stavů, ve vybraných případech může být rozumné zvážit léčbu beta-blokátory. Mělo by se tak však dít se souhlasem příslušného specialisty (kardiologa nebo plicního lékaře).
Tabulky: Bruce Onofrey, OD, RPh. Kliknutím na obrázek jej zvětšíte.
Obecně je však třeba se vyhnout užívání β-blokátorů u osob s atrioventrikulární blokádou, sinusovou bradykardií a obstrukční plicní nemocí.17
Inhibitory karboanhydrázy
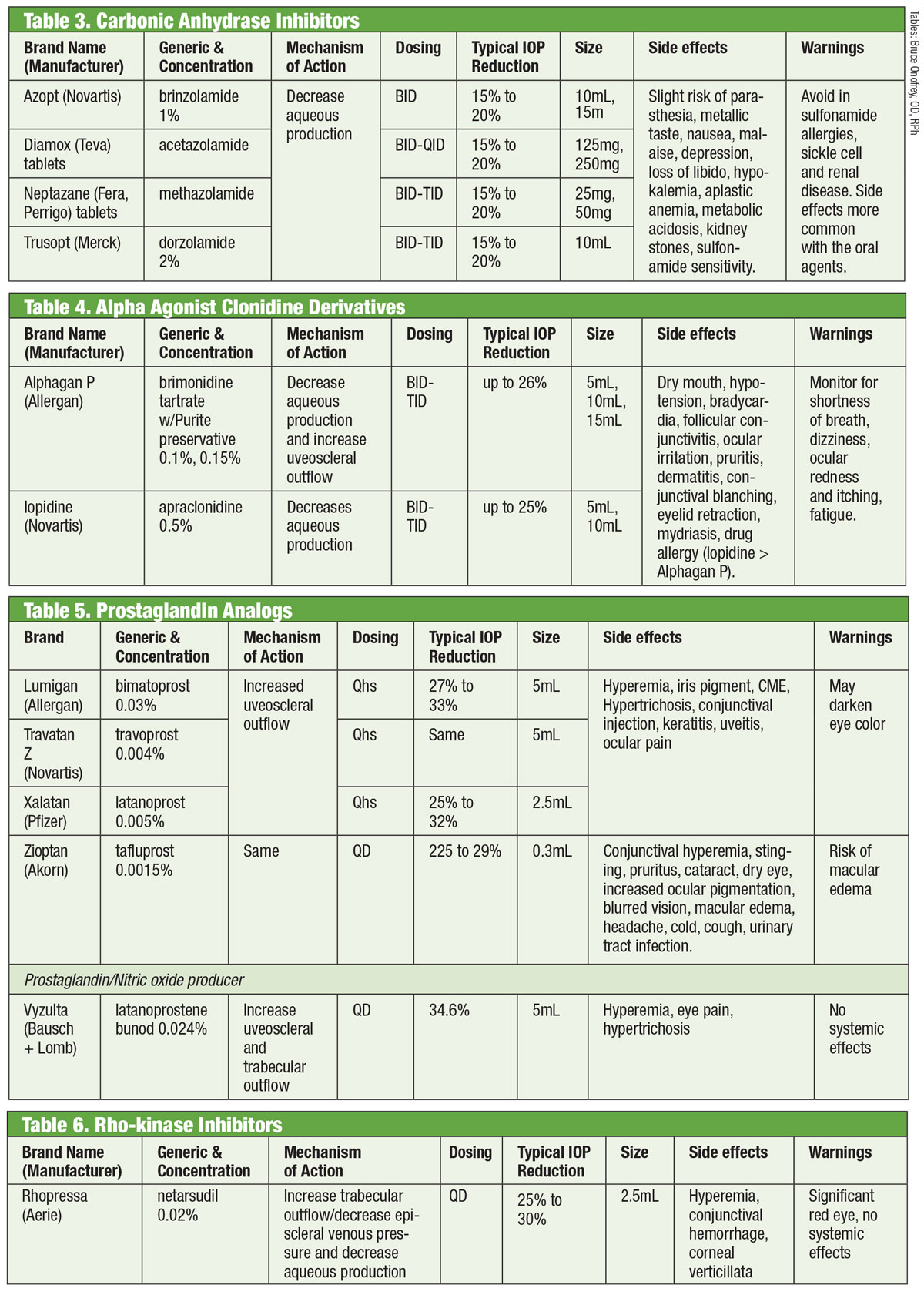
Výzkumníci uznávají schopnost perorálních inhibitorů karboanhydrázy (CAI) snižovat IOP již od 50. let 20. století.18 Dosahují toho potlačením vodní produkce.18 Systémové nežádoucí účinky (jako je únava, gastrointestinální poruchy a parestézie) však omezují jejich chronické používání u glaukomu.18 Perorální CAI se stále používají v případech, kdy topické CAI způsobují přecitlivělost nebo kdy je použití kapek vyloučeno, a také v případech akutního uzávěru úhlu.18 Pokusy o formulaci topické varianty uspěly se zavedením dorzolamidu v polovině 90. let a brzy poté brinzolamidu.19
Existuje nejméně sedm různých izoenzymů karboanhydrázy (CA), přičemž CA-II v ciliárních výběžcích se podílí převážně na tvorbě vody.18 Dorzolamid i brinzolamid jsou silnými inhibitory tohoto izoenzymu, mají však několik klinicky významných rozdílů. Například dorzolamid má pH 5,6, zatímco brinzolamid má pH 7,5. Brinzolamid je navíc dostupný ve formě suspenze. To jsou jen některé z vlastností, které mohou být příčinou individuálních nežádoucích účinků těchto přípravků, mezi které může patřit píchání v případě dorzolamidu a rozmazané vidění v případě brinzolamidu.19
Ačkoli jsou tyto přípravky podle FDA označeny pro dávkování TID, někteří lékaři volí podávání BID. V případě brinzolamidu uvádějí studie fáze III klinicky ekvivalentní snížení IOP při režimu BID nebo TID.20 Jiné studie neuvádějí statisticky významné rozdíly mezi dávkováním BID nebo TID u dorzolamidu.18 Případně jiní obhajují dávkování TID při monoterapii a dávkování BID při použití jako přídatné léčby.21
Tabulky: Bruce Onofrey, OD, RPh. Kliknutím na obrázek jej zvětšíte.
Agonisté alfa
Klonidin představoval nejstarší agonistu alfa (AA) účinného pro snížení IOP. I v lokální formě však vyvolával hluboké systémové nežádoucí účinky bradykardie, sedace a hypotenze.22 Substituce apraklonidinu amidovou skupinou snižovala průnik hematoencefalickou bariérou, a tím i nežádoucí účinky. Bohužel jeho snížená účinnost v průběhu času a zvýšený výskyt oční alergie jej omezují na krátkodobé použití.
Brimonidin, zavedený v roce 1997, je účinný AA s 32krát vyšší selektivitou pro β2 adrenoreceptory než apraklonidin.22 Snižuje IOP dvojím mechanismem – snížením produkce vody a zvýšením uveosklerálního odtoku.23 Stejně jako jeho předchůdce má pozoruhodný výskyt alergie (až 20 %), která se může objevit až osm měsíců po zahájení léčby.22 Byly vyvinuty tři přípravky, každý s podobnou účinností: 0,2 % s benzalkoniumchloridem (BAK); a 0,15 % a 0,1 % s konzervační látkou Purite.24 Společnost Allergan od té doby přestala používat přípravek s konzervační látkou BAK.
Přímá droga
Medicínská marihuana se v poslední době dostává do popředí zájmu díky řadě legislativních změn ve Spojených státech. Přestože je jako metoda snižování IOP zkoumána již od 70. let 20. století, badatelé zjistili, že je schopna snižovat IOP pouze po krátkou dobu. To z něj spolu s poměrně silným profilem vedlejších účinků dělá špatného kandidáta na léčbu. Podle výzkumu však může hrát roli u „pacientů v konečném stadiu glaukomu, u nichž selhala maximální medikamentózní léčba a chirurgický zákrok nebo kteří jsou špatnými kandidáty na chirurgický zákrok.“
Sun X, Xu C, Chadha N,et al. Marijuana for glaucoma: a recipe for disaster or treatment? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Ačkoli nežádoucí účinky většinou korelují s užíváním prostaglandinů, v literatuře se uvádí brimonidinem indukovaná přední uveitida.25 Doba trvání se pohybovala od sedmi dnů do pěti let s průměrem téměř 20 měsíců.
Analoga prostaglandinů
Ty poskytují nejsilnější snížení IOP ze všech kapek tím, že zvyšují uveosklerální odtok vody. Analoga prostaglandinů (PGA) se vážou na receptory v ciliárním tělese a vyvolávají relaxaci hladkého svalstva a mění extracelulární matrix v ciliárním svalu, čímž zvyšují odtok vody uveosklerální cestou.26 Dávkování jednou denně, obvykle před spaním, přináší snížení IOP o 30 až 35 %; mezi možnosti patří latanoprost, bimatoprost, travoprost a tafluprost (dodávaný v jednodávkové variantě bez konzervačních látek).26 Nejčastějším nežádoucím účinkem PGA je hyperémie spojivky, často v prvních několika týdnech po zahájení léčby.26 Může se také objevit podráždění očí, zhoršení stávajících zánětlivých stavů (makulární edém, iritida), atrofie periorbitálního tukového polštářku, pigmentace periokulární kůže, řas a duhovky a hypertrichóza.26
Novou variantou v kategorii analog prostaglandinů je latanoprosten bunod 0,024 %. Tato sloučenina má dvojí mechanismus: zvyšuje uveosklerální odtok a zvyšuje odtok z trabekulární síťky vlivem oxidu dusnatého.27 Oko rozkládá latanoprosten bunod dvakrát za vzniku účinných složek kyseliny latanoprostové a oxidu dusnatého.28 Ten ovlivňuje signální dráhu, která uvolňuje kontraktilní složky v TM, což zvyšuje odtok.28 Další vliv snižuje IOP >1 mm Hg oproti samotnému latanoprostu ve více časových bodech, přičemž celkové snížení IOP se pohybuje od 7,5 mm Hg do 9,1 mm Hg. Nežádoucí účinky s latanoprostem bunod byly podle zkoušejících srovnatelné s nežádoucími účinky samotného latanoprostu, s možným menším výskytem periokulární pigmentace a hypertrichózy.28,29
Inhibitory ROCK
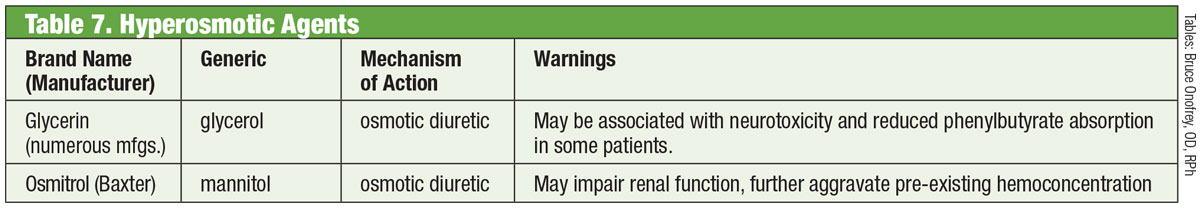
V normálním oku je hlavní odtokovou cestou pro vodnatý humor TM. U pacientů s glaukomem je odpor pro odtok vodního moku touto strukturou zvýšený, což zvyšuje IOP.30 Až donedávna se léky proti glaukomu nedařilo na tuto strukturu zaměřit. To se změnilo v roce 2017 uvedením přípravku Rhopressa (netarsudil 0,02 %, Aerie), inhibitoru rho-kinázy (ROCK).
Tabulka: Bruce Onofrey, OD, RPh. Kliknutím na obrázek jej zvětšíte.
Rho-kináza je široce exprimována v mnoha tkáních, včetně TM, kde podporuje sestavování aktinových stresových vláken a reguluje buněčnou kontrakci.31 Inhibitory ROCK zvyšují odtok vody tím, že snižují buněčnou kontrakci poháněnou aktinem a myozinem a snižují produkci proteinů extracelulární matrix.32 Rhopressa má také inhibiční účinek proti noradrenalinovému transportéru (NET), což z ní činí inhibitor ROCK/NET. Mechanismus NET může být důsledkem snížení průtoku krve do ciliárního tělesa prostřednictvím norepinefrinem indukované vazokonstrikce, což má za následek snížení produkce vody.33 Netarsudil navíc také snižuje episklerální venózní tlak (EVP), čímž poskytuje více cest ke snížení IOP.32 Nejčastějším očním nežádoucím účinkem je oční hyperémie (asi polovina léčených pacientů), která je většinou mírná, přechodná a samovolně odeznívající.32
Je třeba zmínit, že samotný rho hraje důležitou roli v růstu a vedení axonů a také v regulaci přežívání a odumírání neuronů.34 Výzkumníci zjistili, že po poranění zrakového nervu lokální aplikace netarsudilu snižuje odumírání gangliových buněk sítnice a podporuje regeneraci axonů.34
Přistupujeme ke kombinaci
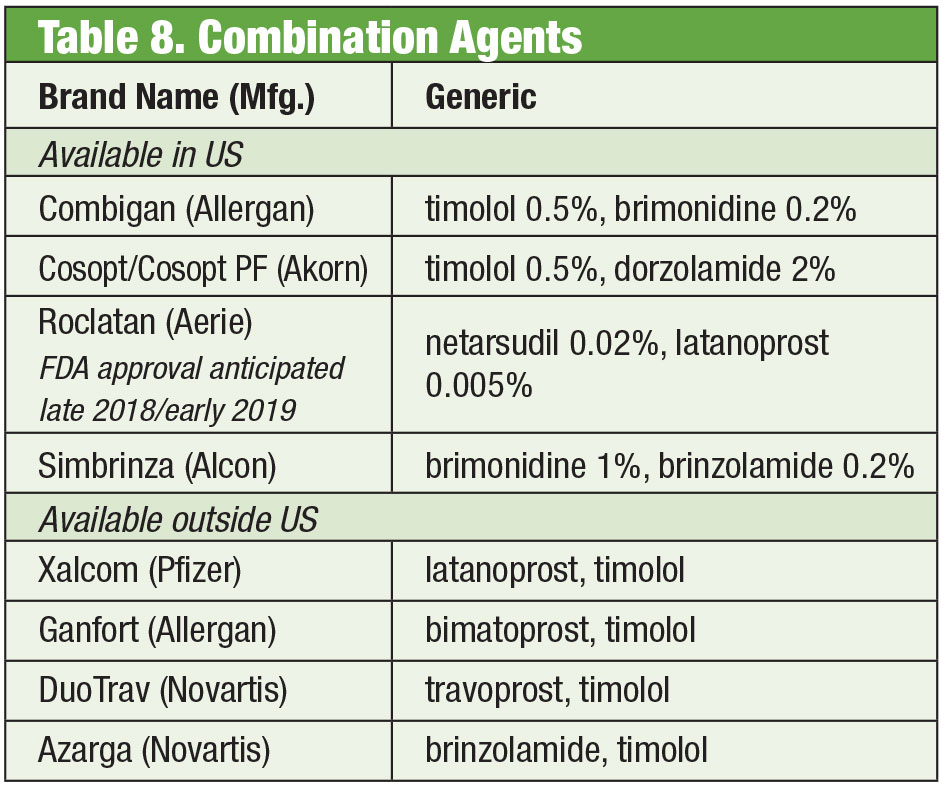
Někdy pacienti potřebují více, než nabízejí volně prodejné přípravky. Citlivost pacientů nebo toxicita očního povrchu v důsledku chronického používání konzervačních látek může vést k hledání alternativ. Některé složené léky jsou dostupné bez konzervačních látek. Pokud je problém s dodržováním předpisů, mohou tyto směsi obsahovat až čtyři léky v jedné lahvičce. Dále se mnoho fixních kombinací účinně používá mimo Spojené státy, ale v současné době nejsou schváleny úřadem FDA; compounding umožňuje americkým lékařům přístup k těmto režimům. Pokud jsou omezením náklady, může být compounding další výhodou. Ačkoli složený přípravek často není hrazen z pojištění pacienta, cena jednoho nebo dvou kombinovaných přípravků může být cenově výhodnější než cena více variant jednotlivých léků, a to i generických přípravků. Dvě kombinované lékárny nabízejí více přednastavených variant: Simple Drops od společnosti Imprimis Pharmaceuticals a Omni prodcut line od společnosti Ocular Science. U každé z nich je také možné další přizpůsobení.
Ačkoli jsou jednotlivé přípravky schváleny FDA, konkrétní kombinace schváleny být nemusí. Je na praktickém lékaři, aby zvážil rizika a přínosy shody.
Kombinované glaukomové přípravky:
Kapky Simple (Imprimis Pharmaceuticals)
Všechny dostupné bez konzervačních látek.
– Tim-Lat PF (timolol/latanoprost)
– Brim-Dor PF (brimonidin/dorzolamid)
– Tim-Brim-Dor PF (timolol/brimonidin/dorzolamid)
– Tim-Dor-Lat PF (timolol/dorzolamid/latanoprost)
– Tim-.Brim-Dor-Lat PF (timolol/brinzolamid/dorzolamid/latanoprost)
– Dor-Tim (dorzolamid/timolol)
– Dorzolamid PF
– Latanoprost PF
Omni kapky (Ocular Science)
Obsahují benzalkonium chlorid, ale v nižších koncentracích (0.001%) než běžné generické přípravky (0,002%).
– Timolol/latanoprost
– Timolol/brimonidin/dorzolamid (AM formule)*
– Timolol/brimonidin/dorzolamid/latanoprost (PM formule)*
* Určeno k jednotnému použití, přičemž AM verze neobsahuje prostaglandin, který se běžně dávkuje pouze jednou denně.
Fixní kombinované přípravky
I přes účinnost těchto jednotlivých přípravků je běžné, že mnoho pacientů s glaukomem vyžaduje ke kontrole svého stavu více terapií.35 Pokud je nutná dvojí terapie, může být nejlepší nabídnout stejný dávkovač, což podporuje větší compliance a snižuje dopad toxicity na povrch oka.36 Timolol se kombinuje s brimonidinem (jako Combigan, Allergan) a dorzolamidem (jako Cosopt, Akorn), oba se dávkují dvakrát denně, přičemž pro přípravek timolol-dorzolamid je k dispozici varianta bez konzervačních látek. Další kombinace dvakrát denně – Simbrinza – kombinuje brimonidin a dorzolamid. Fixní kombinace vykazují dobrou účinnost jak jako primární terapie, tak jako doplněk k PGA. Nežádoucí účinky jsou srovnatelné s jednotlivými složkami.
Adherence/Pacientovo vnímání
Přestože rozhodnutí o doporučení léčby může být složité a závisí na mnoha faktorech, jakmile se lékař a pacient dohodnou na zahájení léčby, je třeba vzít na vědomí určitá základní fakta a použít základní zásady.
Kliknutím na obrázek jej zvětšíte.
Progrese zorného pole a závažnost onemocnění souvisí se špatnou adherencí.37 Podle jedné studie pacienti s chronickými onemocněními užívají v průměru 30 až 70 % předepsaných dávek léků a 50 % z nich přeruší léčbu během několika prvních měsíců léčby.38 Adherence k léčbě glaukomu je podobně špatná jako u jiných chronických onemocnění.39 V souladu s tím může existovat mezera mezi účinností a efektivitou, kdy ačkoli bylo ve velkých klinických studiích prokázáno, že lokální léky jsou účinné, v praxi mohou být kvůli nedodržování léčby ze strany pacientů neúčinné.39
Hlavními faktory, které přispívají ke špatné adherenci u glaukomu, jsou mimo jiné: profil nežádoucích účinků léků, náklady na léčbu, vzdělávání pacientů a vztah mezi lékařem a pacientem.40 Kromě toho může být onemocnění až do pozdní fáze svého průběhu asymptomatické a chybí povědomí o výpadku zorného pole.41
A teď něco úplně jiného
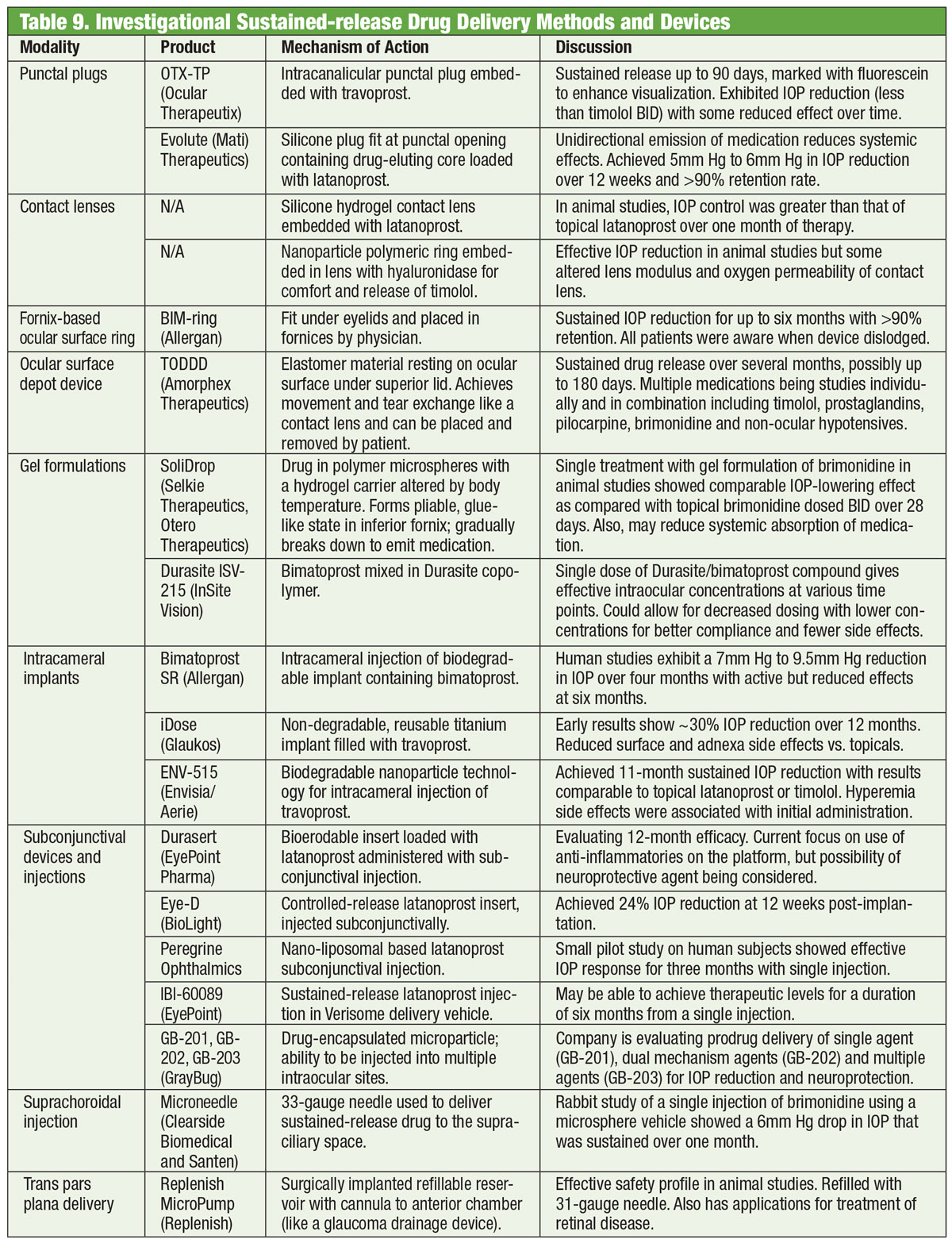
Medikamenty jsou páteří léčby glaukomu již více než sto let a vývoj nových léků neustává. Někteří výzkumníci však hledají alternativy mimo lahvičky. Brýle osazené elektromagnetickou cívkou spolu s kontaktní čočkou obsahující stopové množství zlata mohou jednoho dne pomoci snížit IOP. Kombinace vyvinutá společností Bionode je navržena tak, aby generovala elektrický proud, který protéká řasnatými svaly a stimuluje přirozenou drenážní cestu a snižuje IOP.
Americká oftalmologická akademie. Brýle mohou jednoho dne léčit glaukom. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Přístup 3. července 2018.
Další překážkou adherence jsou potíže s instilací kapek a dávkovacím plánem.42 Ve skutečnosti až 80 % pacientů kontaminuje kapky dotykem obličeje, až 61 % pacientů si nevstřikuje přesně jednu kapku a, což je nejkritičtější, až 37 % pacientů se s kapkou netrefí do oka.43 Praktický lékař by nikdy neměl předpokládat, že pacient je v instilaci kapek zběhlý. Před zahájením kapkové terapie pacienta naučte, jak správně kapky vpravovat, a před odchodem z ordinace mu vpravování kapek úspěšně předveďte. Tuto činnost lze efektivně delegovat na optometrického technika a posílit pomocí edukačního letáku o technice (PDF k vytištění na www.glaucoma.org/treatment/eyedrop-tips.php) a také pomocí videí, jako je například video z produkce Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Pokud má pacient značné potíže s vpravováním očních kapek, může pravděpodobnost úspěchu zvýšit mechanická dávkovací pomůcka. Dodržování správného dávkovacího schématu se zlepšuje při použití automatických připomínek založených na telekomunikaci, aplikací pro připomínání na chytrých telefonech a tabletech.44,45 Ke zlepšení adherence by měla být využita kombinace edukace v ordinaci, stanovení cílů, zjednodušeného režimu kapání a technologie.46 Řešení známých překážek v adherenci k medikaci je nezbytným prvním krokem k úspěchu.
Snížení tlaku
IOP je jediným známým modifikovatelným rizikovým faktorem glaukomu a jeho snížení nesporně prokazatelně snižuje riziko progrese onemocnění.47,48 Účinné snížení IOP se tak stává cílem při léčbě pacientů s glaukomem. Po přesné klasifikaci onemocnění se obvykle stanoví terapeutický cíl. Preferované praktické postupy ve Spojených státech naznačují použití cílového rozmezí IOP, o kterém se lékař domnívá, že perspektivně sníží celoživotní riziko slepoty pacientů a současně minimalizuje zátěž spojenou s léčbou.49-52
Ačkoli při stanovení počáteční cílové IOP může pomoci více metodik (prahová IOP, vypočítaná, jedna velikost pro všechny), nejjednodušší a na důkazech založená metoda spočívá ve snížení IOP o určité procento z výchozí maximální denní IOP, při které dochází k poškození zrakového nervu. IOP je dynamická a vykazuje krátkodobé i dlouhodobé výkyvy, což způsobuje, že v současnosti dostupná tonometrie není dokonale reprodukovatelná. Proto se doporučuje, aby lékař před zahájením léčby získal více měření IOP v různých denních dobách, aby se pokusil stanovit denní vrchol IOP, z něhož by vycházel cílový rozsah.53-55 Není-li však možné získat více 24hodinových křivek IOP, je nepravděpodobné, že by byl skutečný vrchol někdy zachycen. Lékař nakonec bude muset úspěšnost léčby posoudit podle snížení rychlosti progrese při strukturálních a funkčních testech.48,56,57
Doporučené procento cílového snížení IOP se pohybuje od 20 % do 50 % v závislosti na stavu (tj, podezření na glaukom, oční hypertenze, glaukom s normálním napětím, glaukom s vysokým napětím, glaukom s uzavřeným úhlem) základní závažnost onemocnění a očekávaná délka života.58-61
Tabulka: Bruce Onofrey, OD, RPh. Kliknutím na obrázek jej zvětšíte.
Začínáme
PGA jsou ve Spojených státech schváleny pro léčbu první linie a jsou účinnější při snižování IOP, mají relativně omezený profil nežádoucích účinků a dávkují se méně často (jednou denně) než jiné třídy léků.62,63
Po výběru konkrétního přípravku by měl být pacient znovu navštíven nejdéle za čtyři týdny, aby se posoudila účinnost kapky, předešlo se případným nežádoucím účinkům, zajistila se adherence pacienta a posílila se hodnota léčby.
K minimalizaci ztráty zraku nakonec pomůže řádná edukace a bedlivé sledování se strukturálním a funkčním testováním.
Dr. Dorkowski je klinickým koordinátorem programu pro domovy důchodců a asistované bydlení ve společnosti SCO.
Dr. Williamson je vedoucím rezidentů v Memphis VA Medical Center.
Dr. Rixon je ošetřujícím lékařem ve VA Memphis a je členem Optometrické glaukomové společnosti.
Dr. Onofrey je autorem příručky The Ocular Therapeutics Handbook (Příručka oční terapie).
1. Zimmerman TJ, William P. BogerIII. Beta-adrenergní blokátory a léčba glaukomu. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. A history of glaucoma pharmacology. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Direct effects of muscarinic agents on the outflow pathways in human eyes. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. Mechanismus účinku adrenergních léčiv u glaukomu. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl epinefrin: nové proléčivo v léčbě glaukomu. Oftalmologie. 1978;85(3):268-75.
7. Neufeld AH. Experimentální studie mechanismu účinku timololu. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. Mechanismus timololu při snižování nitroočního tlaku: U normálního oka. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Beta adrenergní receptory v pigmentových ciliárních výběžcích. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Distribuce a vlastnosti beta-adrenergních receptorů v lidském duhovkovém tělísku. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. Dvojité maskované srovnání betaxololu a timololu v léčbě glaukomu s otevřeným úhlem. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Oftalmologické beta-blokátory od timololu. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Hodnocení timololu u chronického glaukomu s otevřeným úhlem: Jednou denně vs dvakrát denně. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Účinky timololu, epinefrinu a acetazolamidu na vodní tok během spánku. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Cirkadiánní změny nitroočního tlaku při užívání beta-blokátorů. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Vliv systémové léčby beta-blokátory na účinnost a bezpečnost lokálního brimonidinu a timololu. Brimonidinové studijní skupiny 1 a 2. Ophthalmology: Oční lékařství. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaukom a systémová onemocnění. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Farmakologické a oční hypotenzní vlastnosti lokálních inhibitorů karboanhydrázy. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Topical drug delivery to the eye: dorzolamide [Lokální podávání léčiv do oka: dorzolamid]. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamidová oftalmická suspenze: přehled farmakologie a použití v léčbě glaukomu s otevřeným úhlem a oční hypertenze. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Porovnání aditivního účinku latanoprostu a dorzolamidu na snížení nitroočního tlaku při přidání k timololu u pacientů s glaukomem s otevřeným úhlem nebo oční hypertenzí: randomizovaná, otevřená, multicentrická studie v Řecku. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Výskyt alergie na brimonidin u pacientů dříve alergických na apraklonidin. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Účinnost a bezpečnost brimonidinu jako doplňkové léčby pacientů se zvýšeným nitroočním tlakem ve velké otevřené komunitní studii. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidin-purite 0,1 % versus brimonidin-purite 0,15 % dvakrát denně u glaukomu nebo oční hypertenze: 12měsíční randomizovaná studie. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidinem indukovaná přední uveitida. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Aktuální informace o mechanismu účinku lokálních prostaglandinů pro snížení nitroočního tlaku. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Účinnost latanoprostenu bunod 0,024 % ve srovnání s timololem 0,5 % při snižování nitroočního tlaku po dobu 24 hodin. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprosten bunod oční roztok 0,024 % pro snížení IOP u glaukomu a oční hypertenze. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Srovnání latanoprostenu bunod 0,024% a timolol maleátu 0,5% u glaukomu s otevřeným úhlem nebo oční hypertenze: Studie LUNAR. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. Trabekulární síťovina: A basic review of form and function (Základní přehled formy a funkce). J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Přístup 29. června 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Objev inhibitoru ROCK netarsudilu pro léčbu glaukomu s otevřeným úhlem. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Dvě klinické studie fáze 3 srovnávající bezpečnost a účinnost netarsudilu s timololem u pacientů se zvýšeným nitroočním tlakem: Rho kinase elevated iop treatment trial 1 a 2 (ROCKET-1 a ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Discovery and preclinical development of netarsudil, a novel ocular hypotensive agent for the treatment of glaucoma. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. Topické podání inhibitoru rock/net podporuje přežívání gangliových buněk sítnice a regeneraci axonů po poranění zrakového nervu. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Modely přídatné léčby u pacientů s glaukomem pomocí analogů prostaglandinů. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Fixní kombinace. Glaukom dnes. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. Do adherence rates and glaucomatous visual field progression correlate? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Using pharmacy claims data to study adherence to glaucoma medures: methodology and findings of the Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Effectiveness of intraocular pressure-lowering medication determined by washout. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Why do people (still) go blind from glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. Pohled na glaukom – vidíme ho jasně? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. The most common barriers to glaucoma medication adherence [Nejčastější překážky v dodržování léčby glaukomu]: Průřezový průzkum. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Instilace kapek a glaukom. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automated telecommunication-based reminders and adherence with once-daily glaucoma medication dosing: The automated dosing reminder study (Studie automatického připomínání dávkování). JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: Zájem pacientů a jejich ošetřovatelů o glaukomovou aplikaci pro chytré telefony a tablety. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Atributy spojené s adherencí k medikamentózní léčbě glaukomu a její vliv na výsledky léčby glaukomu: Přehled založený na důkazech a potenciální strategie ke zlepšení adherence. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. New perspectives on target intraocular pressure. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalizace nitroočního tlaku: Cílový nitrooční tlak v podmínkách 24hodinového monitorování nitroočního tlaku. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Cílový tlak v terapii glaukomu. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Péče o pacienta s glaukomem s otevřeným úhlem. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Časné agresivní snížení nitroočního tlaku, cílový nitrooční tlak a nový koncept péče o glaukom. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Diurnal intraocular pressure patterns are not repeatable in the short term in healthy individuals [Denní vzorce nitroočního tlaku nejsou u zdravých jedinců krátkodobě opakovatelné]. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Long-term reproducibility of diurnal intraocular pressure patterns in patients with glaucoma. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Denní variabilita nitroočního tlaku u glaukomu a oční hypertenze. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or preventents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Snížení nitroočního tlaku a progrese glaukomu: Výsledky studie Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. Pokročilá glaukomová intervenční studie (AGIS): The relationship between the control of intraocular pressure and visual field deterioration (Vztah mezi kontrolou nitroočního tlaku a zhoršením zorného pole). Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Visual field progression in the collaborative initial glaucoma treatment study [Progrese zorného pole v kolaborativní studii počáteční léčby glaukomu]. Vliv léčby a dalších výchozích faktorů. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost v léčbě glaukomu. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Dopad zavedení generického latanoprostu na adherenci k léčbě glaukomu. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. A randomized, controlled comparison of latanoprostene bunod and latanoprost 0,005% in the treatment of ocular hypertension and open angle glaucoma: Studie VOYAGER. Br J Ophthalmol. 2015;99(6):738-45.