Celler indeholder masser af vand. En af vandets roller er at opløse forskellige materialer. Der er f.eks. mange forskellige ionforbindelser (salte) i cellerne. Ioner bruges til at opretholde cellepotentialer og er vigtige for cellesignalering og muskelkontraktion.
Hvordan kan man se, om en forbindelse er ionisk eller kovalent?
Der er ikke et enkelt svar på dette spørgsmål. Mange bindinger ligger et sted midt imellem. I en polær kovalent binding deles et elektronpar mellem to atomer for at opfylde deres oktet, men elektronerne ligger tættere på den ene ende af bindingen end på den anden. Der er mere negativ ladning mod den ene ende af bindingen, og det efterlader mere positiv ladning i den anden ende.
Hvis man ser på de forskellige atomers elektronegativitetsværdier, kan man afgøre, hvor jævnt et elektronpar i en binding er delt. Elektronegativiteten stiger mod det øverste højre hjørne af det periodiske system på grund af en kombination af kerneladning og afskærmningsfaktorer. Atomer i det øverste højre hjørne af det periodiske system har en større tiltrækningskraft på deres delte bindingselektroner, mens atomer i det nederste venstre hjørne har en svagere tiltrækningskraft på elektronerne i kovalente bindinger.
I en kulstof-oxygenbinding vil flere elektroner blive tiltrukket af oxygen, fordi det ligger til højre for carbon i dets række i det periodiske system. Forbindelser som , dimethylether, CH3OCH3, er en smule polære. Formaldehyd, CH2O, er endnu mere polær. Elektroner i pi-bindinger holdes mere løst end elektroner i sigma-bindinger af kvantemekaniske årsager. Det gør det muligt for ilten at trække elektronerne til sig lettere i en flerbinding end i en sigma-binding.

Det er ikke alle polariteter, der er lette at bestemme ved at kaste et blik på det periodiske system. Dipolens retning i en bor-vækststof-binding ville være vanskelig at forudsige uden at slå elektronegativitetsværdierne op, da bor ligger længere til højre, men brint ligger højere oppe. Det viser sig, at hydrogenet er lidt negativt.
En binding er ionisk, hvis forskellen i elektronegativitet mellem atomerne er stor nok til, at det ene atom kan trække en elektron helt væk fra det andet atom. Den situation er almindelig i forbindelser, der kombinerer grundstoffer fra den venstre kant af det periodiske system (natrium, kalium, calcium osv.) med grundstoffer i det yderste øverste højre hjørne af det periodiske system (oftest oxygen, fluor, klor). Natriumchlorid er en ionisk forbindelse.
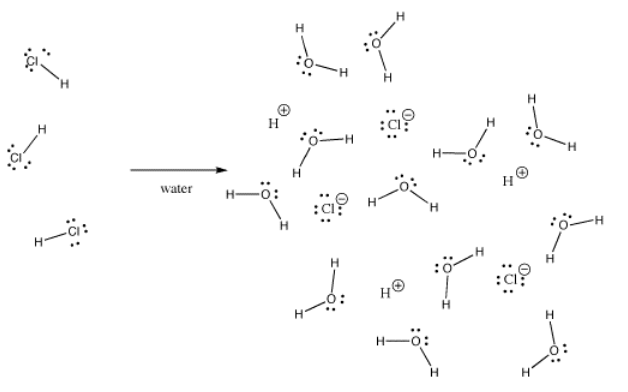
Mange bindinger kan være kovalente i én situation og ioniske i en anden. For eksempel er hydrogenchlorid, HCl, en gas, hvor hydrogen og chlor er kovalent bundet, men hvis HCl bobles ind i vand, ioniseres det fuldstændigt og giver H+ og Cl- i en saltsyreopløsning. Selv i gasformigt HCl er ladningen ikke jævnt fordelt. Kloren er delvist negativ, og hydrogenet er delvist positivt.
Kaliumhydroxid, KOH, indeholder en kovalent binding (O-H) og en ionisk binding (K-O). Brint er tricky, fordi det er både øverst i det periodiske system og i venstre side. Det er lige elektropositivt nok til at danne ioniske bindinger i nogle tilfælde. Det er lige elektronegativt nok til at danne kovalente bindinger i andre tilfælde.
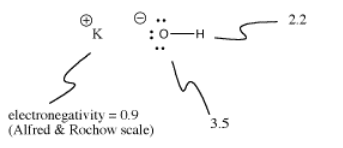
I KOH er K-O-bindingen ionisk, fordi forskellen i elektronegativitet mellem kalium og oxygen er stor. Forskellen i elektronegativitet mellem ilt og brint er ikke lille. En O-H-binding kan nogle gange ionisere, men ikke i alle tilfælde.
Sommetider afhænger ioniseringen af, hvad der ellers foregår i et molekyle. Fordi K-O-bindingen i kaliumhydroxid er ionisk, er der ikke stor sandsynlighed for, at O-H-bindingen ioniserer. Der er allerede en negativ ladning på oxygen. Ladningsadskillelse koster energi, så det er vanskeligere at sætte en anden negativ ladning på ilten ved også at ionisere O-H-bindingen. Ofte er første ioniseringer i molekyler meget lettere end anden ioniseringer.
Ovelse \(\PageIndex{1}\)
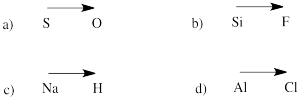
Forudsig polaritetsretningen i en binding mellem atomerne i de følgende par:
a) svovl-oxygen b) silicium-fluor
c) hydrogen-natrium d) klor-aluminium
Svar
Da det er så almindeligt, at et grundstof fra den yderste venstre side af det periodiske system er til stede som et kation, og at grundstoffer yderst til højre bærer negativ ladning, kan vi ofte antage, at en forbindelse, der indeholder et eksempel på hvert af dem, vil have mindst én ionisk binding.
Ovelse \(\PageIndex{2}\)
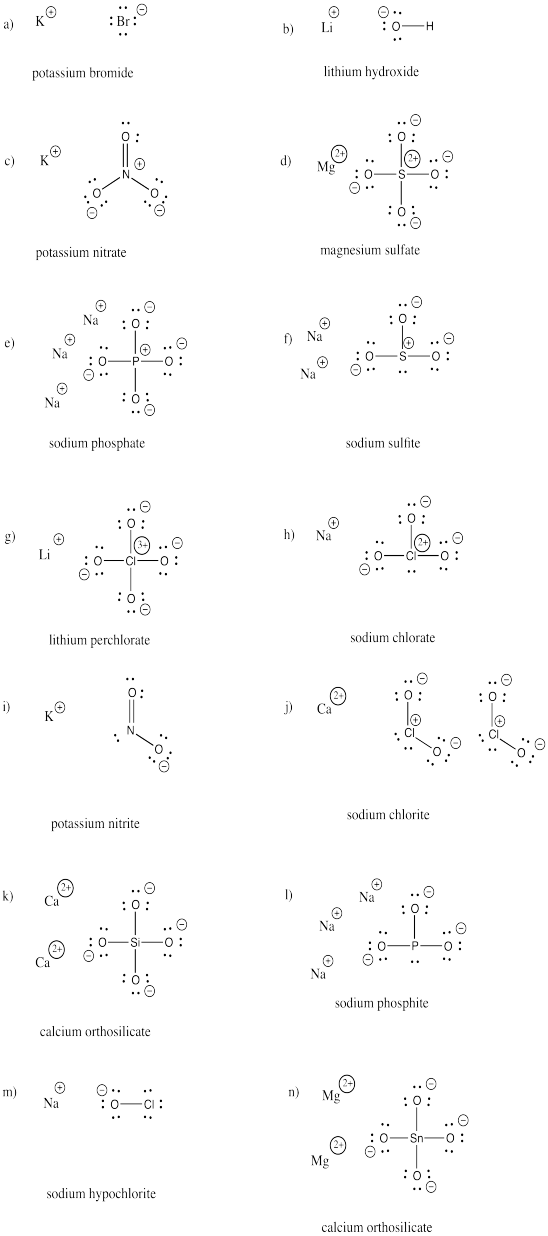
Tegn strukturerne for følgende forbindelser. Hver af dem indeholder mindst en anion og et kation.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Svar
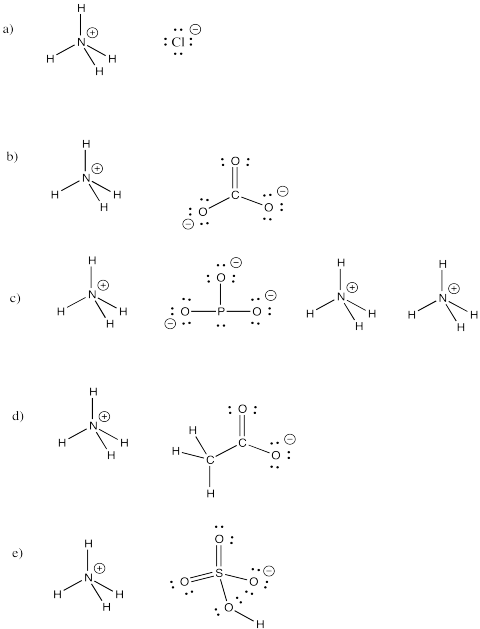
Opgave \(\PageIndex{3}\)
Ammoniumion, NH4+, er en almindelig molekylær ion. Tegn strukturerne for følgende forbindelser, der indeholder denne ion:
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Svar
Ovelse \(\PageIndex{4}\)
Mange anioner har navne, der fortæller noget om deres struktur.
| præfiks – eller -suffiks |
almindelig betydning |
eksempel på navn | eksempel på formel |
| -ide | atom er til stede som anion | chlorid | Cl – |
| -ate | atom er til stede som en oxyanion; normalt en almindelig form | chlorat | ClO3- |
| -it | -atom er til stede som en oxyanion, men med færre oxygenatomer (eller lavere “oxidationstrin”) end en anden almindelig form | chlorit | ClO2- |
| per- | atom er til stede som en oxyanion, men med endnu flere oxygenatomer end “-ate”-formen | perchlorat | ClO4- |
| hypo- | atom er til stede som en oxyanion, men med endnu færre oxygenatomer end “-it”-formen | hypochlorit | ClO- |
Samlet med tabellen som rettesnor foreslås navne for følgende anioner:
a) Br- b) O2- c) F- d) CO32- (almindelig oxyanion) e) NO3- (almindelig oxyanion) f) NO2-
g) S2- h) SO42- (almindelig oxanin) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (almindelig oxyanion) o) PO33- p) I- q) IO3- (almindelig oxyanion) r) IO4-
Svar a)
bromid
Svar b)
oxid
Svar c)
fluorid
Svar d)
carbonat
Svar e)
nitrat
Svar f)
nitrit
Svar g)
sulfid
Svar h)
sulfat
Svar i)
sulfit
Svar j)
persulfat
Svar k)
carbid
Svar l)
nitrid
Svar m)
arsenid
Svar n)
phosphat
Svar o)
sulfat
Svar o)
sulfat
fosfit
Svar p)
iodid
Svar q)
iodat
Svar r)
periodat
Attribution
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)