Atomemissionsspektre
Elektronerne i et atom har en tendens til at være arrangeret på en sådan måde, at atomets energi er så lav som muligt. Et atoms grundtilstand er den laveste energitilstand i et atom. Når disse atomer får tilført energi, absorberer elektronerne energien og bevæger sig til et højere energiniveau. Disse energiniveauer for elektronerne i atomerne er kvantiserede, hvilket igen betyder, at elektronen skal bevæge sig fra et energiniveau til et andet i diskrete trin, snarere end kontinuerligt. En exciteret tilstand i et atom er en tilstand, hvor dets potentielle energi er højere end grundtilstanden. Et atom i den exciterede tilstand er ikke stabilt. Når det vender tilbage til grundtilstanden, frigiver det den energi, som det tidligere havde opnået i form af elektromagnetisk stråling.
Så hvordan opnår atomer overhovedet energi? En måde er at lade en elektrisk strøm passere gennem en indesluttet prøve af en gas ved lavt tryk. Da elektronernes energiniveauer er unikke for hvert grundstof, vil hvert gasudladningsrør gløde med en karakteristisk farve afhængigt af gassens identitet (se nedenfor).

“Neon”-skilte er velkendte eksempler på gasudladningsrør. Men kun skilte, der lyser med den rød-orange farve, der ses på figuren, er faktisk fyldt med neon. Skilte med andre farver indeholder forskellige gasser eller blandinger af gasser.
Videnskabsfolk har studeret den karakteristiske lyserøde farve af gasudladninger, der skabes af brintgas. Når en smal stråle af dette lys blev set gennem et prisme, blev lyset adskilt i fire linjer med meget specifikke bølgelængder (og frekvenser, da \(\lambda\) og \(\nu\) er omvendt relateret). Et atomemissionsspektrum er det mønster af linjer, der dannes, når lys passerer gennem et prisme for at adskille det i de forskellige lysfrekvenser, det indeholder. Figuren nedenfor viser det atomare emissionsspektrum for brint.
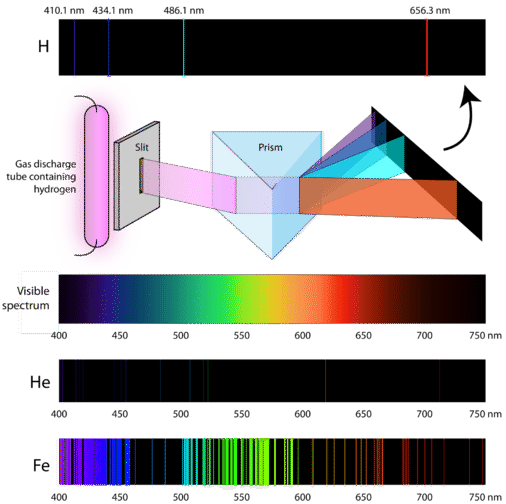
Den klassiske teori var ikke i stand til at forklare eksistensen af atomemissionsspektre, også kendt som linjeemissionsspektre. Ifølge den klassiske fysik ville et atom i grundtilstand være i stand til at absorbere enhver mængde energi i stedet for kun diskrete mængder. På samme måde kunne enhver mængde energi frigives, når atomerne slappede tilbage til en lavere energitilstand, når de slappede af til en lavere energitilstand. Dette ville resultere i det, der er kendt som et kontinuerligt spektrum, hvor alle bølgelængder og frekvenser er repræsenteret. Hvidt lys set gennem et prisme og en regnbue er eksempler på kontinuerlige spektrer. Atomemissionsspektrer var et yderligere bevis på lysets kvantiserede natur og førte til en ny model af atomet baseret på kvanteteori.