Periodiske tendenser
Først vil vi fokusere på individuelle atomer og tænke på tendenser, der er forbundet med et grundstofs placering i det periodiske system. Vi vil som vores første modeller bruge de simple organiske forbindelser ethan, methylamin og ethanol, men begreberne gælder også for mere komplekse biomolekyler med de samme funktionaliteter, f.eks. sidekæderne i aminosyrerne alanin (alkan), lysin (amin) og serin (alkohol).
Horisontal periodisk tendens i surhed og basiskhed:
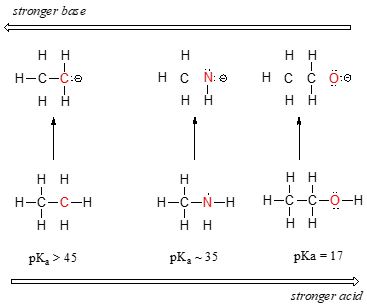
Vi kan se en klar tendens i surhed, når vi bevæger os fra venstre mod højre langs den anden række i det periodiske system fra kulstof til nitrogen til oxygen. Nøglen til at forstå denne tendens er at se på den hypotetiske konjugerede base i hvert enkelt tilfælde: jo mere stabil (svagere) den konjugerede base er, jo stærkere er syren. Se på, hvor den negative ladning ender i hver konjugeret base. I den konjugerede base af ethan er den negative ladning båret af et kulstofatom, mens den negative ladning i den konjugerede base af methylamin og ethanol er placeret på henholdsvis et nitrogen- og et oxygenatom. Husk fra afsnit 2.4A, at elektronegativiteten også stiger, når vi bevæger os fra venstre mod højre langs en række i det periodiske system, hvilket betyder, at ilt er det mest elektronegative af de tre atomer og kulstof det mindst elektronegative.
Note
Jo mere elektronegativt et atom er, jo bedre er det i stand til at bære en negativ ladning. Svagere baser har negative ladninger på mere elektronegative atomer; stærkere baser har negative ladninger på mindre elektronegative atomer.
Sådan er methoxid-anionen den mest stabile (laveste energi, mindst basisk) af de tre konjugerede baser, og ethylcarbanion-anionen er den mindst stabile (højeste energi, mest basisk). Omvendt er ethanol den stærkeste syre og ethan den svageste syre.
Når vi bevæger os lodret inden for en given kolonne i det periodiske system, kan vi igen observere en klar periodisk tendens i syreindholdet. Dette illustreres bedst med haloaciderne og halogeniderne: basiskheden, ligesom elektronegativiteten, øges, når vi bevæger os opad i kolonnen.
Vertikal periodisk tendens i surhedsgrad og basiskhed:

Omvendt stiger surhedsgraden i haloaciderne, når vi bevæger os nedad i søjlen.
For at give mening til denne tendens vil vi endnu en gang se på stabiliteten af de konjugerede baser. Fordi fluor er det mest elektronegative halogenelement, kan vi forvente, at fluorid også er den mindst basiske halogenion. Men i virkeligheden er det den mindst stabile og den mest basiske! Det viser sig, at når man bevæger sig vertikalt i det periodiske system, overtrumfer atomets størrelse dets elektronegativitet med hensyn til basiskhed. Jodets atomradius er ca. dobbelt så stor som fluorets, så i en jodidion er den negative ladning spredt ud over et betydeligt større volumen:

Dette illustrerer et grundlæggende begreb i organisk kemi:
Elektrostatiske ladninger, hvad enten de er positive eller negative, er mere stabile, når de er “spredt ud” over et større område.
Vi vil se denne idé komme til udtryk igen og igen i løbet af vores undersøgelse af organisk reaktivitet i mange forskellige sammenhænge. Indtil videre anvender vi kun begrebet på atomradius’ indflydelse på basestyrken. Fordi fluorid er den mindst stabile (mest basiske) af halogenidkonjugatbaserne, er HF den mindst sure af haloaciderne, kun lidt stærkere end en carboxylsyre. HI er med en \(pK_a\) på ca. -9 næsten lige så stærk som svovlsyre.
Mere vigtigt for studiet af biologisk organisk kemi er det, at denne tendens fortæller os, at thioler er mere sure end alkoholer. \(pK_a\) for thiolgruppen på cystein-sidekæden er f.eks. ca. 8,3, mens \(pK_a\) for alkoholgruppen på serinsidekæden er i størrelsesordenen 17.
Huskede du begrebet “drivkraft”, som blev introduceret i afsnit 6.2? Husk, at drivkraften for en reaktion normalt er baseret på to faktorer: relativ ladningsstabilitet og relativ total bindingsenergi. Lad os se, hvordan dette gælder for en simpel syre-base-reaktion mellem saltsyre og fluoridion:
\
Vi ved, at HCl (\(pK_a\) -7) er en stærkere syre end HF (\(pK_a\) 3.2), så ligevægten for reaktionen ligger på produktsiden: reaktionen er exergonisk, og en “drivkraft” skubber reaktanten til produktet.
Hvad forklarer denne drivkraft? Overvej først ladningsfaktoren: Som vi netop har lært, er kloridionen (på produktsiden) mere stabil end fluoridionen (på reaktantsiden). Dette forklarer delvist drivkraften, der går fra reaktant til produkt i denne reaktion: vi går fra en mindre stabil ion til en mere stabil ion.
Hvad med den samlede bindingsenergi, den anden faktor i drivkraften? Hvis man konsulterer en tabel over bindingsenergier, vil man se, at H-F-bindingen på produktsiden er mere energirigtig (stærkere) end H-Cl-bindingen på reaktantsiden: henholdsvis 570 kJ/mol vs. 432 kJ/mol). Dette bidrager også til drivkraften: vi bevæger os fra en svagere (mindre stabil) binding til en stærkere (mere stabil) binding.