24th Annual Glaucoma Report
Følg nedenstående links for at læse andre artikler fra den årlige opdatering om glaukom:
Glaucoma Care with Laser Precision
MIGS Madness: An Atlas of Options
Comanaging Invasive Glaucoma Surgeries
Glaucoma: Livsstilen hos de rige og berømte med antioxidanter (optjen 2 CE-kreditter)
Eksperter har endnu ikke nået konsensus om en universelt accepteret ætiologi for glaukom. De er dog enige om dette: sænkning af det intraokulære tryk (IOP) er den eneste modificerbare risikofaktor, der kan bremse udviklingen. Topisk farmakoterapi er den traditionelle første tilgang, og der er flere muligheder end nogensinde før.
Denne artikel, del tre i vores serie Take Charge of Glaucoma Series, udforsker de mange medikamenter, som OD’er kan anvende, med råd om, hvornår de skal bruge hvilken behandling til hvilke patienter.
Første autonomi
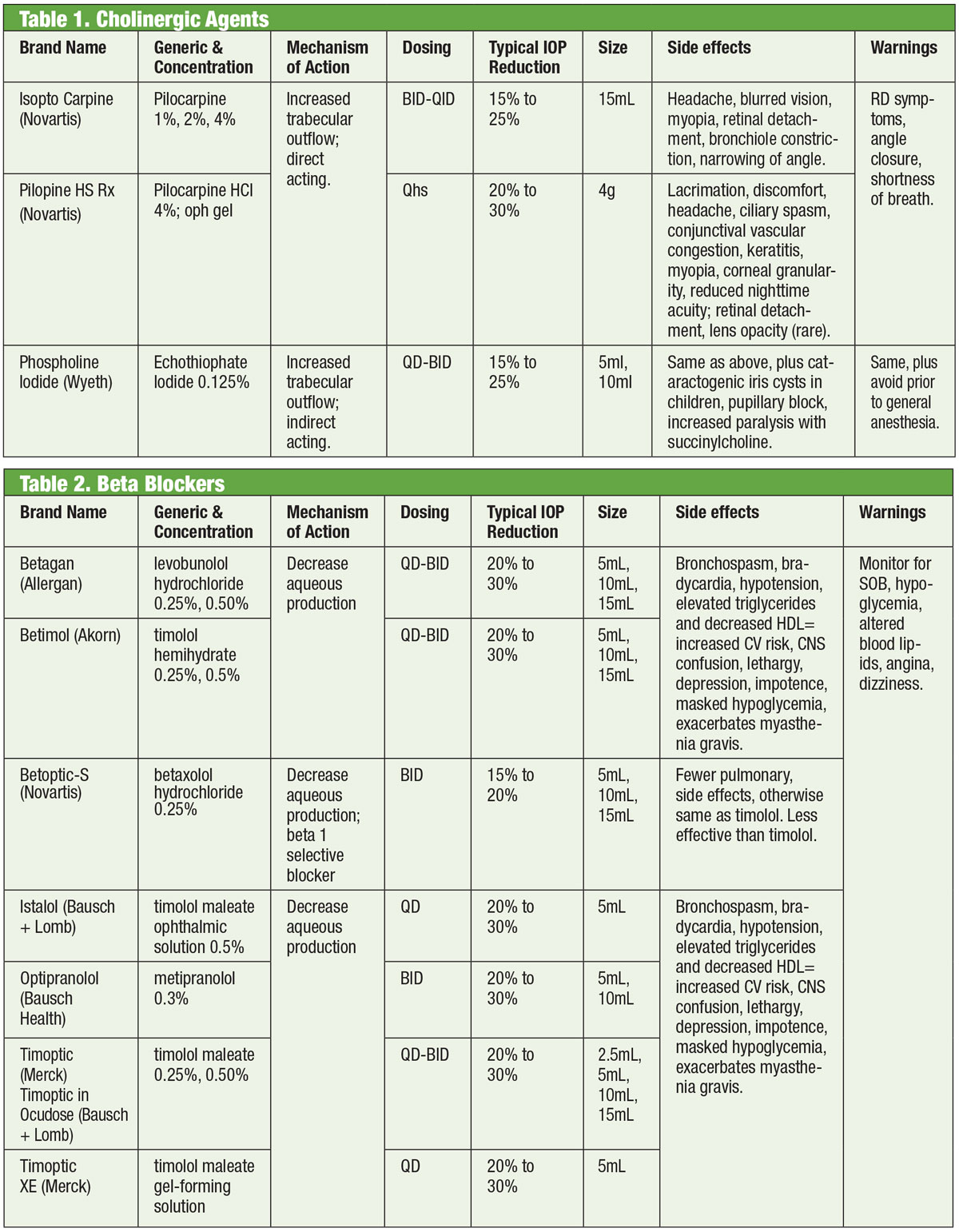
Medikamenter, der virker på det autonome nervesystem (dvs, kolinerge og adrenergika) har været et grundlag for glaukombehandling siden 1800-tallet.1,2 Kolinerge inducerer miosis, som strækker og stimulerer det trabekulære netværk (TM) for at øge vandudstrømningen der og til Schlemm’s kanal.3 Medlemmer af denne klasse omfatter pilocarpin, carbachol, physostigmin, neostigmin og ecothiophat. Af disse er kun pilo stadig i rutinemæssig brug. Behandlingen udviser et dosisrelateret respons med et fald i IOP på ca. 20 %, når det ordineres QID.4
Take Charge of Glaucoma
Følg linkene nedenfor for at læse andre artikler fra vores firedelte glaukomserie:
Del et: Glaucoma: En korstog i primærsektoren
Del to: Forbered din diagnostiske værktøjskasse
Del fire: Spil en rolle i postoperativ glaukombehandling
Og selv om det er effektivt, er kolinergisk brug begrænset af dets okulære og systemiske bivirkninger. Disse omfatter ciliarmuskelspasmer (med tilhørende hovedpine og induceret myopi), miosis, corneal toksicitet, rødme, uveitis, mulig kataraktdannelse, respirationsdepression og gastrointestinal lidelse. Endvidere har nyere lægemidler større IOP-sænkende effekt, hvilket gør, at kolinerge stoffer er forbeholdt specifikke tilfælde, hvor den miotiske effekt kan have en ekstra fordel, f.eks. akut vinkellukning.
Adrenerge agonister påvirker på den anden side alfa- eller beta-adrenerge receptorer (eller begge, hvis de er ikke-selektive). Epinefrin, det primære ikke-selektive middel, reducerer IOP ved først at nedsætte produktionen af vandigt vand og derefter øge udstrømningen gennem TM.5 Desværre har det begrænset anvendelse på grund af betydelige systemiske bivirkninger. Dipivefrin, et prodrug af epinefrin, der blev udviklet i 1970’erne, gør det muligt at anvende meget lavere koncentrationer af moderstoffet med færre systemiske virkninger.6 Ikke-selektive adrenergika anvendes i dag kun minimalt, undtagen i tilfælde, hvor andre lægemidler kan være kontraindiceret.
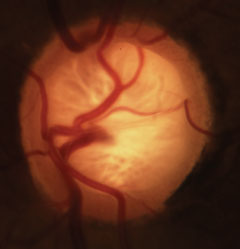
Glaukomatøs cupping med karakteristisk tab af neuroretinal rand, lamina og ændring af vaskulaturen. Klik på billedet for at forstørre det.
Betablokkere
Adrenerge antagonister, eller beta (β)-blokkere, hæmmer vandladningsproduktionen og udgør den standard, hvormed nye lægemidler sammenlignes. Specifikt reducerer β-blokkere ultrafiltrering, hvilket begrænser tilgængeligheden af kammervandssubstrat, der er tilgængeligt til transmission til det bageste kammer.1,7,8 Disse lægemidler kan være ikke-selektive, hvilket betyder, at de hæmmer begge isoformer af de β-adrenerge receptorer (β1 og β2), eller kardioselektive, som har meget større affinitet for β1-receptoren. β2 er øjets fremherskende adrenoreceptor, så ikke-selektive midler vil have en større effekt på IOP-kontrol.9,10
Topiske β-blokkere omfatter timolol, levobunolol, metipranolol, carteolol og betaxolol. Kun betaxolol er kardioselektivt – hvilket gør det nyttigt ved visse kontraindikationer, men det kan være mindre effektivt til at reducere IOP.11 β-blokkere reducerer IOP med 20 % til 30 % og kan doseres to gange dagligt. De kan også doseres én gang dagligt, især ved brug af gelformede opløsninger på grund af deres øgede øjenkontakttid.12,13 Adrenerge antagonister kan have mindre effekt under søvnen, så man skal være forsigtig, når β-blokkere doseres tæt på sengetid, især hvis de ordineres som et én gang dagligt regime.14,15 Hvis patienterne tager systemiske β-blokkere, reduceres den okulære hypotensive effekt af aktuelle β-blokkere, og andre klasser af aktuelle lægemidler kan overvejes.16
Og selv om denne klasse af medicinering for det meste bør undgås ved lungesygdomme eller hjertetilstande, kan det i udvalgte tilfælde være rimeligt at overveje behandling med beta-blokkere. Dette bør dog ske med samtykke fra den relevante specialist (kardiologi eller lungesygdomme).
Tabeller: Bruce Onofrey, OD, RPh. Klik på billedet for at forstørre.
Generelt bør man dog undgå brug af β-blokkere hos personer med atrioventrikulær blok, sinus bradykardi og obstruktiv lungesygdom.17
Carbonsyreanhydrasehæmmere
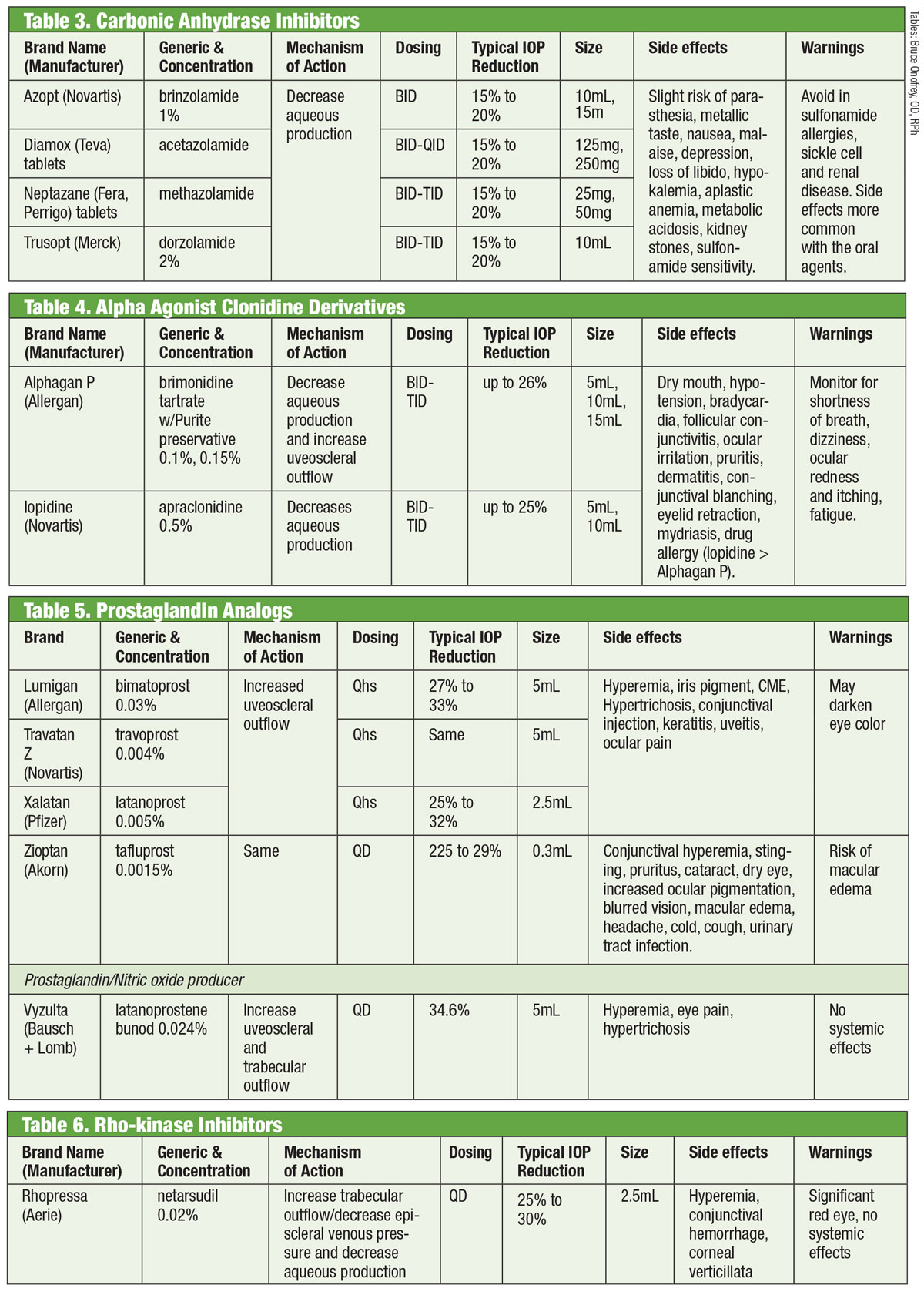
Forskere har siden 1950’erne anerkendt orale carbonsyreanhydrasehæmmere (CAI’er) evne til at sænke IOP.18 De opnår dette ved at undertrykke vandproduktion.18 Systemiske bivirkninger (såsom træthed, gastrointestinale forstyrrelser og paræstesi) begrænser imidlertid deres kroniske brug ved glaukom.18 Orale CAI’er anvendes stadig i tilfælde, hvor topiske CAI’er forårsager overfølsomhed, eller når brugen af dråber er udelukket, samt i tilfælde af akut vinkellukning.18 Forsøg på at formulere en topisk variant lykkedes med introduktionen af dorzolamid i midten af 1990’erne og kort efter brinzolamid.19
Der findes mindst syv forskellige isoenzymer af carbonic anhydrase (CA), hvor CA-II i ciliærprocesserne overvejende er involveret i vandproduktion.18 Både dorzolamid og brinzolamid er potente hæmmere af dette isoenzym, men de har flere klinisk relevante forskelle. For eksempel har dorzolamid en pH-værdi på 5,6, mens brinzolamid har en pH-værdi på 7,5. Desuden fås brinzolamid som en suspension. Dette er blot nogle af de egenskaber, der kan forklare produkternes individuelle bivirkninger, som kan omfatte svie i tilfælde af dorzolamid og sløret syn i tilfælde af brinzolamid.19
Selv om lægemidlerne er FDA-mærket til TID-dosering, vælger nogle behandlere BID-administration. For brinzolamid rapporterer fase III-forsøg om klinisk ækvivalente IOP-reduktioner med enten BID- eller TID-regimer.20 Andre rapporterer ingen statistisk signifikante forskelle mellem BID- eller TID-dosering med dorzolamid.18 Alternativt anbefaler andre TID-dosering til monoterapi og BID-dosering, når det anvendes som supplerende behandling.21
Tabeller: Bruce Onofrey, OD, RPh. Klik på billedet for at forstørre.
Alpha-agonister
Clonidin repræsenterede den tidligste alfa-agonist (AA), der var effektiv til at sænke IOP. Selv i aktuel form gav den imidlertid alvorlige systemiske bivirkninger i form af bradykardi, sedation og hypotension.22 Apraclonidins amidgruppe-substitution mindskede blod-hjernebarrierens penetration og dermed bivirkningerne. Desværre begrænser dets nedsatte effekt over tid og en øget forekomst af okulær allergi det til kortvarig brug.
Brimonidin, der blev introduceret i 1997, er en potent AA med 32 gange større selektivitet for β2-adrenoreceptorer end apraclonidin.22 Det sænker IOP gennem en dobbelt mekanisme, der mindsker vandproduktion og øger uveoskleral udstrømning.23 Ligesom sin forgænger har det en bemærkelsesværdig allergirate (op til 20 %), som kan forekomme op til otte måneder efter behandlingsstart.22 Der er udviklet tre formuleringer, som hver især har samme effekt: 0,2 % med benzalkoniumchlorid (BAK) og 0,15 % og 0,1 % med konserveringsmidlet Purite.24 Allergan har sidenhen indstillet den BAK-konserverede formulering.
The Straight Dope
Medicinsk marihuana har været en stor nyhed på det seneste takket være en række lovændringer i USA. Selv om der er blevet forsket i det som en metode til at reducere IOP siden 1970’erne, har forskerne kun fundet ud af, at det er i stand til at sænke IOP i korte perioder. Dette, kombineret med dens ret kraftige bivirkningsprofil, gør den til en dårlig kandidat til behandling. Forskningen siger dog, at det kan spille en rolle for “slutstadie-glaukom-patienter, der har fejlet maksimal medicinsk behandling og kirurgi, eller som er dårlige kirurgiske kandidater.”
Sun X, Xu C, Chadha N,et al. Marijuana for glaucoma: a recipe for disaster or treatment? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Og selv om bivirkningerne for det meste korrelerer med prostaglandinbrug, viser litteraturen brimonidininduceret anterior uveitis.25 Varigheden varierede fra syv dage til fem år med et gennemsnit på næsten 20 måneder.
Prostaglandinanaloger
Disse giver den mest robuste IOP-reduktion af alle dråber ved at øge den uveosklerale vandige udstrømning. Prostaglandinanaloger (PGA’er) binder sig til receptorer i ciliærlegemet og inducerer afslapning af glatte muskler og ændrer den ekstracellulære matrix i ciliarmusklen for at øge den vandige udstrømning gennem uveosklerale veje26 . PGA’er, der doseres en gang om dagen, almindeligvis ved sengetid, giver en IOP-reduktion på 30-35 %; mulighederne omfatter latanoprost, bimatoprost, travoprost og tafluprost (leveres i en enkeltdosis, konserveringsmiddelfri variant).26 Den mest almindelige bivirkning ved PGA’er er konjunktival hyperæmi, ofte i de første par uger efter behandlingsstart.26 Der kan også ses øjenirritation, forværring af eksisterende inflammatoriske tilstande (makulaødem, iritis), atrofi af den periorbitale fedtpude, pigmentering af periokulær hud, øjenvipper og iris samt hypertrichose.26
En ny variant i kategorien prostaglandinanaloger er latanoprostene bunod 0,024%. Denne forbindelse har en dobbelt mekanisme: den øger den uveosklerale udstrømning og forbedrer udstrømningen fra trabekelmaskeværket gennem påvirkning af nitrogenoxid.27 Øjet nedbryder latanoprosten bunod to gange for at give de aktive komponenter latanoprostsyre og nitrogenoxid.28 Sidstnævnte påvirker en signalvej, der afslapper kontraktile komponenter i TM, hvilket øger udstrømningen.28 Den yderligere virkning sænker IOP >1 mm Hg i forhold til latanoprost alene på tværs af flere tidspunkter, med en samlet IOP-reduktion, der varierer fra 7,5 mm Hg til 9,1 mm Hg. Bivirkninger med latanoprosten bunod var sammenlignelige med dem af latanoprost alene, med muligvis mindre periokulær pigmentering og hypertrichose, ifølge investigatorerne.28,29
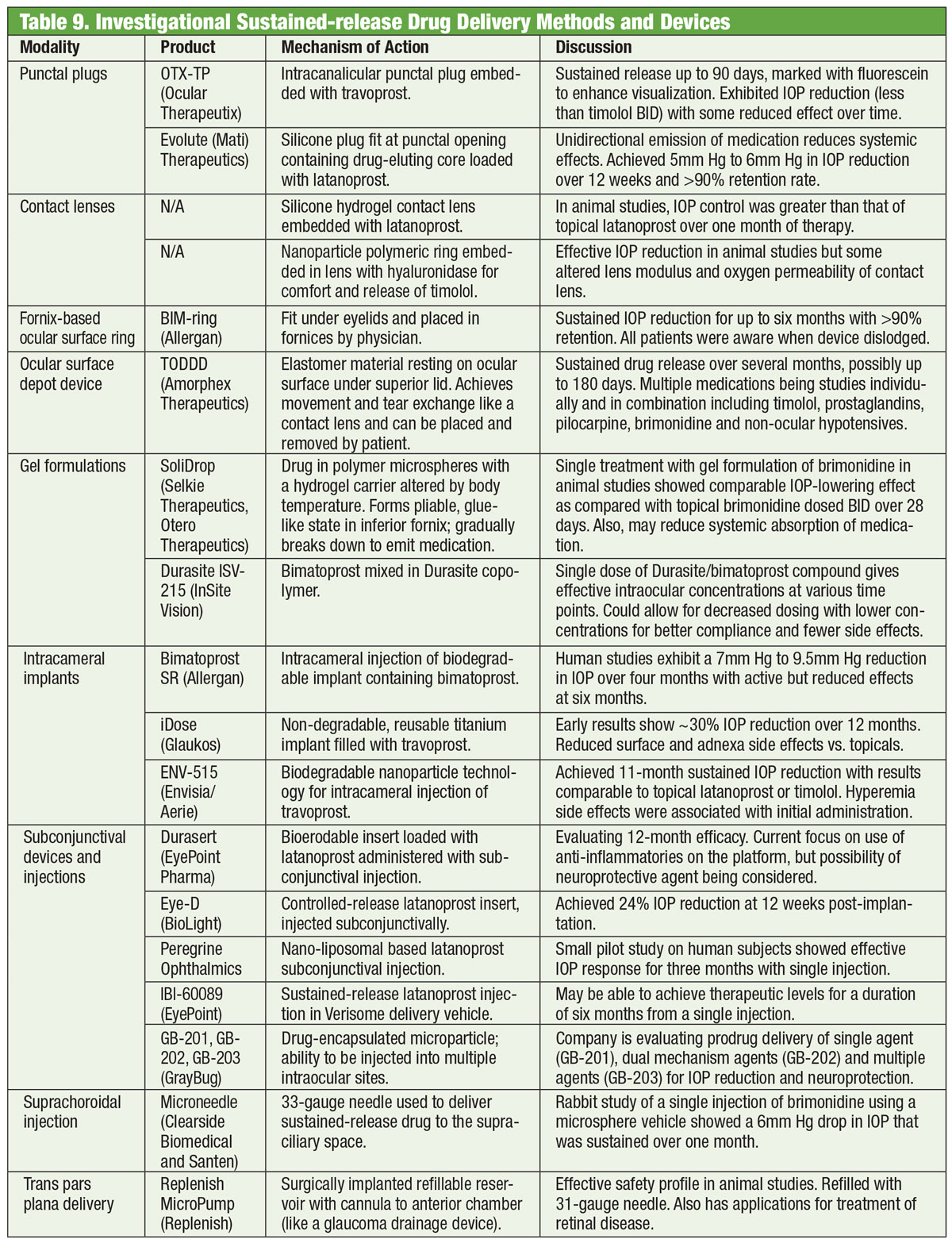
ROCK-hæmmere
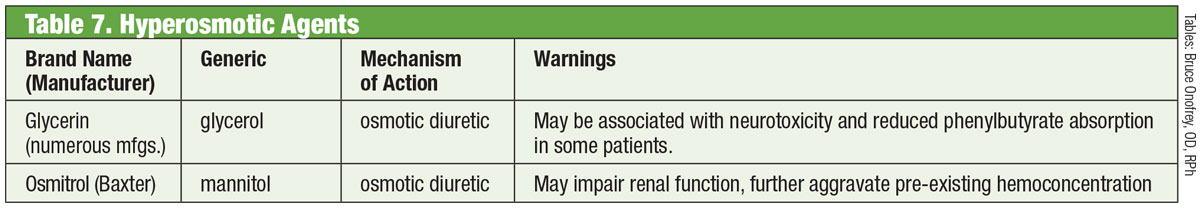
I et normalt øje er TM den vigtigste afløbsvej for kammervæske den vigtigste afløbsvej for kammervæske. Modstanden mod vandholdigt humør gennem denne struktur er øget hos patienter med glaukom, hvilket øger IOP.30 Indtil for nylig lykkedes det ikke at målrette glaukommedicin mod denne struktur. Det ændrede sig i 2017 med introduktionen af Rhopressa (netarsudil 0,02 %, Aerie), en rho-kinase (ROCK)-inhibitor.
Tabel: Klik på billedet for at forstørre.
Rho-kinase er bredt udtrykt i mange væv, herunder TM, hvor det fremmer samlingen af aktinstressfibre og regulerer cellekontraktion.31 ROCK-hæmmere øger vandudstrømningen ved at mindske actin- og myosin-drevet cellekontraktion og reducere produktionen af ekstracellulær matrixprotein.32 Rhopressa har også en hæmmende virkning mod noradrenalin-transporter (NET), hvilket gør det til en ROCK/NET-hæmmer. NET-mekanismen kan være et resultat af reduceret blodgennemstrømning til ciliærlegemet gennem noradrenalininduceret vasokonstriktion, hvilket resulterer i nedsat vandproduktion.33 Desuden nedsætter netarsudil også det episklerale venøse tryk (EVP), hvilket giver flere muligheder for IOP-reduktion.32 Den mest almindelige okulære bivirkning er okulær hyperæmi (ca. halvdelen af de behandlede patienter), som for det meste er mild, forbigående og selvopløsende.32
Det skal bemærkes, at rho selv spiller en vigtig rolle i axonvækst og -styring samt i reguleringen af neuronernes overlevelse og død.34 Forskere fandt, at efter skader på synsnerven reducerer aktuel anvendelse af netarsudil retinal gangliecelle-død og fremmer axonal regeneration.34
Geting in the Mix
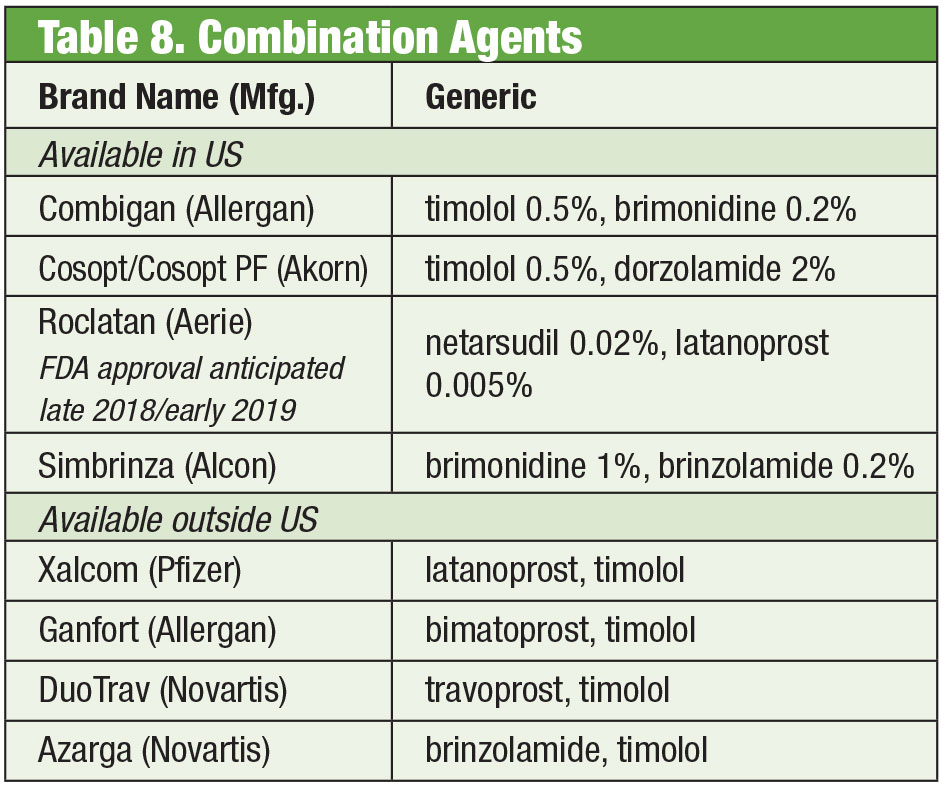
Sommetider har patienterne brug for mere end det, som hyldeprodukterne tilbyder. Patientens følsomhed eller øjenoverfladetoksicitet som følge af kronisk brug af konserveringsmidler kan føre til, at man søger efter alternativer. Nogle sammensatte lægemidler kan fås uden konserveringsmidler. Hvis overholdelse er et problem, kan disse blandinger indeholde op til fire lægemidler i en enkelt flaske. Desuden er mange faste kombinationer blevet anvendt effektivt uden for USA, men er i øjeblikket ikke godkendt af FDA; blandinger giver amerikanske læger adgang til disse behandlinger. Hvis omkostningerne er en begrænsning, kan blandinger være en ekstra fordel. Selv om det sammensatte produkt ofte ikke er dækket af patientens forsikring, kan prisen for et eller to kombinationsprodukter være mere omkostningseffektiv end prisen for flere enkeltmedicinske muligheder, selv generiske formuleringer. To blandingsapoteker tilbyder flere forudindstillede variationer: Simple Drops fra Imprimis Pharmaceuticals og Omni-produktserien fra Ocular Science. Yderligere tilpasning er også mulig fra hver af dem.
Og selv om de enkelte midler er godkendt af FDA, er bestemte kombinationer det måske ikke. Det er op til behandleren at afveje risici og fordele ved overholdelse.
Sammensatte glaukomprodukter:
Simple Drops (Imprimis Pharmaceuticals)
Alle fås uden konserveringsmidler.
– Tim-Lat PF (timolol/latanoprost)
– Brim-Dor PF (brimonidin/dorzolamid)
– Tim-Brim-Dor PF (timolol/brimonidin/dorzolamid)
– Tim-Dor-Lat PF (timolol/dorzolamid/latanoprost)
– Tim-Brim-Dor-Lat PF (timolol/brinzolamid/dorzolamid/latanoprost)
– Dor-Tim (dorzolamid/timolol)
– Dorzolamid PF
– Latanoprost PF
Omni Drops (Ocular Science)
Indeholder benzalkoniumchlorid, men i lavere koncentrationer (0.001%) end almindelige generiske formuleringer (0,002%).
– Timolol/latanoprost
– Timolol/brimonidin/dorzolamid (AM-formel)*
– Timolol/brimonidin/dorzolamid/latanoprost (PM-formel)*
* Beregnet til at blive brugt i fællesskab, hvor AM-versionen mangler prostaglandinet, som almindeligvis kun doseres én gang om dagen.
Fikserede kombinationsprodukter
Trods effektiviteten af disse individuelle produkter er det almindeligt, at mange glaukom-patienter har brug for flere behandlinger for at kontrollere deres tilstand.35 Når dobbeltbehandling er nødvendig, kan det være bedst at tilbyde den samme dispenser, hvilket fremmer øget compliance og reducerer påvirkningen af øjenoverfladen fra toksicitet.36 Timololol er kombineret med brimonidin (som Combigan, Allergan) og dorzolamid (som Cosopt, Akorn), begge doseret to gange dagligt, med en konserveringsmiddelfri løsning til rådighed for timololol-dorzolamid-produktet. En anden kombination to gange dagligt – Simbrinza – kombinerer brimonidin og dorzolamid. De faste kombinationer viser god effektivitet både som primær behandling og som supplement til PGA’er. Bivirkningerne er sammenlignelige med de enkelte komponenter.
Tilhørighed/Patientens opfattelse
Og selv om beslutningen om at anbefale behandling kan være kompleks og afhænger af mange faktorer, skal visse baggrundsfakta anerkendes, og grundlæggende principper skal anvendes, når lægen og patienten er enige om at indlede behandling, når først de er enige om at iværksætte behandlingen.
Klik på billedet for at forstørre.
Visusfeltets progression og sygdommens sværhedsgrad er forbundet med dårlig adhærens.37 Patienter med kroniske medicinske tilstande bruger i gennemsnit 30 % til 70 % af deres ordinerede medicindoser, og 50 % afbryder deres medicin inden for de første par måneder af behandlingen, ifølge en undersøgelse.38 Overholdelsen af glaukommedicin er tilsvarende dårlig som ved andre kroniske tilstande.38 Der kan derfor eksistere en forskel mellem effektivitet og effekt, hvor selv om det er bevist, at topiske lægemidler er effektive i store kliniske undersøgelser, kan de i praksis være ineffektive på grund af patienternes manglende overholdelse af reglerne.39
De vigtigste faktorer, der bidrager til dårlig overholdelse af reglerne i forbindelse med glaukom, er bl.a. medicinens bivirkningsprofil, behandlingsomkostningerne, patientuddannelse og forholdet mellem læge og patient.40 Desuden kan sygdommen være asymptomatisk indtil sent i forløbet med manglende bevidsthed om tab af synsfeltet.41
Og nu til noget helt andet
Medicin har været rygraden i behandlingen af glaukom i mere end et århundrede, og udviklingen af nye lægemidler fortsætter med uformindsket styrke. Men nogle forskere er på udkig efter alternativer uden for flasken. Briller, der er indlejret i en elektromagnetisk spole, kombineret med en kontaktlinse, der indeholder et spor af guld, kan måske en dag bidrage til at sænke IOP. Komboen er udviklet af et firma ved navn Bionode og er designet til at generere en elektrisk strøm, der strømmer gennem ciliarmusklerne for at stimulere den naturlige afløbsvej og sænke IOP.
American Academy of Ophthalmology. Briller kan en dag behandle glaukom. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Tilgået den 3. juli 2018.
En yderligere barriere for adhærens er vanskeligheder med instillation af dråber og doseringsskema.42 Faktisk forurener op til 80 % af patienterne deres dråber ved at røre ved ansigtet, op til 61 % instiller ikke præcis én dråbe, og det mest kritiske er, at op til 37 % misser øjet med dråben.43 Behandleren bør aldrig antage, at patienten er dygtig til instillation af dråber. Før du påbegynder dråbebehandling, skal du lære patienten, hvordan man korrekt instiller dråberne, og få patienten til at demonstrere instillation med succes, inden han/hun forlader kontoret. Dette kan effektivt uddelegeres til en optometrisk tekniker og styrkes med et uddannelsesmateriale om teknikken (PDF til udskrivning på www.glaucoma.org/treatment/eyedrop-tips.php) samt brug af videoer som f.eks. den, der er produceret af Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Hvis patienten har betydelige vanskeligheder med at instillere øjendråber, kan et mekanisk doseringshjælpemiddel forbedre sandsynligheden for succes. Overholdelsen af den korrekte doseringsskema forbedres ved brug af automatiserede telekommunikationsbaserede påmindelser, smartphone- og tabletbaserede påmindelsesapps.44,45 En kombination af uddannelse på kontoret, målsætning, forenklet dropskema og teknologi bør omfavnes for at forbedre overholdelsen.46 At tage fat på de kendte hindringer for overholdelse af medicinering er et nødvendigt første skridt mod succes.
Sænkning af trykket
IOP er den eneste kendte modificerbare glaukomrelaterede risikofaktor, og en sænkning af den har unægteligt vist sig at reducere risikoen for sygdomsprogression.47,48 En effektiv sænkning af IOP bliver således målet ved behandling af patienter med glaukom. Når sygdommen er nøjagtigt klassificeret, fastsættes der typisk et terapeutisk mål. De foretrukne praksismønstre i USA tyder på, at der anvendes et IOP-målområde, som klinikeren mener vil reducere patienternes livstidsrisiko for blindhed prospektivt og samtidig minimere den behandlingsrelaterede byrde.49-52
Men selv om flere metoder kan hjælpe med at bestemme et indledende IOP-mål (tærskel IOP, beregnet, one size fits all), er den enkleste og mest evidensbaserede metode at reducere IOP med en procentdel fra baseline peak døgn IOP, hvor der opstår skader på synsnerven. IOP er dynamisk og udviser kort- og langsigtede svingninger, hvilket gør den nuværende tonometri ikke perfekt reproducerbar. Derfor anbefales det, at klinikeren indhenter flere IOP-målinger på forskellige tidspunkter af dagen, før behandlingen indledes, for at forsøge at fastslå et dagligt IOP-top, som målområdet skal baseres på.53-55 Men hvis man ikke indhenter flere IOP-kurver over 24 timer, er det usandsynligt, at man nogensinde vil få fat i et ægte topniveau. Klinikeren skal i sidste ende måle en vellykket behandling ved at reducere progressionshastigheden ved strukturel og funktionel testning.48,56,57
De anbefalede målprocentsatser for IOP-reduktioner varierer fra 20 % til 50 % afhængigt af tilstanden (dvs, mistanke om glaukom, okulær hypertension, normalspændingsglaukom, højspændingsglaukom, glaukom med lukkede vinkler) grundlæggende sygdomsgrad og forventet levetid.58-61
Tabel: Bruce Onofrey, OD, RPh. Klik på billedet for at forstørre.
Gå i gang
PGA’er er godkendt til førstelinjebehandling i USA og er mere effektive til at sænke IOP, har en relativt begrænset bivirkningsprofil og doseres mindre hyppigt (en gang dagligt) end andre klasser af medicin.62,63
Når et specifikt middel er valgt, bør patienten ses igen om højst fire uger for at måle dråbens effektivitet, for at afværge eventuelle bivirkninger, der måtte opstå, sikre patientens overholdelse af behandlingen og styrke værdien af behandlingen.
I sidste ende vil en korrekt uddannelse og en opmærksom opfølgning med strukturel og funktionel testning bidrage til at minimere synstabet.
Dr. Dorkowski er klinisk koordinator for plejehjems-/hjælpehjemsprogrammet på SCO.
Dr. Williamson er supervisor for opholdet på Memphis VA Medical Center.
Dr. Rixon er overlæge på Memphis VA og er medlem af Optometric Glaucoma Society.
Dr. Onofrey er forfatter til The Ocular Therapeutics Handbook.
1. Zimmerman TJ, William P. BogerIII. De beta-adrenerge blokerende midler og behandlingen af glaukom. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. A history of glaucoma pharmacology. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Direkte virkninger af muscariniske midler på udstrømningsvejene i menneskers øjne. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. Virkningsmekanismen for adrenerge lægemidler i forbindelse med glaukom. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl epinephrin: et nyt pro-drug i behandlingen af glaukom. Ophthalmology. 1978;85(3):268-75.
7. Neufeld AH. Eksperimentelle undersøgelser af virkningsmekanismen for timolol. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. Timolols virkningsmekanisme ved sænkning af det intraokulære tryk: I det normale øje. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Beta adrenerge receptorer i pigmenterede ciliære processer. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Fordeling og egenskaber af beta-adrenerge receptorer i det menneskelige iris-ciliærlegeme. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. En dobbeltmasket sammenligning af betaxolol vs. timolol ved behandling af åbenvinklet glaukom. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Ophthalmiske betablokkere siden timolol. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Evaluering af timolol ved kronisk åbenvinklet glaukom: En gang om dagen vs. to gange om dagen. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Virkninger af timolol, epinephrin og acetazolamid på vandig strømning under søvn. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Circadian intraokulær trykvariation med betablokkere. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Virkninger af systemisk betablokkerbehandling på virkningen og sikkerheden af topisk brimonidin og timolol. Brimonidinundersøgelsesgruppe 1 og 2. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaukom og systemiske sygdomme. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Farmakologiske og okulære hypotensive egenskaber af topiske kulsyreanhydrasehæmmere. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Topisk lægemiddeltilførsel til øjet: dorzolamid. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamid oftalmisk suspension: en gennemgang af dens farmakologi og anvendelse til behandling af åbenvinklet glaukom og okulær hypertension. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Sammenligning af den additive intraokulære tryksænkende effekt af latanoprost og dorzolamid, når de tilføjes til timolol hos patienter med åbenvinklet glaukom eller okulær hypertension: en randomiseret, åben, multicenter-undersøgelse i Grækenland. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Forekomst af brimonidinallergi hos patienter, der tidligere har været allergiske over for apraclonidin. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Effektivitet og sikkerhed af brimonidin som supplerende behandling af patienter med forhøjet intraokulært tryk i et stort, åbent samfundsforsøg. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidin-purit 0,1 % versus brimonidin-purit 0,15 % to gange dagligt ved glaukom eller okulær hypertension: et 12-måneders randomiseret forsøg. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidininduceret anterior uveitis. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Opdatering af virkningsmekanismen for topiske prostaglandiner til reduktion af intraokulært tryk. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Effektivitet af latanoprostene bunod 0,024 % sammenlignet med timolol 0,5 % med hensyn til at sænke det intraokulære tryk over 24 timer. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprostene bunod oftalmisk opløsning 0,024 % til sænkning af IOP ved glaukom og okulær hypertension. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Sammenligning af latanoprostene bunod 0,024 % og timololmaleat 0,5 % ved åbenvinklet glaukom eller okulær hypertension: LUNAR-undersøgelsen. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. Det trabekulære netværk: En grundlæggende gennemgang af form og funktion. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Tilgået den 29. juni 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Discovery of the ROCK inhibitor netarsudil for the treatment of open-angle glaucoma. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. To kliniske fase 3-forsøg, der sammenligner sikkerheden og virkningen af netarsudil med timolol hos patienter med forhøjet intraokulært tryk: rho kinase elevated iop treatment trial 1 and 2 (ROCKET-1 og ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Discovery and preclinical development of netarsudil, a novel ocular hypotensive agent for the treatment of glaucoma. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. Topisk administration af en rock/net-hæmmer fremmer retinal gangliecelleoverlevelse og axonregeneration efter skade på synsnerven. Exp Eye Res. 2017;158;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Supplerende behandlingsmønstre hos glaukompatienter, der anvender prostaglandinanaloger. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Faste kombinationer. Glaucoma Today. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. Er der en sammenhæng mellem adhærensrater og glaukomatøs synsfeltprogression? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Brug af data fra apoteksoplysninger til at undersøge overholdelse af glaukommedicin: metodologi og resultater af Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Chon BH, Stamper R, et al. Effektivitet af intraokulær tryksænkende medicin bestemt ved udskylning. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Hvorfor bliver folk (stadig) blinde på grund af glaukom? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. Et syn på glaukom – ser vi det klart? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. De mest almindelige hindringer for overholdelse af glaukommedicinering: En tværsnitsundersøgelse. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Dråbeinstillation og glaukom. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automatiserede telekommunikationsbaserede påmindelser og overholdelse af dosering af glaukommedicin én gang dagligt: Den automatiserede undersøgelse af påmindelser om dosering. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: Patienters og deres pårørendes interesse for en smartphone- og tabletbaseret glaukomapplikation. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Attributter, der er forbundet med overholdelse af glaukommedicinbehandling og dens virkninger på glaukomresultater: En evidensbaseret gennemgang og potentielle strategier til at forbedre adhærens. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. Nye perspektiver på det intraokulære måltryk. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalisering af det intraokulære tryk: Mål intraokulært tryk i forbindelse med 24-timers intraokulær trykovervågning. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Måltryk i glaukombehandling. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Pleje af patienten med åbenvinklet glaukom. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Tidlig aggressiv intraokulær tryksænkning, intraokulært måltryk og et nyt koncept for glaukombehandling. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Daglige intraokulære trykmønstre er ikke gentagelige på kort sigt hos raske personer. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Long-term reproducibility of diurnal intraocular pressure patterns in patients with glaucoma. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Dag-til-dag variabilitet i intraokulært tryk ved glaukom og okulær hypertension. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraokulært tryk og glaukomatologisk progression ved primær åbenvinklet glaukom. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or preventing the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Reduktion af det intraokulære tryk og glaukomfremskridt: Results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. Den avancerede glaukominterventionsundersøgelse (AGIS): Forholdet mellem kontrol af intraokulært tryk og forringelse af synsfeltet. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Progression af synsfeltet i den kollaborative undersøgelse af den indledende glaukombehandling. Virkningen af behandling og andre baseline-faktorer. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost i behandlingen af glaukom. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impact of the introduction of generic latanoprost on glaucoma medication adherence. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. En randomiseret, kontrolleret sammenligning af latanoprostene bunod og latanoprost 0,005 % til behandling af okulær hypertension og åbenvinklet glaukom: VOYAGER-undersøgelsen. Br J Ophthalmol. 2015;99(6):738-45.