Enzymernes strukturelle ustabilitet
Den kendsgerning, at aktive steder er så velegnede til at levere specifikke miljøforhold, betyder også, at de er underlagt påvirkninger fra det lokale miljø. Det er rigtigt, at en forøgelse af omgivelsestemperaturen generelt øger reaktionshastighederne, enzymkatalyserede eller andre. Men hvis temperaturen øges eller sænkes uden for et optimalt område, kan det påvirke de kemiske bindinger i det aktive sted på en sådan måde, at de er mindre velegnede til at binde substrater. Høje temperaturer vil i sidste ende få enzymer, ligesom andre biologiske molekyler, til at denaturere, en proces, der ændrer et stofs naturlige egenskaber. Ligeledes kan pH-værdien i det lokale miljø også påvirke enzymfunktionen. Aminosyrerester på det aktive sted har deres egne sure eller basiske egenskaber, som er optimale for katalysen. Disse rester er følsomme over for ændringer i pH, der kan forringe den måde, hvorpå substratmolekyler bindes. Enzymer er egnede til at fungere bedst inden for et bestemt pH-område, og ligesom med temperatur kan ekstreme pH-værdier (sure eller basiske) i miljøet medføre, at enzymer denatureres.
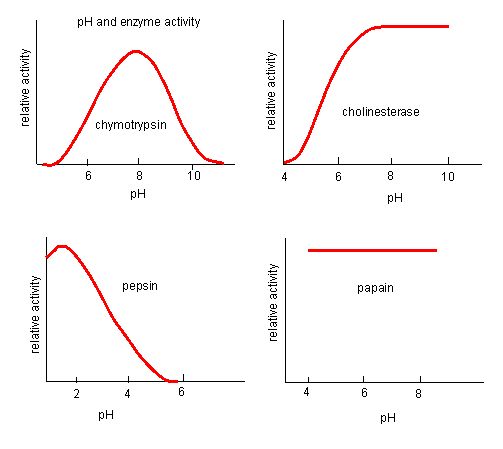
Figur 4. Enzymer har en optimal pH-værdi. Den pH-værdi, ved hvilken enzymet er mest aktivt, vil være den pH-værdi, hvor R-grupperne på det aktive sted er protoneret/deprotoneret, således at substratet kan trænge ind i det aktive sted, og det første trin i reaktionen kan begynde. Nogle enzymer kræver en meget lav pH-værdi (sur) for at være helt aktive. I menneskekroppen er disse enzymer sandsynligvis placeret i den nederste del af mavesækken eller placeret i lysosomer (en celleorganel, der bruges til at fordøje store forbindelser inde i cellen).
Kilde: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Processen, hvor enzymer denatureres, starter normalt med afviklingen af den tertiære struktur gennem destabilisering af de bindinger, der holder den tertiære struktur sammen. Hydrogenbindinger, ionbindinger og kovalente bindinger (disulfidbroer og peptidbindinger) kan alle blive forstyrret af store ændringer i temperatur og pH-værdi. Lav en energihistorie for det røde enzym ved hjælp af skemaet over enzymaktivitet og temperatur nedenfor. Forklar, hvad der kan ske fra 37 °C til 95 °C.
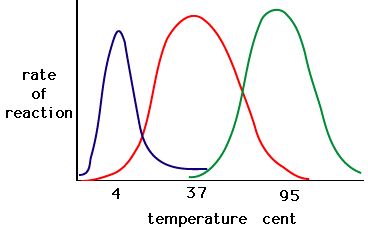
Figur 5. Enzymer har en optimal temperatur. Den temperatur, ved hvilken enzymet er mest aktivt, vil normalt være den temperatur, hvor enzymets struktur er stabil eller ukompromitteret. Nogle enzymer kræver en bestemt temperatur for at forblive aktive og ikke denaturere. Kilde: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Induceret pasform og enzymfunktion
I mange år troede forskerne, at bindingen mellem enzym og substrat foregik på en simpel “lås og slå”-måde. Denne model hævdede, at enzymet og substratet passede perfekt sammen i ét øjeblikkeligt trin. Den nuværende forskning støtter imidlertid et mere raffineret synspunkt, der kaldes induceret tilpasning. Den inducerede tilpasningsmodel udvider lock-and-key-modellen ved at beskrive en mere dynamisk interaktion mellem enzym og substrat. Når enzym og substrat mødes, forårsager deres interaktion et let skift i enzymets struktur, som bekræfter et mere produktivt bindingsarrangement mellem enzymet og substratets overgangstilstand. Denne energetisk gunstige binding maksimerer enzymets evne til at katalysere sin reaktion.
Når et enzym binder sit substrat, dannes der et enzym-substratkompleks. Dette kompleks sænker aktiveringsenergien for reaktionen og fremmer dens hurtige forløb på en af mange måder. På et grundlæggende niveau fremmer enzymer kemiske reaktioner, der involverer mere end ét substrat, ved at bringe substraterne sammen i en optimal orientering. Det relevante område (atomer og bindinger) i det ene molekyle er placeret ved siden af det relevante område i det andet molekyle, som det skal reagere med. En anden måde, hvorpå enzymer fremmer reaktionen af deres substrater, er ved at skabe et energimæssigt gunstigt miljø i det aktive sted, så reaktionen kan finde sted. Visse kemiske reaktioner kan forløbe bedst i et let surt eller upolært miljø. De kemiske egenskaber, der fremkommer ved den særlige placering af aminosyreresterne i et aktivt sted, skaber det energetisk gunstige miljø for, at et enzyms specifikke substrater kan reagere.
Den aktiveringsenergi, der kræves for mange reaktioner, omfatter den energi, der er involveret i en let forvridning af kemiske bindinger, så de lettere kan reagere. Enzymatisk virkning kan hjælpe denne proces. Enzym-substrat-komplekset kan sænke aktiveringsenergien ved at forvrænge substratmolekylerne på en sådan måde, at det letter bindingsbruddet. Endelig kan enzymer også sænke aktiveringsenergien ved at tage del i selve den kemiske reaktion. Aminosyreresterne kan levere visse ioner eller kemiske grupper, som faktisk danner kovalente bindinger med substratmolekyler som et nødvendigt trin i reaktionsprocessen. I disse tilfælde er det vigtigt at huske, at enzymet altid vil vende tilbage til sin oprindelige tilstand, når reaktionen er afsluttet. En af de karakteristiske egenskaber ved enzymer er, at de i sidste ende forbliver uændrede efter de reaktioner, som de katalyserer. Når et enzym er færdig med at katalysere en reaktion, frigiver det sit eller sine produkter.
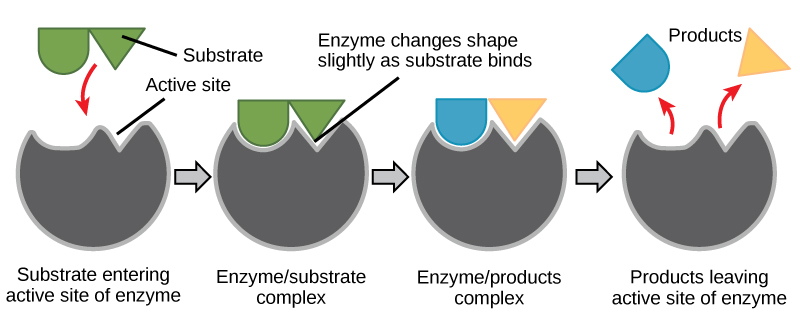
Figur 6. I henhold til induced-fit-modellen gennemgår både enzym og substrat dynamiske konformationsændringer ved binding. Enzymet forvrænger substratet til dets overgangstilstand og øger derved reaktionshastigheden.
Skab en energihistorie for reaktionen ovenfor
Besvar ved hjælp af figur 6 de spørgsmål, der stilles i energihistorien.
1. Hvad er reaktanterne? Hvad er produkterne?
2. Hvilket arbejde blev udført af enzymet?
3. Hvilken tilstand er energien oprindeligt i? Hvilken tilstand er energien omdannet til i den endelige tilstand? Denne kan stadig være vanskelig, men prøv at finde ud af, hvor energien befinder sig i den indledende tilstand og i den endelige tilstand.