Når du har fastslået, at kernen eksisterer, kan du nu se på de eksperimentelle beviser for dens størrelse, med udgangspunkt i Rutherford-eksperimentet.
Resumé af lektionen
- Diskussion og arbejdseksempel: Atomkernens størrelse (15 minutter)
- Diskussion: Atom- og kernestørrelse (10 minutter)
- Spørgsmål fra eleverne: Kræfter og nærmeste nærhed (30 minutter)
- Drøftelse: Atomnummer og ladning på en kerne (5 minutter)
- Diskussion: Øvre grænse for kernes størrelse (30 minutter)
- Drøftelse: Diskussion: En gåde til en kommende lektion (5 minutter)
Diskussion og arbejdseksempel: Atomkernens størrelse
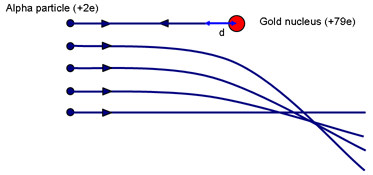
Du kan få en idé om atomkernens mulige størrelse ved at tænke på Rutherfords eksperiment. Spørg: Hvilken påvirkningsparameter vil resultere i, at en partikel kommer tættest på kernen? (Et frontalt sammenstød med p = 0.)
Energiens bevarelsesprincip bruges til at beregne afstanden til nærmeste nærhed som et mål for størrelsen af en kerne. Forståelsen af den efterfølgende beregning afhænger af, om eleverne har gennemgået elektrisk potentiale og felter. Alternativt tjener det som en god repetition.
Episode 522-1: Alfapartikelspredning – afstanden til nærmeste nærhed (Word, 29 KB)
Episode 522-2: Afstanden til nærmeste nærhed (Word, 107 KB)
Når α’et bringes momentant til hvile (efter at være kravlet så langt op som muligt på den elektrostatiske bakke), vil der være udført arbejde mod den frastødende kraft fra kernen. α’ets kinetiske energi er lagret i feltet omkring kernen. Når hastigheden er nul, er al energien nu lagret i feltet.
Hvis α’et momentant standser, når det befinder sig i en afstand d fra (centrum af) kernen med ladningen Ze, er energien i feltet:
Eα = 14πε0 2e Zed
Dette er lig med α-partiklens oprindelige kinetiske energi. Rutherford brugte en α-kilde, som han havde fået af Madame Curie. α-energien var ~ 7,7 MeV.
For guld er Z = 79. Løsning giver d ~ 3 × 10-14 m. Sammenlign dette med guldatomernes diameter ~ 3 × 10-10 m. En kerne er altså mindst 10 000 gange mindre end et atom. Det er vigtigt at understrege, at denne beregning giver en øvre grænse for størrelsen af guldkernen; vi kan ikke sige, at alfapartiklen berører kernen; en mere energisk α kan komme endnu tættere på.
Et atom er for det meste tomt (hvilket er grunden til, at de fleste as gik lige igennem – eventuelle elektroner ville næppe hindre den relativt massive α med høj hastighed).
Diskussion: Atom- og kernestørrelse
Bede dine elever om at foreslå en skala-model af atomet i kerneform. For eksempel: Hvis en kerne havde en diameter på 1 mm, ville et atom være 10 000 gange større eller 10 m i diameter. Vælg en passende placering for en kerne på 1 mm (et lille kugleleje eller en kugle af Blu-tac). Gå 5 m (fem store skridt) ud til kanten af atomet, hvor elektronerne befinder sig. NB: lærebogsdiagrammer af et atom med en kerne er ikke tegnet i målestok.
Styrk et nøjagtigt billede ved at få en elev til at stille sig op som en kerne, anslå sin omkreds (40 cm?) og spørge, hvor en anden elev skulle stå for at være ved atomets kant. 104 × 40 cm = 4000 m}, så radius af dette atom er 2 km! Tjek med et lokalt kort for at finde et navngivet sted, som eleverne vil kunne genkende, og som ligger 2 km væk.
Fortsat forstærkning: I et fast stof, hvor atomerne er tæt pakket, er afstanden mellem tilstødende atomkerner ~ størrelsen af et atom, dvs. svarende til, at to elever står 4 km fra hinanden!
Så det er ret utroligt, at nogen overhovedet rammer en kerne. Begge er af samme størrelse. Tværsnitsareal præsenteret af en kerne ~radius2, altså ~1 × 10-28 m2}.
Spørg: Hvordan vil du forvente, at antallet af reflekterede som afhænger af tykkelsen af metalfolien, der indeholder målkernerne? (Forestil dig guldatomerne i lag, chancen for en afbøjning stiger med tykkelsen, men absorption på vej ind eller tilbage ud af den stadig tykkere folie vil til sidst forhindre en yderligere stigning i antallet af reflekterede og detekterede.
Det er en stor hjælp, hvis dine elever kan huske følgende størrelsesordener:
Radius af atomkerne ~ 10 -14m
Radius af atom ~ 10 -10m
Eelevspørgsmål: Kræfter og nærmeste nærhed
Episode 522-3: Rutherford-spredning: Kræfternes retning (Word, 82 KB)
Episode 522-4: Rutherford-spredning: Energy and closest approach (Word, 83 KB)
Diskussion: Atomnummer og ladningen på en kerne
Rutherford brugte sine data til at finde ladningen på en målkernes guldkerne. Yderligere eksperimenter for at finde ladningen af Cu-, Ag- og Pt-folier gav:
| Atomnummer | Et spredningsforsøg | ||
| Cu | 29 | 29.3 × e | |
| Ag | 47 | 46.3 × e | |
| PT | 78 | 77,4 × e |
Så den elektriske ladning på en kerne er givet ved atomnummeret × e, dvs. Z e. Med en enkelt undtagelse (brint, H-1) er Z altid mindre end det atomare massetal. Hvad forklarer så forskellen? Atomet må være elektrisk neutralt. Rutherford foreslog neutronen.
Diskussion: Øvre grænse for kernes størrelse
Husk, at Rutherfords analyse giver en øvre grænse for størrelsen på kernen (d ~ 1 α partikelenergi). Den størrelse, man måler, afhænger af energien af den α-partikel, man bruger. Vi har altså brug for en anden metode til at finde størrelsen på en guldkerne. Kan du komme i tanke om en bedre partikel til at undersøge størrelsen af en kerne? (Neutronen – da den er uladt, vil den komme tættere på.)
En anden teknik er den dybe inelastiske spredning af elektroner. Henvis tilbage, hvis du allerede har behandlet partiklers bølgenatur (de Broglie-bølger λ = hp), eller dette emne kan indsættes her, hvis det ønskes. Elektron diffraktionsapparatet har en grundlæggende lighed med en partikelspredning. Elektronerne skydes mod en tynd film – i dette tilfælde af grafit.
Rutherford var heldig, at de Broglie-bølgelængden for α-partiklerne (som han ikke kendte) var ret lille, og at coulomb-afstødningen stopper, når man kommer for tæt på – ellers ville diffraktionseffekter have forvirret dataene! (Prøv beregningen, hvis du allerede har gennemgået λ = hp.)
Episode 506-2: Fortolkning af elektrondiffraktionsmønstre (Word, 30 KB)
Episode 522-5: Deep inelastic scattering (Word, 56 KB)
Episode 522-6: Elektroner måler kernes størrelse (Word, 42 KB)
Diskussion: En gåde til en fremtidig lektion
Der er et grundlæggende problem med Rutherfords model. Spørg din klasse: Hvordan kan et atom med en central kerne være stabilt – hvorfor kollapser det ikke? Ifølge den klassiske elektrodynamik burde elektronerne udsende stråling, mens de kredser om Jorden og spiralformet indad.
(Det er godt at forlade en klasse med en gåde til en fremtidig lektion.)