Læringsmål
- At beskrive egenskaberne ved en gas.
De tre almindelige faser (eller tilstande) af stof er gasser, væsker og faste stoffer. Gasser har den laveste massefylde af de tre, er meget komprimerbare og fylder fuldstændigt enhver beholder, hvori de anbringes. Gasser opfører sig på denne måde, fordi deres intermolekylære kræfter er relativt svage, så deres molekyler bevæger sig konstant uafhængigt af de andre tilstedeværende molekyler. Faste stoffer er derimod relativt tætte, stive og ikke-komprimerbare, fordi deres intermolekylære kræfter er så stærke, at molekylerne stort set er låst fast på plads. Væsker er relativt tætte og inkompressible ligesom faste stoffer, men de flyder let for at tilpasse sig formen af deres beholdere ligesom gasser. Vi kan derfor konkludere, at summen af de intermolekylære kræfter i væsker ligger mellem dem i gasser og i faste stoffer. Figur 10.1.1 sammenligner de tre stoftilstande og illustrerer forskellene på molekylært niveau.
Figur 10.1.1.1 Et diatomært stof (O2) i fast, flydende og gasformig tilstand
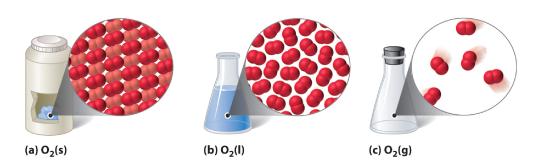
(a) Fast O2 har et fast volumen og en fast form, og molekylerne er pakket tæt sammen. (b) Flydende O2 tilpasser sig formen af sin beholder, men har et fast volumen; det indeholder relativt tætpakkede molekyler. (c) Gasformigt O2 fylder sin beholder fuldstændigt – uanset beholderens størrelse og form – og består af vidt adskilte molekyler.
Et givet stofs tilstand afhænger i høj grad af betingelserne. H2O findes f.eks. almindeligvis i alle tre tilstande: fast is, flydende vand og vanddamp (dets gasform). Under de fleste forhold møder vi vand som den væske, der er afgørende for livet; vi drikker det, laver mad med det og bader i det. Når temperaturen er kold nok til at omdanne væsken til is, kan vi stå på ski eller skøjter på det, pakke det ind i en snebold eller en snekegle og endda bygge boliger med det. VanddampSkelnen mellem en gas og en damp er subtil: Udtrykket damp henviser til den gasform af et stof, der er flydende eller fast under normale forhold (25 °C, 1,0 atm). Kvælstof (N2) og ilt (O2) betegnes således som gasser, men gasformigt vand i atmosfæren kaldes vanddamp. er en bestanddel af den luft, vi indånder, og den dannes, når vi opvarmer vand til madlavning eller til at lave kaffe eller te. Vanddamp ved temperaturer over 100 °C kaldes damp. Damp bruges til at drive store maskiner, herunder turbiner, der producerer elektricitet. Egenskaberne ved de tre tilstande af vand er opsummeret i tabel 10.1.1
Den geometriske struktur og de fysiske og kemiske egenskaber ved atomer, ioner og molekyler afhænger normalt ikke af deres fysiske tilstand; de enkelte vandmolekyler i is, flydende vand og damp er f.eks. alle identiske. Derimod afhænger et stofs makroskopiske egenskaber i høj grad af dets fysiske tilstand, som bestemmes af intermolekylære kræfter og forhold som temperatur og tryk.
Figur 10.1.2 viser placeringen i det periodiske system af de grundstoffer, der almindeligvis findes i gasformig, flydende og fast tilstand. Bortset fra brint er de grundstoffer, der forekommer naturligt som gasser, placeret i den højre side af det periodiske system. Af disse er alle ædelgasserne (gruppe 18) monatomare gasser, mens de andre gasformige grundstoffer er diatomare molekyler (H2, N2, O2, F2 og Cl2). Oxygen kan også danne en anden allotrope, det meget reaktive triatomare molekyle ozon (O3), som også er en gas. I modsætning hertil er brom (som Br2) og kviksølv (Hg) væsker under normale forhold (25 °C og 1,0 atm, almindeligvis benævnt “rumtemperatur og -tryk”). Gallium (Ga), som kun smelter ved 29,76 °C, kan omdannes til en væske ved blot at holde en beholder med det i hånden eller opbevare den i et rum uden aircondition på en varm sommerdag. Resten af grundstofferne er alle faste stoffer under normale forhold.
Figur 10.1.2 Grundstoffer, der forekommer naturligt som gasser, væsker og faste stoffer ved 25°C og 1 atm
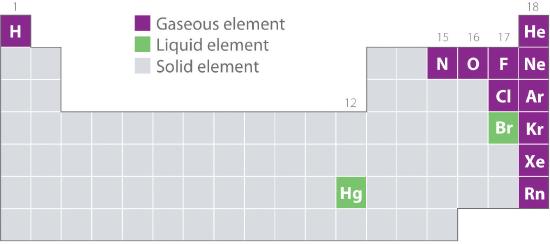
Ædelgasserne og kviksølv forekommer som monatomare arter, mens alle andre gasser og brom er diatomare molekyler.
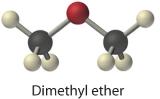
Mange af de grundstoffer og forbindelser, som vi hidtil er stødt på, findes typisk som gasser; nogle af de mere almindelige er anført i tabel 10.1.2 . Gasformige stoffer omfatter mange binære hydrider, såsom hydrogenhalogeniderne (HX); hydrider af chalcogenerne; hydrider af gruppe 15-elementerne N, P og As; hydrider af gruppe 14-elementerne C, Si og Ge; og diboran (B2H6). Desuden er mange af de simple kovalente oxider af ikke-metallerne gasser, f.eks. CO, CO2, NO, NO2, NO2, SO2, SO3 og ClO2. Mange organiske forbindelser med lav molekylmasse er også gasser, herunder alle kulbrinter med fire eller færre kulstofatomer og simple molekyler som f.eks. dimethylether , methylchlorid (CH3Cl), formaldehyd (CH2O) og acetaldehyd (CH3CHO). Endelig er kølemidler som f.eks. chlorfluorcarboner (CFC) og hydrochlorfluorcarboner (HCFC) gasser, der let kan gøres flydende ved komprimering, og væsker kan til gengæld omdannes til gasser ved at sænke trykket på væskerne. Faseændringen fra væske til gas i rørene inde i køleskabet afkøler, mens kompressionen i spoler i bunden eller på bagsiden af køleskabet opvarmer rummet. Ammoniak og SO2 er andre komprimerbare gasser, der har været anvendt som kølemidler, men som ikke kan anvendes i boliger på grund af deres giftige natur. Ammoniak anvendes stadig som kølemiddel i store erhvervsområder på grund af dets effektivitet og lave pris.
Alle de tidligere nævnte gasformige stoffer (bortset fra de monatomiske ædelgasser) indeholder kovalente eller polære kovalente bindinger og er upolære eller polære molekyler. I modsætning hertil forhindrer de stærke elektrostatiske tiltrækninger i ionforbindelser, såsom NaBr (kogepunkt = 1390°C) eller LiF (kogepunkt = 1673°C), at de kan eksistere som gasser ved stuetemperatur og tryk. Desuden er de letteste medlemmer af en given familie af forbindelser sandsynligvis gasser, og kogepunkterne for polære forbindelser er generelt højere end kogepunkterne for upolære forbindelser med samme molekylmasse. Derfor er det i en given serie af forbindelser mest sandsynligt, at de letteste og mindst polære stoffer i en given serie af forbindelser vil være gasser. Med relativt få undtagelser er forbindelser med mere end ca. fem atomer fra periode 2 eller lavere imidlertid for tunge til at kunne eksistere som gasser under normale forhold.
Note the Pattern
Gasformige stoffer indeholder ofte kovalente eller polære kovalente bindinger, eksisterer som upolære eller svagt polære molekyler, har relativt lave molekylmasser og indeholder fem eller færre atomer fra periode 1 eller 2.
Selv om gasser har en lang række anvendelsesmuligheder, men en særlig grum anvendelse af et gasformigt stof menes at være blevet anvendt af perserne mod den romerske by Dura i det østlige Syrien i det tredje århundrede e.Kr. Perserne gravede en tunnel under bymuren for at komme ind og erobre byen. Arkæologiske beviser tyder på, at da romerne svarede med modtunneler for at stoppe belejringen, antændte perserne bitumen- og svovlkrystaller for at producere en tæt, giftig gas. Det er sandsynligt, at bælge eller skorstene fordelte de giftige dampe. Resterne af ca. 20 romerske soldater blev fundet ved foden af bymuren ved indgangen til en tunnel, der var mindre end 2 m høj og 11 m lang. Da det er højst usandsynligt, at perserne kunne have slagtet så mange romere ved indgangen til et så begrænset rum, spekulerer arkæologerne i, at de gamle persere brugte kemisk krigsførelse for at få succes med at erobre byen.
Eksempel 10.1.1
Hvilke forbindelser ville du forudsige, at de er gasser ved stuetemperatur og -tryk?
- cyclohexen
- lithiumcarbonat
- cyclobutan
- vanadium(III)oxid
- benzoesyre (C6H5CO2H)
Givet: forbindelser
Spørgsmålet: fysisk tilstand
Strategi:
A Afgør, om hver forbindelse er ionisk eller kovalent. En ionisk forbindelse er højst sandsynligt et fast stof ved stuetemperatur og tryk, mens en kovalent forbindelse kan være et fast stof, en væske eller en gas.
B Blandt de kovalente forbindelser er de forbindelser, der er relativt upolære og har lave molekylmasser, højst sandsynligt gasser ved stuetemperatur og tryk.
Løsning:
A Lithiumcarbonat er Li2CO3, der indeholder Li+- og CO32-ioner, og vanadium(III)oxid er V2O3, der indeholder V3+- og O2-ioner. Begge er primært ionforbindelser, som forventes at være faste stoffer. De resterende tre forbindelser er alle kovalente.
B Benzoesyre har mere end fire kulstofatomer og er polær, så det er ikke sandsynligt, at det vil være en gas. Både cyclohexen og cyclobutan er i det væsentlige upolære molekyler, men cyclobutan (C4H8) har en betydeligt lavere molekylmasse end cyclohexen (C6H10), som igen har mere end fire kulstofatomer. Vi forudsiger derfor, at cyclobutan højst sandsynligt er en gas ved stuetemperatur og tryk, mens cyclohexen er en væske. Med et kogepunkt på kun 12 °C sammenlignet med 83 °C for cyclohexen er cyclobutan faktisk en gas ved stuetemperatur og tryk.
Øvelse
Hvilke forbindelser ville du forudsige, at de er gasser ved stuetemperatur og tryk?
- n-butanol
- ammoniumfluorid (NH4F)
- ClF
-
ethylenoxid
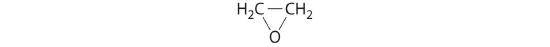
- HClO4
Svar: c; d
Summarum
Materie i bulk kan eksistere i tre tilstande: gas, væske og fast stof. Gasser har den laveste massefylde af de tre, er meget komprimerbare og fylder deres beholdere fuldstændigt. Grundstoffer, der eksisterer som gasser ved stuetemperatur og tryk, er samlet i højre side af det periodiske system; de forekommer enten som monatomiske gasser (ædelgasserne) eller diatomiske molekyler (nogle halogener, N2, O2). Mange uorganiske og organiske forbindelser med fire eller færre ikke-vandstofatomer er også gasser ved stuetemperatur og tryk. Alle gasformige stoffer er kendetegnet ved svage vekselvirkninger mellem de enkelte molekyler eller atomer, der indgår i dem.
Nøgleopfattelse
- Molekylerne i gasformige stoffer indeholder ofte kovalente eller polære kovalente bindinger, er upolære eller svagt polære molekyler og har relativt lave molekylmasser.
Begrebsproblemer
-
Forklar forskellene mellem stoffets mikroskopiske og makroskopiske egenskaber. Er kogepunktet for en forbindelse en mikroskopisk eller makroskopisk egenskab? molekylmasse? Hvorfor?
-
Bedøm, om smeltepunktet, dipolmomentet og den elektriske ledningsevne er makroskopiske eller mikroskopiske egenskaber ved stof, og forklar din begrundelse.
-
Hvordan påvirker de mikroskopiske egenskaber ved stof de makroskopiske egenskaber? Kan du sætte molekylmasse i forbindelse med kogepunktet? Hvorfor eller hvorfor ikke? Kan polaritet relateres til kogepunktet?
-
For et stof, der har gas-, væske- og fast fase, skal du ordne disse faser i rækkefølge efter stigende
- densitet.
- styrke af de intermolekylære vekselvirkninger.
- kompressibilitet.
- molekylær bevægelse.
- orden i molekylernes eller atomernes placering.
-
Forklar, hvad der er galt med dette udsagn: “Stoftilstanden bestemmer i høj grad et stofs molekylære egenskaber.”
-
Beskriv de vigtigste faktorer, der bestemmer tilstanden af en given forbindelse. Hvilke ydre forhold har indflydelse på, om et stof findes i en af de tre stoftilstande?
-
Hvilke grundstoffer i det periodiske system findes som gasser ved stuetemperatur og tryk? Hvilke af disse er diatomare molekyler, og hvilke er monatomare? Hvilke grundstoffer er væsker ved stuetemperatur og tryk? Hvilken del af det periodiske system indeholder grundstoffer, hvis binære hydrider højst sandsynligt er gasser ved stuetemperatur?
-
Er følgende observation korrekt? “Næsten alle binære hydrider, der ikke er metaller, er gasser ved stuetemperatur, men metalhydriderne er alle faste stoffer.” Forklar din begrundelse.
-
Er følgende iagttagelse korrekt? “Alle chalcogenhydriderne er gasser ved stuetemperatur og tryk undtagen det binære hydrid af oxygen, som er en væske.” Gør rede for din begrundelse. Ville du forvente, at 1-chlorpropan ville være en gas? jodpropan? Hvorfor?
-
Forklar, hvorfor ionforbindelser ikke er gasser under normale forhold.
Svar
-
-
-
-
-
-
De molekylære egenskaber ved et stof styrer dets stoftilstand under et givet sæt af betingelser, og ikke omvendt. Tilstedeværelsen af stærke intermolekylære kræfter begunstiger en kondenseret stoftilstand (flydende eller fast stof), mens meget svage intermolekylære vekselvirkninger begunstiger gasformig tilstand. Desuden dikterer molekylernes form, om en kondenseret fase er en væske eller et fast stof.
-
-
Elementer, der eksisterer som gasser, findes hovedsageligt i det øverste højre hjørne og på højre side af det periodiske system. Følgende grundstoffer findes som gasser: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe og Rn findes som gasser. Halvdelen af halogenerne, alle ædelgasserne og de letteste chalcogener og picnogener er således gasser. Af disse findes alle undtagen ædelgasserne som toatomige molekyler. Kun to grundstoffer eksisterer som væsker ved en normal rumtemperatur på 20-25 °C: kviksølv og brom. Den øverste højre del af det periodiske system omfatter også de fleste af de grundstoffer, hvis binære hydrider er gasser. Desuden er de binære hydrider af grundstofferne i gruppe 14-16 gasser.
-
-
-
-