Kræft er et resultat af et sammenbrud i de kontroller, der regulerer cellerne. Årsagerne til sammenbruddet omfatter altid ændringer i vigtige gener. Disse ændringer er ofte et resultat af mutationer, dvs. ændringer i kromosomernes DNA-sekvens. Mutationer kan være meget små ændringer, der kun påvirker nogle få nukleotider, eller de kan være meget store og føre til store ændringer i kromosomernes struktur.
Både små og store mutationer kan påvirke cellernes adfærd. Kombinationer af mutationer i vigtige gener kan føre til udvikling af kræft. Materialet på denne side beskriver forholdet mellem mutationer og kræft, de forskellige former for mutationer, og hvad der forårsager dem. Yderligere oplysninger om emnerne på denne side kan også findes i de fleste introducerende lærebøger i biologi, vi anbefaler Campbell Biology, 11th edition.1
Temaer på denne side:
- Mutationer og kræft
- Arvelige mutationer og kræft
- Mutationstyper
- Punktmutationer
- Translokationer
- Translokationer
- Genforstærkning
- Inversioner, Deletioner og duplikationer
- Aneuploidi
- Epigenetiske ændringer
- Mutationsårsager
- Mutationsoversigt
- Kend strømmen: Mutation
Mutation og kræft
Den unormale adfærd, som kræftceller udviser, er resultatet af en række mutationer i vigtige regulerende gener. Cellerne bliver gradvist mere unormale, efterhånden som flere gener bliver beskadiget. Ofte bliver de gener, der styrer DNA-reparationen, selv beskadiget, hvilket gør cellerne endnu mere modtagelige for stadig større genetisk kaos.
Nedenfor ses en animation, der viser forholdet mellem kromosomer, gener og DNA.
De fleste kræftformer menes at opstå fra en enkelt mutant forstadiecelle. Når denne celle deler sig, kan de resulterende “datterceller” få forskellige mutationer og forskellig adfærd i løbet af et stykke tid. De celler, der opnår en fordel med hensyn til deling eller modstandsdygtighed over for celledød, vil have en tendens til at overtage populationen. På denne måde er tumorcellerne i stand til at opnå en lang række egenskaber, som normalt ikke ses i den raske udgave af den repræsenterede celletype. De adfærdsændringer, der ses i kræftceller, er fokus for afsnittet om kræftbiologi på webstedet.
Mutationer i vigtige regulerende gener (tumorsuppressorer og proto-onkogener) ændrer cellernes adfærd og kan potentielt føre til den uregulerede vækst, der ses i kræft.
For næsten alle de kræfttyper, der er undersøgt til dato, ser det ud til, at overgangen fra en normal, sund celle til en kræftcelle er en trinvis udvikling, der kræver mange genetiske ændringer, der tilsammen skaber kræftcellen. Disse mutationer forekommer på både onkogener og tumorsuppressorer. Dette er en af grundene til, at kræft er langt mere udbredt hos ældre mennesker. For at skabe en kræftcelle skal der ske en række mutationer i den samme celle. Da sandsynligheden for, at et gen bliver muteret, er meget lille, står det klart, at chancen for, at flere forskellige mutationer forekommer i den samme celle, virkelig er meget usandsynlig. Af denne grund har cellerne i en 70-årig krop haft mere tid til at akkumulere de ændringer, der er nødvendige for at danne kræftceller, mens cellerne i et barn har langt mindre sandsynlighed for at have erhvervet de nødvendige genetiske ændringer. Selvfølgelig får nogle børn kræft, men det er langt mere almindeligt hos ældre personer. Grafen nedenfor viser antallet af tarmkræfttilfælde i USA som en funktion af alder. Grafen er hentet fra National Cancer Institute. 2
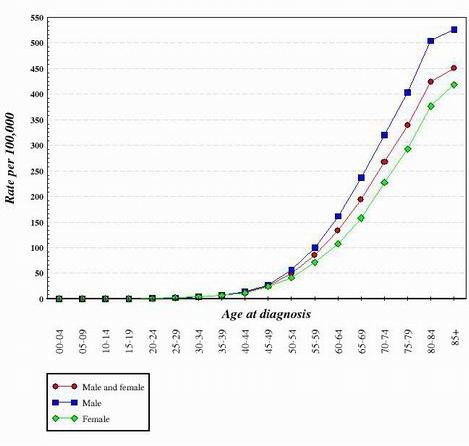
Gennem at se på formen af kurver som dem, der er vist ovenfor, er det blevet konkluderet, at der kræves flere genetiske ændringer for at skabe celler, der bliver kræftsyge.
I laboratoriet har forskere forsøgt at skabe tumorceller ved at ændre eller indføre vigtige regulerende proteiner. Flere undersøgelser har forsøgt at definere det minimale antal genetiske ændringer, der er nødvendige for at skabe en kræftcelle, med spændende resultater.3
I naturen kan mutationer akkumuleres i celler over tid, og hvis den “rigtige” gruppe af gener er muteret, kan der opstå kræft. En undersøgelse fra 2012 viste, at knoglemarvsstamceller i et sundt individ akkumulerer mange mutationer, efterhånden som personen bliver ældre. Bare nogle få yderligere ændringer i nøglegener kan forårsage kræft. Resultaterne antyder, at “normale” celler og kræftceller måske ikke er så forskellige i mange tilfælde.4
Arvelige mutationer i kræft
For at komplicere tingene er det klart, at de ændringer, der er nødvendige for at skabe en kræftcelle, kan opnås på mange forskellige måder. Selv om alle kræftformer skal overvinde det samme spektrum af reguleringsfunktioner for at kunne vokse og udvikle sig, kan de involverede gener være forskellige. Desuden kan rækkefølgen, i hvilken generne bliver de-reguleret eller går tabt, også variere. Som eksempel kan tyktarmskræfttumorer fra to forskellige personer involvere meget forskellige sæt tumorsuppressorer og onkogener, selv om resultatet (kræft) er det samme.
Den store heterogenitet, der ses i kræft, selv i kræft i det samme organ, betyder, at diagnose og behandling er kompliceret. De nuværende fremskridt inden for molekylær klassifikation af tumorer bør gøre det muligt at udforme rationelle behandlingsprotokoller baseret på de faktiske gener, der er involveret i et givent tilfælde. Nye diagnostiske test kan omfatte screening af hundredvis eller tusindvis af gener med henblik på at skabe en personlig profil af tumoren hos en person. Disse oplysninger skulle gøre det muligt at skræddersy kræftbehandlinger, der er tilpasset den enkelte person. For yderligere oplysninger om dette se afsnittet Genomics/Proteomics.
De genetiske ændringer, der fører til ureguleret cellevækst, kan erhverves på to forskellige måder. Det er muligt, at mutationen kan opstå gradvist over en årrække, hvilket fører til udvikling af et “sporadisk” tilfælde af kræft. Alternativt er det muligt at arve dysfunktionelle gener, der fører til udvikling af en familiær form af en bestemt kræfttype. Nogle eksempler på kræftformer med kendte arvelige komponenter omfatter:
- Brystkræft – Arv af muterede versioner af BRCA1- og BRCA2-generne er kendte risikofaktorer. Selv om mange, hvis ikke de fleste personer med brystkræft ikke har påviselige ændringer i disse gener, øger en muteret form sandsynligheden for at udvikle brystkræft, hvis man har en muteret form.
- Koloncancer- Defekter i DNA-reparationsgener såsom MSH2 er kendt for at disponere personer for arvelig ikke-polyposis kolorektal cancer (HNPCC).
- Retinoblastom- Defekter i Rb-tumorsuppressor-genet er kendt for at forårsage denne øjenkræft og flere andre typer kræft. Mere om denne særlige sygdom findes i afsnittet om Rb
Dette er en ufuldstændig liste over de kendte arvelige kræfttyper, og det er sikkert, at der vil blive identificeret flere arvelige kræftformer, efterhånden som genetikken for forskellige kræfttyper bliver klarlagt.
Der kan findes flere oplysninger om dette emne i kapitel 2 og 4 i The Biology of Cancer af Robert A. Weinberg.
Mutationstyper
Den proces, hvorved proteiner fremstilles, translation, er baseret på “læsning” af mRNA, der blev produceret via transkriptionsprocessen. Enhver ændring i det DNA, der koder for et gen, vil føre til en ændring af det producerede mRNA. Til gengæld kan det ændrede mRNA føre til produktion af et protein, som ikke længere fungerer korrekt. Selv en ændring af et enkelt nukleotid langs DNA’et i et gen kan føre til et helt ufunktionelt protein.
Der er flere forskellige måder, hvorpå DNA kan ændres. I det følgende afsnit beskrives de forskellige typer af genetiske ændringer nærmere.
Punktmutationer
Genetiske ændringer kan inddeles i to generelle kategorier. Den første kategori består af ændringer, der kun ændrer en eller få nukleotider langs en DNA-streng. Disse typer ændringer betegnes punktmutationer.
Når ribosomer læser et budbringer-RNA-molekyle, fortolkes hver tredje nukleotid som én aminosyre. Disse tre bogstavkoder kaldes kodoner. For at lave en analogi til en engelsk sætning: “The fat cat ate the rat” ville indeholde 6 kodoner. De ændringer, som mutationer medfører, kan føre til ting som “The fat bat ate the rat.” eller “The fa” eller “The fat oca tat her at…”. Indvirkningen på proteinet afhænger af, hvor ændringen sker, og hvilken type ændring der er tale om.
De kodoner på tre bogstaver, som ribosomerne læser, kan ændres ved mutation på en af tre måder:
Nonsense-mutationer
Den nye kodon medfører, at proteinet afsluttes for tidligt, hvilket giver et protein, der er forkortet og ofte ikke fungerer korrekt eller slet ikke.
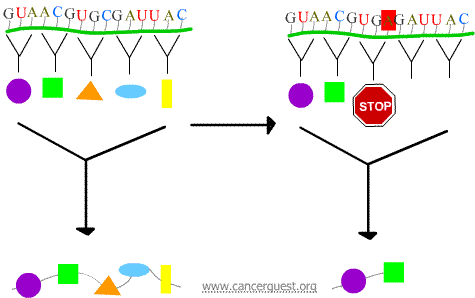
Missense-mutationer
Det nye codon medfører, at der indsættes en forkert aminosyre i proteinet. Virkningerne for proteinets funktion afhænger af, hvad der indsættes i stedet for den normale aminosyre.

Frameshift-mutationer
Tabet eller gevinsten af 1 eller 2 nukleotider medfører, at det berørte codon og alle de efterfølgende codoner læses forkert. Dette fører til et meget anderledes og ofte ikke-funktionelt proteinprodukt.
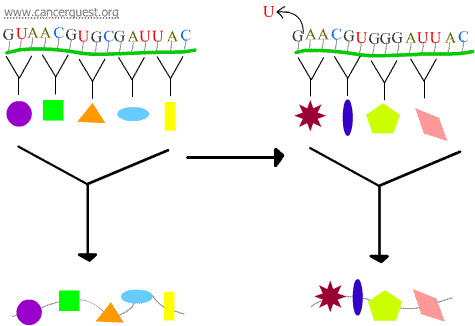
Transskriptionsfejl
En vis DNA-skade resulterer i et modificeret nukleotid eller en lille gruppe af nukleotider, som ikke kan “læses” af RNA-polymerase. Når RNA-polymerase-komplekset når frem til disse steder, vil det nogle gange omgå skaden ved at tilføje nukleotider i et forsøg på at fortsætte, selv om det betyder, at det er det forkerte, der skal lægges ind. Denne proces er kendt som transkriptionel mutagenese, og den kan spille en væsentlig rolle i udviklingen af kræft.5
Translokationer
En anden kategori af mutationer omfatter ændringer af større mængder DNA, ofte på kromosomniveau. Disse kaldes translokationer og indebærer brud og flytning af kromosomfragmenter. Ofte giver brud i to forskellige kromosomer mulighed for dannelse af to “nye” kromosomer med nye kombinationer af gener.
Selv om det kan se ud til, at dette ikke ville give store problemer, da alle generne stadig er til stede, kan processen føre til en dereguleret cellevækst på en række måder-
1. Generne bliver måske ikke transskriberet og oversat korrekt på deres nye placering.
2. Flytningen af et gen kan føre til en stigning eller et fald i dets transkriptionsniveau.
3. Brud og genforening kan også ske inden for et gen (som vist med grønt ovenfor), hvilket fører til dets inaktivering.
For nogle kræftformer er bestemte translokationer meget almindelige og kan endda bruges til at diagnosticere sygdommen. Translokationer er almindelige i leukæmier og lymfomer og er blevet mindre almindeligt identificeret i kræftformer i fast væv. Som eksempel kan nævnes en udveksling mellem kromosom 9 og 22, der ses hos over 90 % af patienter med kronisk myelogen leukæmi (CML). Udvekslingen fører til dannelse af en forkortet form af kromosom 22, der kaldes Philadelphia-kromosomet (efter det sted, hvor det blev fundet). Denne translokation fører til dannelsen af et onkogen fra abl-proto-onkogenet.67
Andre kræftformer, der ofte (eller altid) er forbundet med bestemte translokationer, omfatter Burkitt-lymfom, B-celle-lymfomer og flere typer leukæmi.
Genforstærkning
I denne meget usædvanlige proces er den normale DNA-replikationsproces alvorligt forstyrret. Resultatet er, at der i stedet for at lave en enkelt kopi af et område af et kromosom produceres mange kopier i stedet for at lave en enkelt kopi af et område af et kromosom. Dette fører til, at der produceres mange kopier af de gener, der er placeret på den pågældende region af kromosomet. Nogle gange produceres der så mange kopier af den forstærkede region, at de faktisk kan danne deres egne små pseudokromosomer kaldet dobbeltminutkromosomer.
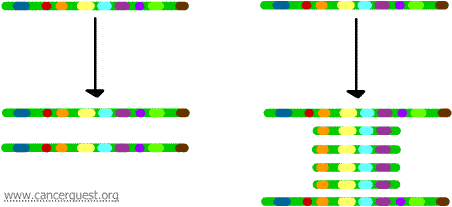
Generne på hver af kopierne kan transskriberes og oversættes, hvilket fører til en overproduktion af det mRNA og protein, der svarer til de forstærkede gener, som vist nedenfor. De snoede linjer repræsenterer mRNA, der produceres via transkriptionen af hver kopi af genet.
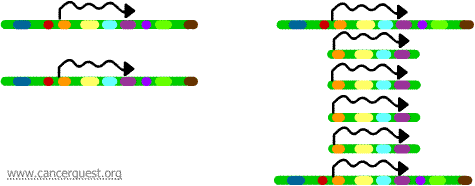
Selv om denne proces ikke ses i normale celler, forekommer den ret ofte i kræftceller. Hvis et onkogen indgår i den forstærkede region, kan den resulterende overekspression af dette gen føre til dereguleret cellevækst. Som eksempler herpå kan nævnes amplifikation af myc-onkogenet i en lang række tumorer og amplifikation af ErbB-2 eller HER-2/neu-onkogenet i bryst- og æggestokkræft. I tilfælde af HER-2/neu-onkogenet er kliniske behandlinger blevet udviklet til at målrette celler, der overudtrykker proteinproduktet.
Genforstærkning bidrager også til et af de største problemer i forbindelse med kræftbehandling: lægemiddelresistens. Lægemiddelresistente tumorer kan fortsætte med at vokse og sprede sig, selv i tilstedeværelse af kemoterapimidler. Et gen, der ofte er involveret, kaldes MDR for multipel lægemiddelresistens. Proteinproduktet fra dette gen fungerer som en pumpe, der er placeret i cellemembranen. Det er i stand til selektivt at udstøde molekyler fra cellen, herunder kemoterapimidler. Denne fjernelse gør lægemidlerne ineffektive.
Dette behandles mere detaljeret i afsnittet om lægemiddelresistens. Amplifikation af forskellige gener kan gøre andre kemoterapimidler ineffektive.
Inversioner, duplikeringer og sletninger
Inversioner
I disse ændringer frigøres segmenter af DNA fra et kromosom og genindsættes derefter i den modsatte retning. Som i de foregående eksempler kan denne omlægning føre til unormal genekspression, enten ved at aktivere et onkogen eller deaktivere et tumorsuppressorgen.
Duplikationer/deletioner
Gennem replikationsfejl kan et gen eller en gruppe af gener blive kopieret mere end én gang inden for et kromosom. Dette adskiller sig fra genamplifikation ved, at generne ikke replikeres uden for kromosomet, og at de kun kopieres én ekstra gang og ikke hundredvis eller tusindvis af gange. Gener kan også gå tabt på grund af fejl i replikationsprocessen eller andre genetiske skader.

Aneuploidi
Aneuploidi er den genetiske ændring, der indebærer tab eller tilvækst af hele kromosomer. På grund af problemer i celledelingsprocessen er det muligt, at de replikerede kromosomer ikke adskilles nøjagtigt i dattercellerne. Dette kan resultere i celler, der har for mange kromosomer eller for få kromosomer. Et eksempel på en ret almindelig aneuploid tilstand, der ikke har noget med kræft at gøre, er Downs syndrom, hvor der er en ekstra kopi af kromosom 21 i alle cellerne hos den berørte person.
I animationen nedenfor laves der kopier af to kromosomer, men når cellen deler sig, fordeles kromosomerne ikke jævnt på de to celler, der dannes (datterceller). Resultatet er, at den ene celle har for mange kromosomer og den ene ikke har nok.
Kræftceller er meget ofte aneuploide. Mennesker har normalt 46 kromosomer i deres celler, men kræftceller har ofte mange flere, nogle gange mere end 100 kromosomer. Tilstedeværelsen af de ekstra kromosomer gør cellerne ustabile og forstyrrer i høj grad kontrollen med celledelingen. Der er i øjeblikket en løbende debat om, hvorvidt alle kræftformer er aneuploide eller ej. Uanset om det er tilfældet, står det klart, at aneuploidi er et fælles træk ved kræftceller.
Epigenetiske ændringer
Ud over egentlige ændringer i DNA-sekvensen kan genekspressionen ændres ved ændringer i DNA’et og kromatinet, som ikke ændrer sekvensen. Da disse ændringer ikke ændrer DNA-sekvensen i generne, betegnes de som epigenetiske ændringer. To typer epigenetiske ændringer er beskrevet nedenfor.
Methylering
I denne ændring modificeres nogle nukleotider i DNA’et ved at tilføje en methylgruppe (-CH3) til basen. Methylering af DNA er forbundet med inaktivering af det pågældende område af DNA. Unormale DNA-methyleringsmønstre er blevet set i kræftceller. Ligesom de beskrevne ændringer ændrer methylering udtrykket af de berørte gener.
Acetylering
I denne epigenetiske ændring bliver de histonproteiner, som DNA’et er viklet omkring, modificeret ved tilsætning af acetyl (-CH3CHO)-grupper. Denne ændring fører til en løsgørelse af interaktionen mellem DNA og histon og er forbundet med øget genekspression. Ændringen af processerne for tilføjelse og fjernelse af acetylgrupper til DNA er et aktivt område inden for forskning i kræftbehandling.
Mere om epigenetiske ændringer og kræftbehandlinger.
Årsager til mutation
Som vi har set, skabes kræftceller fra normale forløberceller via en akkumulering af genetiske skader. De mekanismer, hvormed ændringerne fremkaldes, er varierende. I bred forstand falder agenterne for genetiske ændringer (mutationer) primært i de kategorier, der er beskrevet nedenfor, og som diskuteres indgående i det følgende afsnit.
Spontane mutationer
Spontane mutationer: Baserne (A, T, G, C) i DNA ændres eller går tabt som følge af ikke-reparerede replikationsfejl eller tilfældige molekylære hændelser. F.eks. fører tabet af en aminogruppe fra cytosin, en normal base, der findes i DNA, til produktion af uracil, en base, der normalt ikke findes i DNA. Hvis denne ændring ikke opdages og omvendes, kan der opstå en mutation. Undertiden kan en hel base gå tabt som følge af spaltning af bindingen mellem DNA-rygsøjlen og basen. Dette fører til et hul i DNA-dobbelthelixen, som, hvis det ikke repareres, kan føre til en mutation næste gang DNA’et kopieres (dvs. under replikationen).
Inducerede mutationer
Inducerede mutationer: Mutationer kan fremkaldes ved at udsætte organismer (eller celler) for en række forskellige behandlinger. Nogle af de mest almindelige er:
Stråling- Stråling er et af de første kendte mutagener og er en potent inducerende faktor for mutationer. Forskellige typer stråling forårsager forskellige typer af genetiske ændringer. Ultraviolet (UV) stråling forårsager punktmutationer. Røntgenstråler kan forårsage brud i DNA-dobbelthelixen og føre til translokationer, inversioner og andre typer kromosomskader. Udsættelse for UV-stråler i sollys har været forbundet med hudkræft. Bemærk, at strålings DNA-skadelige egenskaber er blevet udnyttet i flere forskellige strålebaserede kræftbehandlinger.
Nedenfor ses en type mutation, der forårsages af ultraviolet stråling. I dette eksempel får UV-strålingernes bombardement af DNA-dobbelthelixen to baser til at slå sig sammen. Dette ændrer DNA’s struktur og kan føre til permanente ændringer, hvis det ikke repareres.
En anden type stråling er den energi, der udsendes af naturligt forekommende radioaktive elementer (som radon og uran) eller menneskeskabte kilder, som dem, der findes (og skabes) i atomreaktorer. Stråling af denne type findes i forskellige typer og kan forårsage forskellige typer af skader på celler og væv. Stråling kan beskadige DNA direkte eller forårsage dannelse af kemikalier (dvs. reaktive oxygenarter eller ROS), som derefter kan beskadige DNA eller andre cellekomponenter.
Bekæmpelse af stråling fra radioaktive materialer er veldokumenteret. Analyser af overlevende fra atombomberne, der blev kastet over Japan under Anden Verdenskrig, viste store stigninger i leukæmier kort efter eksponeringen og derefter stigninger i andre kræfttyper i løbet af de følgende årtier.8
Farlige mængder radioaktivt materiale er også blevet frigivet ved et uheld fra atomkraftværker. Strålingseksponering som følge af den utilsigtede udledning af radioaktive materialer fra atomreaktoren i Tjernobyl er blevet forbundet med stigninger i kræft i skjoldbruskkirtlen og andre ondartede kræftformer.9
Medicinske billeddannelsesmaskiner (som røntgenmaskiner og CT-scannere) udsætter også patienter for stråling. De mængder, der anvendes til en enkelt test, menes ikke at forårsage betydelige mængder kræft, men den langsigtede virkning af mange tests over en årrække er uklar.10 Ligeledes menes det ikke, at flypassagerers udsættelse for helkropsskanning i lufthavne udgør en risiko for kræft.11 Passagerer, der flyver i fly, udsættes også for stråling fra rummet, men på et lavt niveau, og det menes ikke at udgøre en kræftrisiko, heller ikke for flybesætningsmedlemmer.1112
Kemiske mutagener- Mange forskellige kemikalier er kendt for at forårsage mutationer. Disse kemikalier udøver deres virkning ved at binde sig til DNA eller DNA’s byggesten og gribe ind i replikations- eller transkriptionsprocesserne. Nogle eksempler på potente mutagener er benzo-a-pyren, et kemikalie, der findes i cigaretrøg, og aflatoxin, et mutagen, der oftest findes i ukorrekt opbevarede landbrugsprodukter.
Kronisk inflammation- Kronisk inflammation kan føre til DNA-skader på grund af produktion af mutagene kemikalier fra cellerne i immunsystemet. Et eksempel herpå er langvarig inflammation forårsaget af infektion med hepatitisvirus. Læs mere om virus og kræft.
Syreradikaler- Under indfangningen af energi fra maden, som sker i vores mitokondrier, kan der dannes kemikalier, som er meget reaktive og er i stand til at beskadige cellemembraner og selve DNA’et. Disse reaktive iltintermediater (ROI) kan også dannes ved eksponering af celler for stråling, som vist nedenfor.
Den mutagene aktivitet af ROI er forbundet med udviklingen af kræft samt med aktiviteterne af flere kræftbekæmpende behandlinger, herunder stråling og kemoterapi. 131415
Abnormale celledeling
Under mitose er det muligt, at celledelingsprocessen ikke lykkes med at dele de replikerede kromosomer nøjagtigt i to datterceller. En fejl af denne type vil føre til produktion af aneuploide celler. Cellerne vil enten mangle, eller have fået et betydeligt antal gener. Denne sjældne proces kan skabe celler, der er mere tilbøjelige til ureguleret celledeling. Som tidligere nævnt er en stor procentdel af de kræftformer, der er isoleret fra mennesker, aneuploide.
Hvis en celle har en mutation i et gen, hvis proteinprodukt er ansvarlig for at “kontrollere” delingsprocessen, kan tingene hurtigt komme ud af kontrol, og dattercellerne fra hver deling kan blive stadig mere unormale.
Vira som mutagener
Virusser menes at være ansvarlige for en betydelig procentdel af kræfttilfælde. Virus kan forårsage kræft på en række forskellige måder, og den måde, som hver enkelt virustype virker på, er sandsynligvis lidt forskellig. Nogle vira (herunder mange retrovirusser) kan forårsage mutationer ved at indsætte deres gener i den inficerede celles genom. Det indsatte DNA kan ødelægge eller ændre aktiviteten af de berørte gener.161718
Vira kan også forårsage mutationer på indirekte måder. Som et eksempel: En infektion med hepatitisvirus kan vare i mange år. I den periode forsøger kroppens forsvarssystem at slippe af med viruset ved at producere giftige kemikalier. Disse kemikalier kan forårsage skade på ellers sunde “forbipasserende” celler og sende dem på den vej, der fører til kræft. Der er mange andre måder, hvorpå virus kan forårsage kræft.1920
På grund af den betydning, som virus har for udviklingen af mange kræftformer, har vi oprettet et afsnit om virus og kræft.
Transposoner som mutagener
Transposoner er korte DNA-sekvenser, som har evnen til at bevæge sig fra et sted i DNA til et andet sted. Transposoner koder for et enzym, transposase, der fungerer som splejsning af transposonen til nye steder i et genom (se skematisk fremstilling af en transposon nedenfor til venstre). Transposoner blev opdaget af Barbara McClintock, og hun vandt en Nobelpris for sit arbejde.2122 Det menneskelige genom indeholder mange inaktiverede kopier af transposoner, der har mistet deres evne til at flytte eller “hoppe” til nye steder. Omkring 50 % af det menneskelige genom består af “døde” transposoner.23
Bevægelsen af aktive transposoner kan føre til mutationer og ændre genernes aktivitet. Et synligt eksempel på transposonbevægelse (kaldet transposition) er farvningen af kernerne i indisk majs (se nedenfor til højre). De transposoner, der er aktive i mennesker, menes at være involveret i menneskelige sygdomme, herunder kræft.242526


Mutation Resumé
Genetisk ændring (mutation) Introduktion
- Den unormale adfærd, som kræftceller udviser, er resultatet af en række mutationer i vigtige regulerende gener (dvs. DNA-reparationsgener).
- De fleste kræftformer menes at opstå fra en enkelt forstadiecelle, der erhverver tilstrækkelige mutationer til at blive en kræftcelle.
DNA-mutationer
- Genetiske ændringer kan være små og kun påvirke et eller få nukleotider (punktmutationer), eller de kan være ret store og ændre strukturen af et kromosom eller kromosomer.
- Punktmutationer
- Translation er produktionen af et protein ved hjælp af enzymer, der “læser” tre nukleotid-“ord” (kodoner) langs et messenger RNA (mRNA).
- Selv en ændring af et enkelt nukleotid langs et gens DNA kan føre til et helt ufunktionelt protein. Mutationerne er grupperet efter de ændringer, de skaber i det resulterende proteinprodukt fra det berørte gen.
- Nonsense-mutationer – Det nye (muterede) kodon medfører, at proteinsyntesen stopper for tidligt.
- Missense-mutationer – Det ændrede kodon medfører, at der indsættes en forkert aminosyre i proteinet.
- Frameshift-mutationer – Tab eller gevinst af 1 eller 2 nukleotider i et mRNA medfører, at kodoner læses forkert. Resulterer ofte i forkortede og ikke-funktionelle proteiner.
- Forandringer på kromosomniveau
- Translokationer – Brud og (undertiden) udveksling af kromosomfragmenter.
- Genamplifikation – Unormal replikation skaber flere kopier af en region af et kromosom. I sidste ende fører dette til overproduktion af de tilsvarende proteiner.
- Inversioner – DNA-segmenter frigøres fra et kromosom og genindsættes derefter i den modsatte retning.
- Duplikationer/delektioner – Et gen eller en gruppe af gener kan gå helt tabt eller blive kopieret mere end én gang inden for et kromosom.
- Aneuploidi – En genetisk ændring, der indebærer tab eller tilvækst af hele kromosomer.
- Spontane mutationer kan opstå som følge af ikke-repareret DNA eller tilfældige molekylære hændelser.
- Aneuploidi er meget almindelig i kræftceller.
Epigenetiske ændringer
- Genekspression kan ændres ved ændringer i DNA og kromatin, som ikke ændrer den genetiske sekvens. Eksempler herpå er DNA-methylering og acetylering af histoner.
- Methylering – Nogle nukleotider i DNA’et modificeres ved tilføjelse af en methylgruppe, som er forbundet med inaktivering af den pågældende region af DNA
- Acetylering – Tilføjelse af acetylgrupper løsner DNA’et og øger genekspressionen.
Inducerede mutationer
- Mutationer kan induceres ved at udsætte organismer (eller celler) for en række forskellige behandlinger:
- Stråling – UV-stråler forårsager punktmutationer, og røntgenstråler forårsager flere former for skader.
- Kemiske mutagener – Kan binde sig til DNA eller DNA’s byggesten og forstyrre replikations- eller transkriptionsprocesserne.
- Kronisk inflammation – DNA-skader som følge af produktion af mutagene kemikalier fra cellerne i immunsystemet
- Syreradikaler – Fremkommer fra en celles energiproduktion og kan beskadige DNA.
Andre genetiske forandringer
- Aberrant celledeling, der resulterer i ukorrekt deling af kromosomerne, kan føre til aneuploidi.
- Virus kan forårsage genetiske skader på flere forskellige måder og er forbundet med en lang række kræftformer.
Mutationer og kræft
- Det ser ud til, at overgangen fra en normal, sund celle til en kræftcelle er en trinvis udvikling.
- Kræftudvikling kræver genetiske ændringer i flere forskellige onkogener og tumorsuppressorer.
- Alle kræftformer skal overvinde det samme spektrum af regulerende funktioner for at kunne vokse og udvikle sig, men de involverede gener kan være forskellige.
- Kræftens heterogenitet komplicerer diagnosticering og behandling.
- Det er muligt at arve dysfunktionelle gener, der fører til udvikling af en familiær form af en bestemt kræfttype.
Know the Flow: Mutation
Know the Flow er et interaktivt spil, hvor du kan teste din viden. Sådan spiller du:
- Træk de relevante valgmuligheder fra kolonnen til højre, og placer dem i rækkefølge i felterne til venstre. Bemærk, at du kun skal bruge fem af de seks valgmuligheder for at gennemføre spillet.
- Når du er færdig, skal du klikke på ‘Check’ for at se, hvor mange du fik ret.
- For forkerte svar skal du klikke på ‘Description’ for at se oplysninger om processerne.
- For at prøve igen skal du vælge ‘Reset’ og starte forfra.
-
1
-
2
-
3
-
4
-
5
-
Lær mereEn celle er i gang med DNA-syntese
-
Lær mereDer laves mange kopier af et område af et kromosom
-
Lær mereTransskription af forstærkede generLær mereTransskription af forstærkede generLær mereOverproduktion af en nøgle protein fører til vækst af lægemiddelresistent tumorLær mereDuplikation forekommerKontroller svarene NulstilDu gjorde det!Processen er i den rigtige rækkefølge!
Spil igen
Det er nødvendigt med Javascript for at spille Know the Flow- 1. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biology (11th ed.). Pearson.
- 2. Surveillance, Epidemioloy, and End Results (SEER) repræsenteret af National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. “Oprettelse af menneskelige tumorceller med definerede genetiske elementer”. Nature 400: 464-468
- 4. Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. The origin and evolution of mutations in acute myeloid leukemia (Oprindelse og udvikling af mutationer i akut myeloid leukæmi). Cell, 20. juli 2012
- 5. Brégeon D, Doetsch PW. Transkriptionel mutagenese: årsager og inddragelse i tumorudvikling. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. “Kromosomundersøgelser af normale og leukæmiske menneskelige leukocytter”. J Natl Cancer Inst (1960). 25: 85-100.
- 7. Rowley JD. “En ny konsistent kromosomal abnormitet i kronisk myelogen leukæmi identificeret ved quinacrin fluorescens og Giemsa farvning.” Nature (1973). 243: 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. Risiko for kræft og ikke-kræftsygdomme hos overlevende fra atombomberne. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. The Chernobyl accident–an epidemiological perspective. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 Mar 9.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Eksponering for ioniserende stråling i lave doser fra medicinske billeddannelsesprocedurer. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Airport Full-Body Screening: Hvad er risikoen? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Kosmisk stråling i kommerciel luftfart. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. “Oxidativ stress, DNA-skader og brystkræft”. AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. “Oxidativ stress og eksperimentel carcinogenese.” Indian J. Exp. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. “Oxyradikaler, lipidperoxidation og DNA-skader.” (2002)181-182:219-222
- 16. Nair V. Retrovirus-induceret onkogenese og sikkerheden ved retrovirale vektorer. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Epstein-Barr-virus og Burkitt-lymfom. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogene retrovirusser og kræft. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatitis B-virus-induceret onkogenese. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV-relateret hepatocellulært karcinom: Fra kronisk inflammation til kræft. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. Oprindelse og opførsel af mutable loci i majs. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Nobelprisforelæsning
- 23. Burns KH, Boeke JD. Human transposon tectonics. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Mobile genetiske elementer og kræft. Fra mutationer til genterapi. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Mobile elementer i det menneskelige genom: konsekvenser for sygdom. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Naturlig mutagenese af menneskelige genomer ved hjælp af endogene retrotransposoner. Cell. 2010 Jun 25;141(7):1253-61.