Solut sisältävät paljon vettä. Yksi veden tehtävistä on liuottaa erilaisia aineita. Soluissa on esimerkiksi monia erilaisia ionisia yhdisteitä (suoloja). Ioneja käytetään solupotentiaalien ylläpitämiseen, ja ne ovat tärkeitä solujen viestinvälityksessä ja lihasten supistumisessa.
Miten voit sanoa, onko yhdiste ioninen vai kovalenttinen?
Tähän kysymykseen ei ole yksinkertaista vastausta. Monet sidokset ovat jossain siltä väliltä. Polaarisessa kovalenttisessa sidoksessa elektronipari jaetaan kahden atomin välillä niiden kahdeksikon täyttämiseksi, mutta elektronit sijaitsevat lähempänä sidoksen toista päätä kuin toista. Sidoksen toiseen päähän päin on enemmän negatiivista varausta, jolloin toiseen päähän jää enemmän positiivista varausta.
Katsomalla eri atomien elektronegatiivisuusarvoja voimme päätellä, kuinka tasaisesti elektronipari jaetaan sidoksessa. Elektronegatiivisuus kasvaa kohti jaksollisen järjestelmän oikeaa yläkulmaa ydinvarauksen ja suojaavien tekijöiden yhdistelmän vuoksi. Jaksollisen järjestelmän oikeassa yläkulmassa olevilla atomeilla on suurempi vetovoima jaettuihin sidoselektroneihin, kun taas vasemmassa alakulmassa olevilla atomeilla on heikompi vetovoima kovalenttisten sidosten elektroneihin.
Hiilen ja hapen välisessä sidoksessa happi vetäisi puoleensa enemmän elektroneja, koska se on jaksollisen järjestelmän rivillä hiilen oikealla puolella. Yhdisteet kuten , dimetyylieetteri, CH3OCH3, ovat hieman polaarisia. Formaldehydi, CH2O, on vielä enemmän polaarinen. Kvanttimekaniikkaan liittyvistä syistä piisidosten elektronit ovat löysemmällä kuin sigmasidosten elektronit. Tämän ansiosta happi voi vetää elektroneja puoleensa helpommin moninkertaisessa sidoksessa kuin sigmasidoksessa.

Kaikkea polaarisuutta ei ole helppo määrittää vilkaisemalla jaksollista järjestelmää. Boorin ja vedyn välisen sidoksen dipolin suuntaa olisi vaikea ennustaa katsomatta elektronegatiivisuusarvoja, koska boori on kauempana oikealla mutta vety ylempänä. Kuten käy ilmi, vety on lievästi negatiivinen.
Sidos on ioninen, jos atomien välinen elektronegatiivisuusero on niin suuri, että toinen atomi voisi vetää elektronin kokonaan pois toiselta atomilta. Tällainen tilanne on yleinen yhdisteissä, joissa yhdistyvät jaksollisen järjestelmän vasemman reunan alkuaineet (natrium, kalium, kalsium jne.) ja jaksollisen järjestelmän äärimmäisessä oikeassa yläkulmassa olevat alkuaineet (yleisimmin happi, fluori, kloori). Natriumkloridi on ioninen yhdiste.
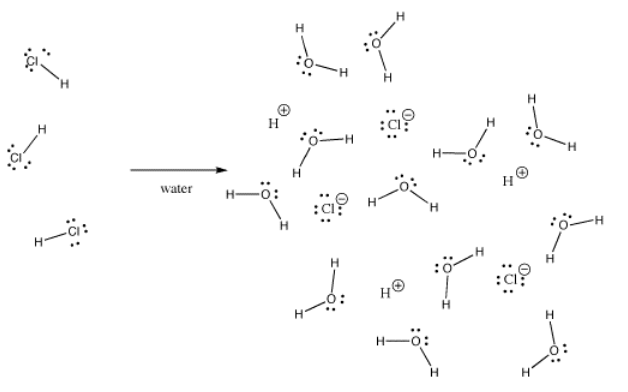
Monet sidokset voivat olla kovalenttisia yhdessä tilanteessa ja ionisia toisessa. Esimerkiksi kloorivety, HCl, on kaasu, jossa vety ja kloori ovat kovalenttisesti sidoksissa, mutta jos HCl:ää kuplitetaan veteen, se ionisoituu kokonaan ja antaa suolahappoliuoksen H+ ja Cl-. Jopa kaasumaisessa HCl:ssä varaus ei jakaudu tasaisesti. Kloori on osittain negatiivinen ja vety osittain positiivinen.
Kaliumhydroksidi, KOH, sisältää yhden kovalenttisen (O-H) ja yhden ionisen (K-O) sidoksen. Vety on hankala, koska se on jaksollisen järjestelmän yläosassa sekä vasemmalla puolella. Se on juuri sen verran sähköpositiivinen, että se voi joissakin tapauksissa muodostaa ionisidoksia. Se on juuri ja juuri tarpeeksi elektronegatiivinen muodostaakseen kovalenttisia sidoksia toisissa tapauksissa.
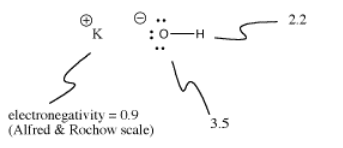
KOH:ssa K-O-sidos on ioninen, koska kaliumin ja hapen elektronegatiivisuusero on suuri. Hapen ja vedyn välinen elektronegatiivisuusero ei ole pieni. O-H-sidos voi joskus ionisoitua, mutta ei kaikissa tapauksissa.
Joskus ionisaatio riippuu siitä, mitä muuta molekyylissä tapahtuu. Koska kaliumhydroksidin K-O-sidos on ioninen, O-H-sidos ei todennäköisesti ionisoidu. Hapessa on jo negatiivinen varaus. Varauserottelu maksaa energiaa, joten on vaikeampaa saada happiin toinen negatiivinen varaus ionisoimalla myös O-H-sidos. Usein molekyylien ensimmäiset ionisaatiot ovat paljon helpompia kuin toiset ionisaatiot.
Harjoitus \(\PageIndex{1}\)
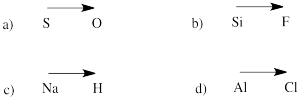
Arvioi seuraavien parien atomien välisen sidoksen napaisuuden suunta:
a) rikki-happi b) pii-fluori
c) vety-natrium d) kloori-alumiini
Vastaus
Koska on niin tavallista, että jaksollisen järjestelmän vasemmanpuoleisimman reunan alkuaine esiintyy kationina, ja että äärioikealla olevat alkuaineet kantavat negatiivista varausta, voimme usein olettaa, että yhdisteessä, joka sisältää esimerkin kummastakin, on vähintään yksi ionisidos.
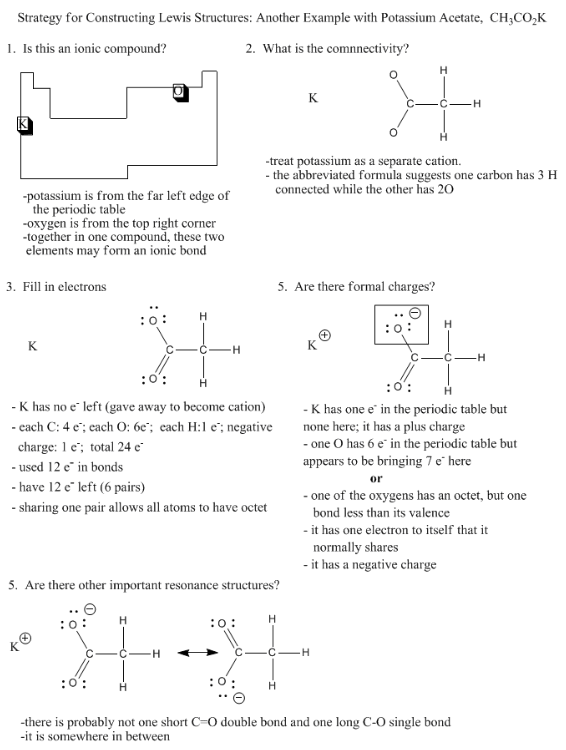
Harjoitus \(\PageIndex{2}\)
Piirrä seuraavien yhdisteiden rakenteet. Jokainen sisältää vähintään yhden anionin ja kationin.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Vastaus
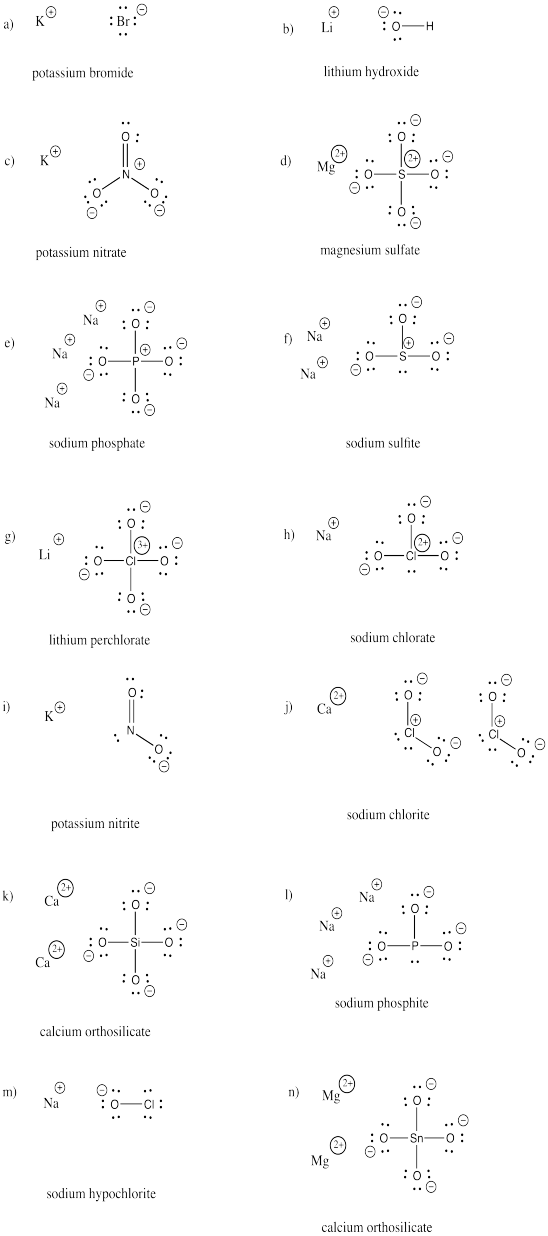
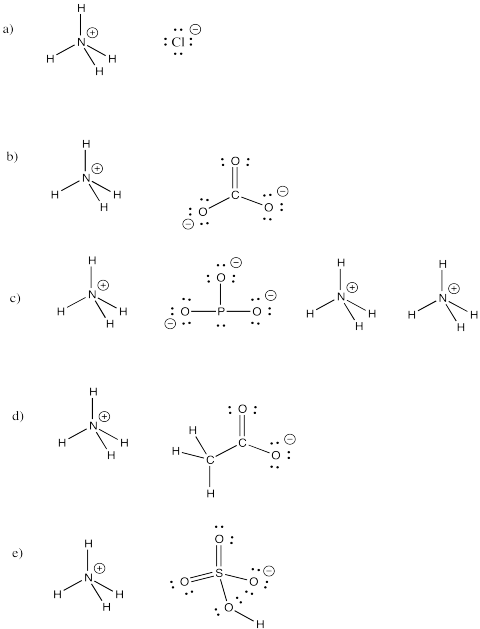
Harjoitus \(\PageIndex{3}\)
Ammoniumioni, NH4+, on yleinen molekyyli-ioni. Piirrä seuraavien tätä ionia sisältävien yhdisteiden rakenteet.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Vastaus
Harjoitustehtävä \(\PageIndex{4}\)
Monilla anioneilla on nimiä, jotka kertovat jotain niiden rakenteesta.
| prefiksi- tai -suffiksi |
yleinen merkitys |
esimerkkinimi | esimerkkikaava |
| -ide | atomi esiintyy anionina | kloridina | Cl – |
| -ate | atomi esiintyy oksyanionina; yleensä yleinen muoto | kloraatti | ClO3- |
| -itti | atomi esiintyy oksianionina, mutta jossa on vähemmän happigeenejä (tai alhaisempi ”hapetusaste”) kuin toisessa yleisessä muodossa | kloriitti | ClO2- |
| per- | atomi on läsnä oksianionina, mutta jossa on vielä enemmän happigeenejä kuin ”-ate”-muodossa | perkloraatti | ClO4- |
| hypo- | atomi esiintyy happianionina, mutta siinä on vielä vähemmän happigeenejä kuin ”-iitti”-muodossa | hypokloriitti | ClO- |
Taulukkoa apuna käyttäen, ehdota nimiä seuraaville anioneille:
a) Br- b) O2- c) F- d) CO32- (yleinen oksanioni) e) NO3- (yleinen oksanioni) f) NO2-
g) S2- h) SO42- (yleinen oksanioni) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (yleinen oksanioni) o) PO33- p) I- q) IO3- (yleinen oksianioni) r) IO4-
Vastaus a)
bromidi
Vastaus b)
oksidi
Vastaus c)
fluoridi
Vastaus d)
karbonaatti
Vastaus e)
nitraatti
Vastaus f)
nitriitti
Vastaus g)
sulfidi
Vastaus h)
sulfaatti
Vastaus i)
sulfiitti
Vastaus j)
persulfaatti
Vastaus k)
karbidi
Vastaus l)
nitridi
Vastaus m)
arsenidi
Vastaus m)
arsenidi
Vastaus m)
arsenidi
Vastaus m)
fosfaatti
Vastaus m)
arsenidi
Vastaus n)
fosfaatti
Vastaus o)
fosfiitti
Vastaus p)
jodidi
Vastaus q)
jodaatti
Vastaus r)
perjodaatti
Attribuutio
Chris P Schaller, Ph.D., (Pyhän Benedictin korkeakoulu / Pyhän Johanneksen yliopisto)