Atomien emissiospektrit
Atomin elektronit pyrkivät järjestäytymään siten, että atomin energia on mahdollisimman pieni. Atomin perustila on atomin alhaisin energiatila. Kun näille atomeille annetaan energiaa, elektronit imevät energiaa ja siirtyvät korkeammalle energiatasolle. Nämä atomien elektronien energiatasot ovat kvantittuneita, mikä taas tarkoittaa sitä, että elektronin on siirryttävä energiatasolta toiselle erillisin askelin eikä jatkuvasti. Atomin kiihdytetty tila on tila, jossa sen potentiaalienergia on suurempi kuin perustilassa. Jännitetyssä tilassa oleva atomi ei ole stabiili. Kun se palaa takaisin perustilaan, se luovuttaa aiemmin saamansa energian sähkömagneettisen säteilyn muodossa.
Miten atomit siis ylipäätään saavat energiaa? Yksi tapa on johtaa sähkövirta suljetun kaasunäytteen läpi matalassa paineessa. Koska elektronien energiatasot ovat kullekin alkuaineelle yksilölliset, jokainen kaasupurkausputki hehkuu ominaista väriä riippuen kaasun identiteetistä (ks. alla).


”Neon”-merkit ovat tuttuja esimerkkejä kaasupurkausputkista. Kuitenkin vain neonilla täytetyt kyltit, jotka hehkuvat kuvassa näkyvällä oranssinpunaisella värillä, ovat todellisuudessa neonilla täytettyjä. Muiden värien merkit sisältävät erilaisia kaasuja tai kaasuseoksia.
Tutkijat tutkivat vetykaasun synnyttämän kaasupurkauksen erottuvaa vaaleanpunaista väriä. Kun tämän valon kapeaa sädettä tarkasteltiin prisman läpi, valo erottui neljäksi viivaksi, joilla oli hyvin erityiset aallonpituudet (ja taajuudet, koska \(\lambda\) ja \(\nu\) ovat kääntäen verrannollisia). Atomin emissiospektri on viivakuvio, joka muodostuu, kun valo kulkee prisman läpi ja erotetaan sen sisältämiin eri valotaajuuksiin. Alla olevassa kuvassa on esitetty vedyn atomiemissiospektri.
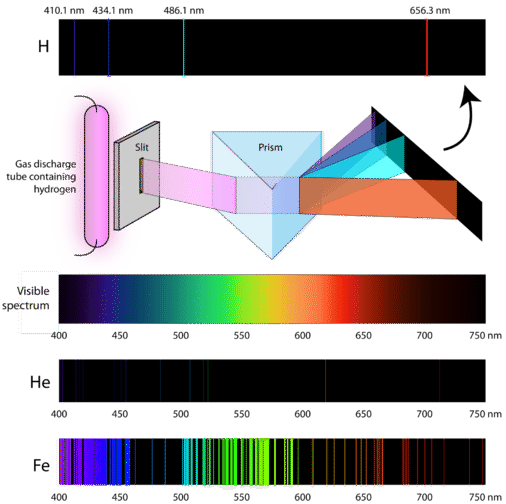
Klassinen teoria ei kyennyt selittämään atomiemissiospektrien, jotka tunnetaan myös nimellä emissioviivaspektrit, olemassaoloa. Klassisen fysiikan mukaan perustilassa oleva atomi pystyisi absorboimaan minkä tahansa määrän energiaa eikä vain diskreettejä määriä. Vastaavasti atomien rentoutuessa takaisin matalampienergiseen tilaan voisi vapautua mikä tahansa määrä energiaa. Tämä johtaisi niin sanottuun jatkuvaan spektriin, jossa kaikki aallonpituudet ja taajuudet ovat edustettuina. Valkoinen valo prisman läpi katsottuna ja sateenkaari ovat esimerkkejä jatkuvasta spektristä. Atomien emissiospektrit olivat lisää todisteita valon kvantittuneesta luonteesta, ja ne johtivat kvanttiteoriaan perustuvaan uuteen atomimalliin.