Jaksolliset trendit
Keskitymme ensin yksittäisiin atomeihin ja pohdimme trendejä, jotka liittyvät alkuaineen sijaintiin jaksollisessa järjestelmässä. Käytämme ensimmäisinä malleina yksinkertaisia orgaanisia yhdisteitä etaania, metyyliamiinia ja etanolia, mutta käsitteet soveltuvat yhtä lailla monimutkaisempiin biomolekyyleihin, joilla on samat funktionaaliset ominaisuudet, esimerkiksi aminohappojen sivuketjuihin alaniiniin (alkaani), lysiiniin (amiini) ja seriiniin (alkoholi).
Horisontaalinen jaksollinen trendi happamuudessa ja emäksisyydessä:
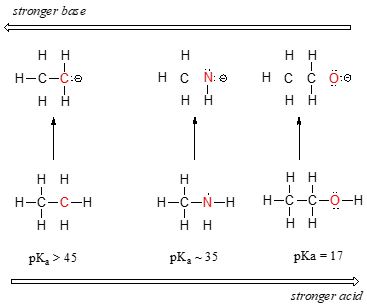
Voidaan nähdä selkeä trendi happamuudessa, kun liikutaan vasemmalta oikealle jaksollisen järjestelmän toista riviä pitkin hiilestä typpeen ja happiin. Avain tämän suuntauksen ymmärtämiseen on tarkastella hypoteettista konjugoitua emästä kussakin tapauksessa: mitä vakaampi (heikompi) konjugoitu emäs, sitä vahvempi happo. Katso, mihin negatiivinen varaus päätyy kussakin konjugaattiemäksessä. Etaanin konjugaattiemäksessä negatiivinen varaus on hiiliatomilla, kun taas metyyliamiinin ja etanolin konjugaattiemäksissä negatiivinen varaus on typpi- ja happiatomissa. Muista kohdasta 2.4A, että myös elektronegatiivisuus kasvaa siirryttäessä jaksollisen järjestelmän rivillä vasemmalta oikealle, mikä tarkoittaa, että happi on kolmesta atomista kaikkein elektronegatiivisin ja hiili vähiten elektronegatiivinen.
Huomautus
Mitä elektronegatiivisempi atomi on, sitä paremmin se pystyy kantamaan negatiivisen varauksen. Heikommilla emäksillä on negatiiviset varaukset enemmän elektronegatiivisilla atomeilla; vahvemmilla emäksillä on negatiiviset varaukset vähemmän elektronegatiivisilla atomeilla.
Metoksidianioni on siis kolmesta konjugaattiemäksestä stabiilein (pienimmän energian omaava, vähiten emäksinen) ja etyylikarbaanianionianioni vähiten stabiilein (suurimman energian omaava, emäksisin). Vastaavasti etanoli on vahvin happo ja etaani heikoin happo.
Kun liikutaan jaksollisen järjestelmän sarakkeessa vertikaalisesti, havaitaan jälleen selkeä jaksollinen suuntaus happamuudessa. Tätä havainnollistavat parhaiten halohapot ja halogenidit: emäksisyys, kuten elektronegatiivisuuskin, lisääntyy sarakkeessa ylöspäin mentäessä.
Happamuuden ja emäksisyyden vertikaalinen jaksollinen trendi:

Käänteisesti happamuus kasvaa halohapoissa, kun siirrymme sarakkeessa alaspäin.
Tämän trendin ymmärtämiseksi tarkastelemme jälleen kerran konjugaattiemästen stabiilisuutta. Koska fluori on elektronegatiivisin halogeenielementti, voisimme odottaa fluoridin olevan myös vähiten emäksinen halogeeni-ioni. Tosiasiassa se on kuitenkin vähiten stabiili ja emäksisin! Kävi ilmi, että kun jaksollisessa järjestelmässä liikutaan pystysuunnassa, atomin koko on emäksisyyden kannalta tärkeämpi kuin sen elektronegatiivisuus. Jodin atomisäde on noin kaksinkertainen fluoriin verrattuna, joten jodidi-ionissa negatiivinen varaus jakautuu huomattavasti suuremmalle tilavuudelle:

Tämä havainnollistaa orgaanisen kemian peruskäsitettä:
Elektrostaattiset varaukset, olivatpa ne sitten positiivisia tai negatiivisia, ovat stabiilimpia, kun ne ”jakautuvat” suuremmalle alueelle.
Tapaamme tämän ajatuksen ilmaistuna yhä uudelleen orgaanisen reaktiivisuuden tutkimisen aikana monissa eri yhteyksissä. Toistaiseksi sovellamme käsitettä vain atomisäteen vaikutukseen emäslujuuteen. Koska fluoridi on halogenidikonjugaattiemäksistä vähiten stabiili (emäksisin), HF on halogeenihapoista vähiten hapan, vain hieman vahvempi kuin karboksyylihappo. HI, jonka \(pK_a\) on noin -9, on lähes yhtä vahva kuin rikkihappo.
Mikä tärkeämpää biologisen orgaanisen kemian tutkimuksen kannalta, tämä suuntaus kertoo meille, että tiolit ovat happamia kuin alkoholit. Esimerkiksi kysteiinin sivuketjun tioliryhmän \(pK_a\) on noin 8,3, kun taas seriinin sivuketjun alkoholiryhmän \(pK_a\) on suuruusluokkaa 17.
Muistatko luvussa 6.2 esitellyn käsitteen ”käyttövoima”? Muista, että reaktiota ohjaava voima perustuu yleensä kahteen tekijään: suhteelliseen varauksen stabiilisuuteen ja suhteelliseen kokonaissidosenergiaan. Katsotaanpa, miten tämä pätee yksinkertaiseen happo-emäsreaktioon suolahapon ja fluoridi-ionin välillä:
\
Tiedämme, että HCl (\(pK_a\) -7) on vahvempi happo kuin HF (\(pK_a\) 3.2), joten reaktion tasapaino on tuotteen puolella: reaktio on eksergoninen, ja ”käyttövoima” työntää reaktanttia kohti tuotetta.
Millä selitetään tämä käyttövoima? Tarkastellaan ensin varaustekijää: kuten juuri opimme, kloridi-ioni (tuotepuolella) on stabiilimpi kuin fluoridi-ioni (reaktiopuolella). Tämä selittää osittain tässä reaktiossa reagoivasta aineesta tuotteeseen kulkevan käyttövoiman: siirrymme vähemmän stabiilista ionista stabiilimpaan ioniin.
Entäpä sidosten kokonaisenergia, toinen käyttövoiman tekijä? Jos katsot sidosenergiataulukkoa, näet, että H-F-sidos tuotteen puolella on energisempi (vahvempi) kuin H-Cl-sidos reaktantin puolella: 570 kJ/mol vs. 432 kJ/mol, vastaavasti). Myös tämä vaikuttaa osaltaan käyttövoimaan: siirrymme heikommasta (vähemmän stabiilista) sidoksesta vahvempaan (stabiilimpaan) sidokseen.