24th Annual Glaucoma Report
Alhaalla olevista linkeistä pääset lukemaan muita artikkeleita glaukooman vuosipäivityksestä:
Glaukooman hoito lasertarkkuudella
MIGS Madness: An Atlas of Options
Comanaging Invasive Glaucoma Surgeries
Glaucoma: (Ansaitse 2 CE-pistettä)
Asiantuntijat eivät ole vielä päässeet yksimielisyyteen glaukooman yleisesti hyväksytystä etiologiasta. Tästä he ovat kuitenkin yhtä mieltä: silmänpaineen (IOP) alentaminen on ainoa muokattavissa oleva riskitekijä sen etenemisen hidastamiseksi. Paikallinen lääkehoito on perinteinen ensilinjan lähestymistapa, ja vaihtoehtoja on enemmän kuin koskaan.
Tässä artikkelissa, Take Charge of Glaucoma -sarjamme kolmannessa osassa, tutustutaan moniin lääkkeisiin, joita OD:t voivat käyttää, ja annetaan neuvoja siitä, milloin mitäkin hoitoa kannattaa käyttää millekin potilaalle.
Early Autonomics
Lääkkeet, jotka vaikuttavat autonomiseen hermostoon (esim, kolinergit ja adrenergit) ovat olleet glaukooman hoidon perusta 1800-luvulta lähtien.1,2 Kolinergit aiheuttavat mioosia, joka venyttää ja stimuloi trabekulaarista verkkoa (TM) lisäämällä kammion ulosvirtausta sinne ja Schlemmin kanavaan.3 Tämän luokan jäseniä ovat muun muassa pilokarpiini, karbatsoli, fysostigmiini, neostigmiini ja ekotiopaatti. Näistä vain pilokarppi on edelleen rutiinikäytössä. Hoitovaste on annoksesta riippuvainen, ja IOP laskee noin 20 %, kun sitä määrätään QID.4
Take Charge of Glaucoma
Seuraa alla olevia linkkejä lukeaksesi muita artikkeleita neliosaisesta glaukooma-sarjastamme:
Ensimmäinen osa: Glaukooma: Toinen osa: Diagnostiikkatyökalut valmiiksi
Neljäs osa: Glaukoomahäiriö: Perusterveydenhuollon ristiretki
Neljäs osa: Play a Part in Postoperative Glaucoma Care
Koliinergisten lääkkeiden käyttöä rajoittavat niiden silmä- ja systeemiset sivuvaikutukset, vaikka ne ovatkin tehokkaita. Näihin kuuluvat sädelihaksen spasmi (johon liittyy päänsärkyä ja indusoitua likinäköisyyttä), miosis, sarveiskalvotoksisuus, punoitus, uveiitti, mahdollinen kaihin muodostuminen, hengityslama ja ruoansulatuskanavan häiriöt. Lisäksi uudemmilla lääkkeillä on suurempi silmänpainetta alentava teho, minkä vuoksi kolinergiset lääkkeet on varattu erityistapauksiin, joissa mioosivaikutuksesta voi olla lisähyötyä, kuten akuutti kulmasulku.
Adrenergiset agonistit taas vaikuttavat alfa- tai beeta-adrenergisiin reseptoreihin (tai molempiin, jos ne eivät ole selektiivisiä). Epinefriini, ensisijainen ei-selektiivinen aine, alentaa silmänpaineen alenemista vähentämällä ensin vesikalvon tuotantoa ja lisäämällä sitten ulosvirtausta TM:n kautta.5 Valitettavasti sen käyttö on rajallista merkittävien systeemisten sivuvaikutusten vuoksi. Epinefriinin 1970-luvulla kehitetty adrenaliinin aihiolääke dipivefriini mahdollistaa paljon pienempien emoyhdisteen pitoisuuksien käytön, jolloin systeemiset vaikutukset ovat vähäisemmät.6 Epäselektiivisiä adrenalgeetteja käytetään nykyään vain vähän, paitsi tapauksissa, joissa muut lääkkeet voivat olla vasta-aiheisia.
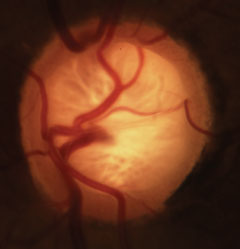
Glaukomatoottinen kuppikuvio, jossa on tyypillistä neuroretinaalisen reunan ja laminan häviäminen sekä verisuoniston muuttuminen. Klikkaa kuvaa suurentaaksesi.
Betasalpaajat
Adrenergiset antagonistit eli beeta (β)-salpaajat estävät vesikalvon tuotantoa ja ovat standardi, jolla uusia lääkkeitä verrataan. Erityisesti β-salpaajat vähentävät ultrasuodatusta, mikä rajoittaa takakammioon välitettävissä olevan kammionesteen substraatin saatavuutta.1,7,8 Nämä lääkkeet voivat olla epäselektiivisiä, eli ne estävät β-adrenergisten reseptorien molempia isomuotoja (β1 ja β2), tai kardioselektiivisiä, joilla on paljon suurempi affiniteetti β1-reseptoriin. β2 on silmän vallitseva adrenoreseptori, joten epäselektiivisillä aineilla on suurempi vaikutus silmänpaineen hallintaan.9,10
Topikaalisia β-salpaajia ovat timololi, levobunololi, metipranololi, karteololi ja betaksololi. Ainoastaan betaksololi on kardioselektiivinen – mikä tekee siitä hyödyllisen tietyissä vasta-aiheissa, mutta se saattaa olla tehottomampi vähentämään silmänpainetta.11 β-salpaajat vähentävät silmänpainetta 20-30 %, ja niitä voidaan annostella kahdesti päivässä. Niitä voidaan annostella myös kerran vuorokaudessa, erityisesti silloin, kun käytetään geelimäisiä liuoksia, koska niiden silmäkontaktiaika on pidempi.12,13 Adrenergisten antagonistien vaikutus voi olla vähäisempi unen aikana, joten on oltava varovainen, kun β-salpaajia annostellaan lähellä nukkumaanmenoaikaa, erityisesti jos niitä määrätään kerran vuorokaudessa.14,15 Jos potilaat käyttävät systeemisiä β-salpaajia, paikallisesti käytettävien β-salpaajien silmänpainetta alentava vaikutus vähenee, ja muita paikallisesti käytettävien lääkkeiden luokkia voidaan harkita.16
Vaikka tätä lääkitysluokkaa tulisi useimmiten välttää keuhko- tai sydänsairauksien yhteydessä, valikoiduissa tapauksissa voi olla järkevää harkita beetasalpaajahoitoa. Tämä olisi kuitenkin tehtävä asianmukaisen erikoislääkärin (kardiologian tai keuhkosairauksien erikoislääkärin) suostumuksella.
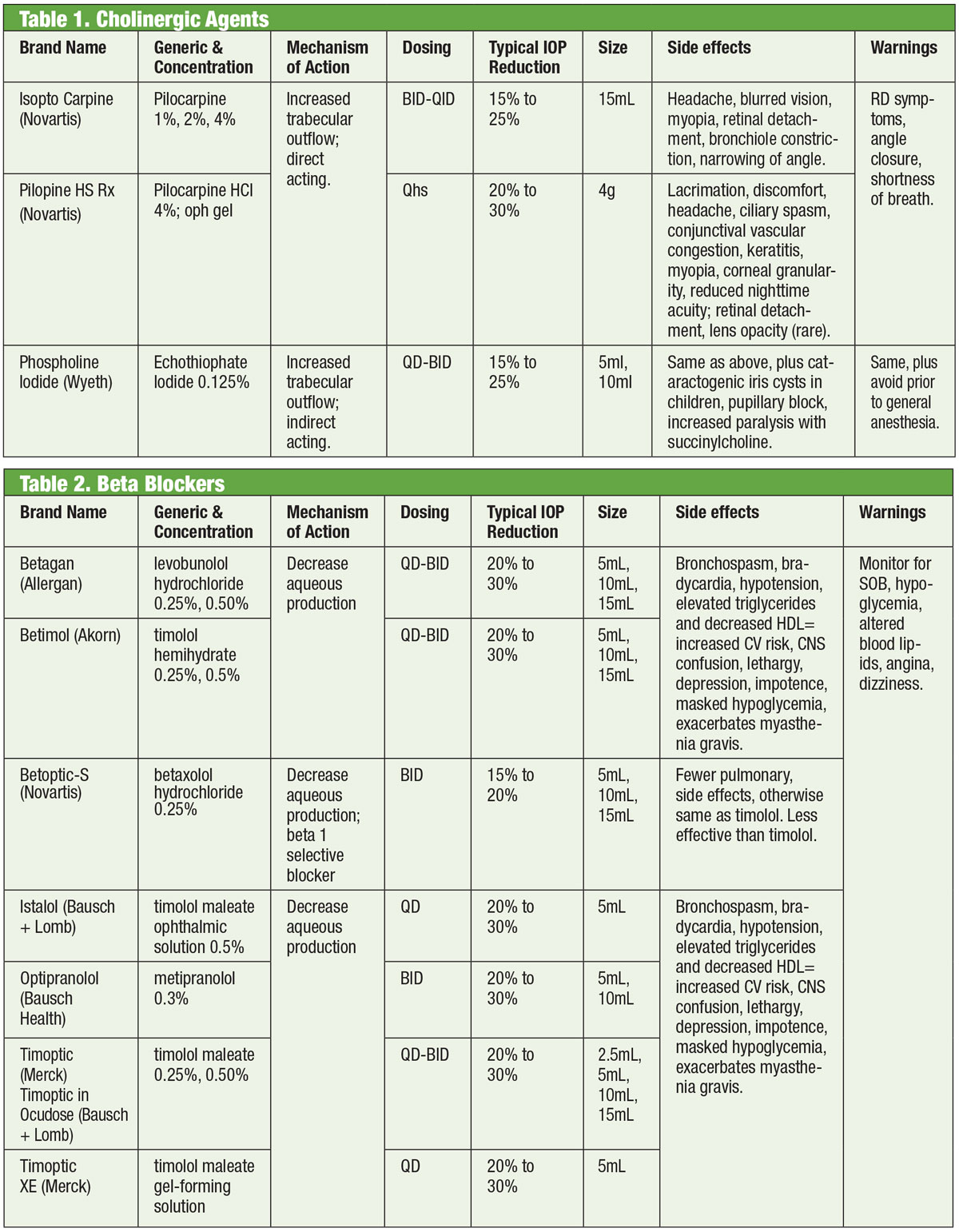
Taulukot: Bruce Onofrey, OD, RPh. Klikkaa kuvaa suurentaaksesi.
Yleisesti β-salpaajien käyttöä tulisi kuitenkin välttää henkilöillä, joilla on eteis-kammiokatkos, sinusbradykardia ja obstruktiivinen keuhkosairaus.17
Hiilihappoanhydraasin estäjät
Tutkijat ovat tunnustaneet suun kautta otettavien hiilihappoanhydraasin estäjien (carbonic anhydrase inhibitors, CAI) kyvyn alentaa silmänpaineen alenemista jo 1950-luvulta lähtien.18 Ne saavuttavat tämän tukahduttamalla vesikalvon tuotantoa.18 Systeemiset haittavaikutukset (kuten väsymys, ruoansulatuskanavan häiriöt ja parestesia) rajoittavat kuitenkin näiden lääkkeiden pitkäaikaista käyttöä glaukooman hoidossa.18 Suun kautta otettavia CAI:ita käytetään edelleen tapauksissa, joissa paikalliset CAI:t aiheuttavat yliherkkyyttä tai kun tippojen käyttö ei ole mahdollista, sekä akuuteissa kulmasulkeumatapauksissa.18 Yritykset kehittää paikallisia CAI:ita onnistuivat, kun 1990-luvun puolivälissä otettiin käyttöön dortsolamidi ja pian sen jälkeen brintsolamidi.19
Karboksyylianhydraasin (CA) isoentsyymejä on ainakin seitsemän erilaista, ja CA-II:llä on sädekehän prosesseissa pääasiallinen osuus vesituotannossa.18 Sekä dortsolamidi että brintsolamidi ovat tämän isoentsyymin voimakkaita estäjiä, mutta niillä on useita kliinisesti merkittäviä eroja. Esimerkiksi dortsolamidin pH on 5,6, kun taas brintsolamidin pH on 7,5. Lisäksi brintsolamidia on saatavana suspensiona. Nämä ovat vain joitakin ominaisuuksia, jotka voivat selittää valmisteiden yksilölliset haittavaikutukset, joihin voi kuulua kirvelyä dortsolamidin tapauksessa ja näön hämärtymistä brintsolamidin tapauksessa.19
Vaikka lääkeaineet on FDA:n mukaan merkitty annosteltavaksi TID-annosteluna, jotkut lääkärit valitsevat BID-annostelun. Brinsolamidin osalta vaiheen III tutkimuksissa raportoidaan kliinisesti samanarvoista silmänpaineen alenemista joko BID- tai TID-annostelulla.20 Toiset raportoivat, että dortsolamidin osalta BID- tai TID-annostelun välillä ei ole tilastollisesti merkitseviä eroja.18 Vaihtoehtoisesti toiset kannattavat TID-annostelua monoterapian yhteydessä ja BID-annostelua, kun sitä käytetään liitännäislääkkeenä.21
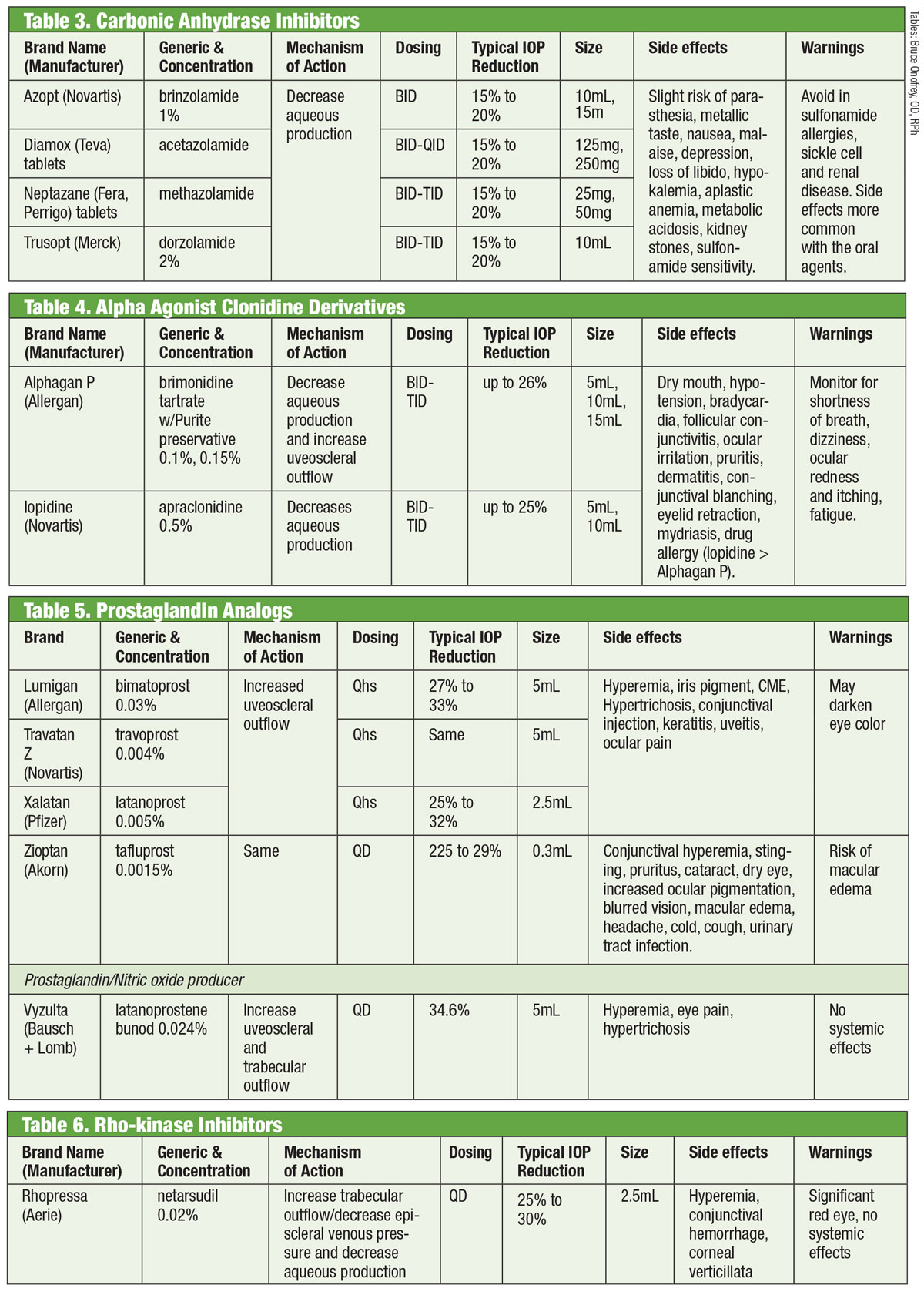 >
>
>Taulukot: Bruce Onofrey, OD, RPh. Klikkaa kuvaa suurentaaksesi.
Alfa-agonistit
Klonidiini edusti varhaisinta alfa-agonistia (AA), joka tehosi IOP:n alentamiseen. Se tuotti kuitenkin jo paikallisesti käytettynä syviä systeemisiä sivuvaikutuksia, kuten bradykardiaa, sedaatiota ja hypotensiota.22 Apraklonidiinin amidiryhmän korvaaminen vähensi veri-aivoesteen tunkeutumista ja siten sivuvaikutuksia. Valitettavasti sen tehon heikkeneminen ajan myötä ja silmäallergian lisääntynyt esiintyvyys rajoittavat sen käytön lyhytaikaiseen käyttöön.
Vuonna 1997 käyttöönotettu brimonidiini on voimakas AA, jolla on 32 kertaa suurempi selektiivisyys β2-adrenoreseptoreihin kuin apraklonidiinilla.22 Se alentaa silmänpaineen alenemista kaksoismekanismilla, jossa se vähentää vesikalvotuotantoa ja lisää uveoskleraalista ulosvirtausta.23 Edeltäjänsä tavoin sillä on huomattava allergiaprosentti (jopa 20 %), joka voi ilmetä kahdeksan kuukautta hoidon aloittamisen jälkeen.22 On kehitetty kolme formulaatiota, joilla kullakin on samanlainen teho: 0,2 % bentsalkoniumkloridilla (BAK) sekä 0,15 % ja 0,1 % Purite-säilöntäaineella.24 Allergan on sittemmin lopettanut BAK-säilöntäaineella varustetun formulaation käytön.
Suoraa kamaa
Lääkkeellinen marihuana on noussut isoon uutisotsikkoon viimeaikoina Yhdysvalloissa tapahtuneiden lakimuutosten ansiosta. Vaikka sitä on tutkittu 1970-luvulta lähtien IOP:n alentamismenetelmänä, tutkijat ovat havainneet sen kykenevän alentamaan IOP:ta vain lyhytaikaisesti. Tämä ja sen melko runsas sivuvaikutusprofiili tekevät siitä huonon hoitokohteen. Tutkimusten mukaan sillä voi kuitenkin olla merkitystä ”loppuvaiheen glaukoomapotilaille, joilla ei ole onnistunut maksimaalinen lääkehoito ja leikkaus tai jotka ovat huonoja leikkauskandidaatteja.”
Sun X, Xu C, Chadha N,et al. Marijuana for glaucoma: resepti katastrofiin vai hoitoon? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Vaikka haittavaikutukset korreloivat enimmäkseen prostaglandiinien käytön kanssa, kirjallisuudessa esiintyy brimonidiinin aiheuttamaa anteriorista uveiittia.25 Kesto vaihteli seitsemästä päivästä viiteen vuoteen keskiarvon ollessa lähes 20 kuukautta.
Prostaglandiinianalogit
Nämä vähentävät pisaroista voimakkaimmin silmänpaineen alenemista tehostamalla uveoskleraalista kammion ulosvirtausta. Prostaglandiinianalogit (PGA) sitoutuvat sädekehän reseptoreihin ja aiheuttavat sileän lihaksen relaksaatiota ja muuttavat solunulkoista matriksia sädekehän lihaksessa lisätäkseen kammion ulosvirtausta uveoskleraalisia reittejä pitkin.26 PGA-lääkkeet annostellaan kerran päivässä, yleensä nukkumaanmenoaikaan, ja ne alentavat silmänpaineen alenemista 30-35 prosenttia. Vaihtoehtoina ovat latanoprost, bimatoprost, travoprost ja tafluprost (säilöntäaineeton kerta-annosvaihtoehto).26 PGA-lääkkeiden yleisin haittavaikutus on sidekalvon hyperemia, joka ilmenee usein ensimmäisten viikkojen aikana hoidon aloittamisen jälkeen.26 Silmän ärsytystä, olemassa olevien tulehdustilojen pahenemista (makulaturvotus, iriitti), periorbitaalisen rasvapatjan surkastumista, silmänympärysihon, ripsien ja iiriksen pigmentoitumista sekä hypertrichoosia voi myös esiintyä.26
Uusi vaihtoehto prostaglandiinianalogien luokassa on latanoprostene bunod 0,024 %. Tällä yhdisteellä on kaksoismekanismi: se lisää uveoskleraalista ulosvirtausta ja tehostaa trabekulaariverkon ulosvirtausta typpioksidin vaikutuksesta.27 Silmä hajottaa latanoprostene bunodin kahteen kertaan, jolloin saadaan aktiiviset komponentit latanoprostihappo ja typpioksidi.28 28 Jälkimmäinen vaikuttaa signalointireittiin, joka rentouttaa TM:n supistumiskomponentteja, mikä lisää ulosvirtausta.28 Lisävaikutus laskee IOP:tä >1mm Hg verrattuna pelkkään latanoprostiin useiden aikapisteiden aikana, jolloin IOP:n kokonaislasku vaihteli 7,5mm Hg:stä 9,1mm Hg:iin. Latanoprosten bunodin haittavaikutukset olivat vertailukelpoisia pelkän latanoprostin haittavaikutuksiin verrattuna, ja tutkijoiden mukaan periokulaarinen pigmentaatio ja hypertrikoosi olivat mahdollisesti vähäisempiä.28,29
ROCKin estäjät
Normaalissa silmässä kammionesteen pääasiallinen poistumisreitti on TM. Tämän rakenteen läpi kulkevan kammionesteen vastus on lisääntynyt glaukoomapotilailla, mikä nostaa IOP:tä.30 Viime aikoihin asti glaukoomalääkkeet eivät ole kohdistuneet tähän rakenteeseen. Tämä muuttui vuonna 2017, kun markkinoille tuli Rhopressa (netarsudil 0,02 %, Aerie), joka on rho-kinaasin (ROCK) estäjä.
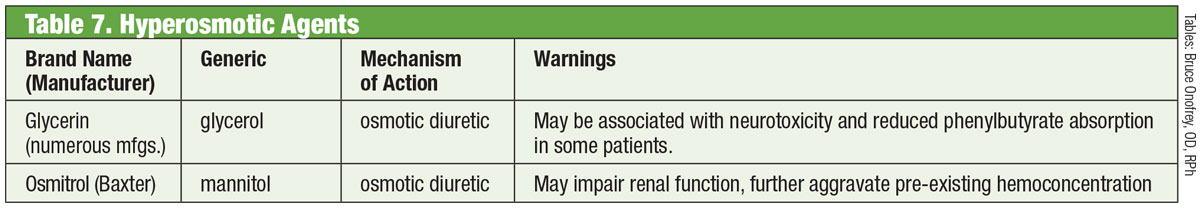
Taulukko: Bruce Onofrey, OD, RPh. Klikkaa kuvaa suurentaaksesi.
Rho-kinaasi ilmentyy laajalti monissa kudoksissa, myös TM:ssä, jossa se edistää aktiinijännityssäikeiden kokoamista ja säätelee solujen supistumista.31 ROCK:n estäjät lisäävät vesikalvon ulosvirtausta vähentämällä aktiini- ja myosiinivetoista solujen supistumista ja vähentämällä solunulkoisen matriksin proteiinien tuotantoa.32 Rhopressa vaikuttaa estävästi myös noradrenaliinin kuljettajaan (NET), mikä tekee siitä ROCK/NET-estäjän. NET-mekanismi voi olla seurausta noradrenaliinin aiheuttaman vasokonstriktion aiheuttamasta vähentyneestä verenkierrosta sädekehään, mikä johtaa vähentyneeseen vesikalvon tuotantoon.33 Lisäksi netarsudiili vähentää myös episkleraalista laskimopaineita (EVP), mikä tarjoaa useita väyliä silmänpaineen alentamiselle.32 Tavallisin silmäsairauden haittavaikutus on okulaarihyperemia (noin puolet hoidettavista potilaista), joka on suurimmaksi osaksi lievää, ohimenevää ja itsestään häviävää.32
Huomattakoon, että rho:lla itsellään on tärkeä rooli aksonien kasvussa ja ohjauksessa sekä hermosolujen eloonjäämisen ja kuoleman säätelyssä.34 Tutkijat havaitsivat, että näköhermon vaurioitumisen jälkeen netarsudiilin paikallinen anto vähentää verkkokalvon gangliosolujen kuolemaa ja edistää aksonien regeneroitumista.34
Sekoitetaan
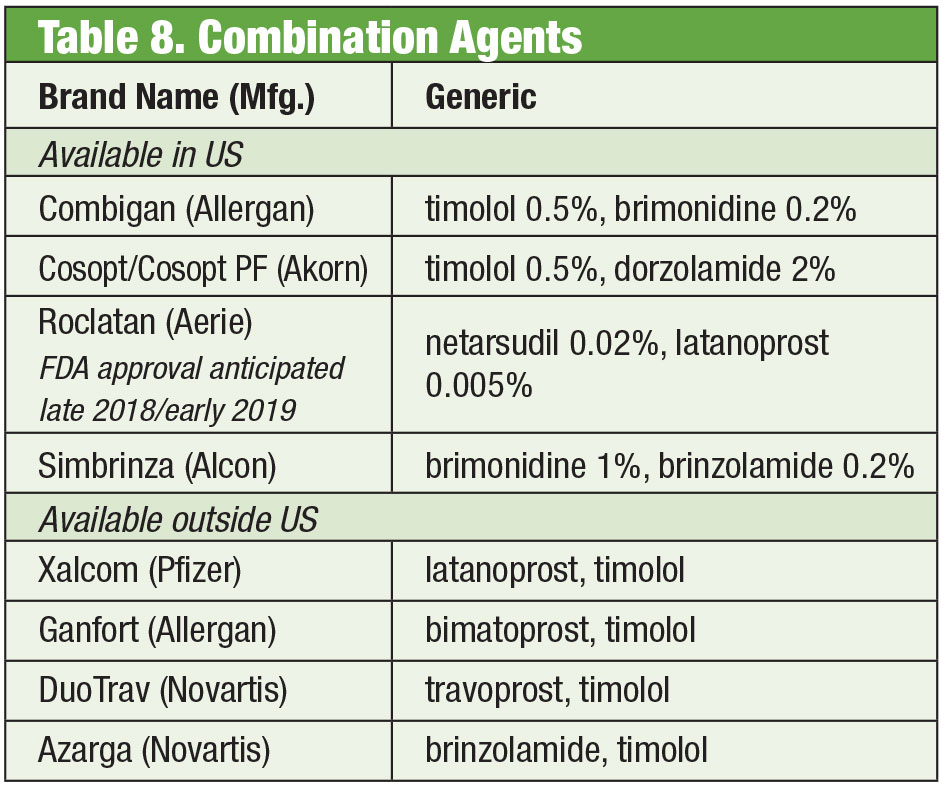
Joskus potilaat tarvitsevat muutakin kuin sen, mitä valmisvalmisteet tarjoavat. Potilaan herkkyys tai säilöntäaineiden kroonisesta käytöstä johtuva silmänpinnan toksisuus voi johtaa vaihtoehtojen etsimiseen. Joitakin yhdistelmälääkkeitä on saatavana ilman säilöntäaineita. Jos vaatimustenmukaisuus on ongelma, nämä seokset voivat sisältää jopa neljä lääkettä yhdessä pullossa. Lisäksi monia kiinteitä yhdistelmiä on käytetty tehokkaasti Yhdysvaltojen ulkopuolella, mutta FDA ei ole tällä hetkellä hyväksynyt niitä. Jos kustannukset ovat rajoittava tekijä, yhdistelmävalmistus voi olla lisäetu. Vaikka potilaan vakuutus ei useinkaan kata yhdistelmävalmistetta, yhden tai kahden yhdistelmävalmisteen hinta voi olla kustannustehokkaampi kuin useiden yksittäisten lääkevaihtoehtojen, jopa geneeristen valmisteiden, hinta. Kaksi yhdistelmäapteekkia tarjoaa useita valmiita variaatioita: Simple Drops Imprimis Pharmaceuticalsilta ja Omni-tuotesarja Ocular Science -yhtiöltä. Myös lisäräätälöinti on mahdollista kummassakin.
Vaikka yksittäiset aineet ovat FDA:n hyväksymiä, tietyt yhdistelmät eivät välttämättä ole. Lääkärin tehtävänä on punnita noudattamisen riskit ja hyödyt.
Glaukoomatuotteet:
Simple Drops (Imprimis Pharmaceuticals)
Kaikki saatavilla säilöntäaineeton.
– Tim-Lat PF (timololi/latanoprost)
– Brim-Dor PF (brimonidiini/dortsolamidi)
– Tim-Brim-Dor PF (timololi/brimonidiini/dortsolamidi)
– Tim-Dor-Lat PF (timololi/dortsolamidi/latanoprost)
– Tim-Dor-Lat PF (timololi/dortsolamidi/latanoprost)
– Tim-Brim-Dor PF (timololi/dortsolamidi/latanoprost).Brim-Dor-Lat PF (timololi/brintsolamidi/dortsolamidi/latanoprost)
– Dor-Tim (dortsolamidi/timololi)
– Dorzolamide PF
– Latanoprost PF
Omni Drops (Ocular Science)
Sisältää bentsalkoniumkloridia, mutta pienempinä pitoisuuksina (0.001 %) kuin tavallisissa geneerisissä valmisteissa (0,002 %).
– Timololi/latanoprost
– Timololi/brimonidiini/dortsolamidi (AM-valmiste)*
– Timololi/brimonidiini/dortsolamidi/latanoprost (PM-valmiste)*
* Tarkoitettu käytettäväksi yhdessä, AM-versiosta puuttuu prostaglandiini, jota annostellaan yleisesti vain kerran päivässä.
Kiinteät yhdistelmävalmisteet
Tämän yksittäisten valmisteiden tehosta huolimatta on tavallista, että monet glaukoomapotilaat tarvitsevat useita eri hoitomuotoja tilan hallitsemiseksi.35 Kun kaksoishoito on tarpeen, voi olla parasta tarjota samaa annostelulaitetta, mikä lisää hoitomyöntyvyyttä ja vähentää toksisuuden vaikutusta silmän pintaan.36 Timololi yhdistetään brimonidiiniin (Combigan, Allergan) ja dortsolamidiin (Cosopt, Akorn), jotka molemmat annostellaan kahdesti päivässä, ja timololi-dortsolamidivalmisteesta on saatavilla säilöntäaineeton vaihtoehto. Toinen kahdesti päivässä käytettävä yhdistelmä – Simbrinza – yhdistää brimonidiinin ja dortsolamidin. Kiinteiden yhdistelmien teho on hyvä sekä ensisijaisena hoitona että PGA-lääkkeiden lisänä. Sivuvaikutukset ovat verrattavissa yksittäisiin komponentteihin.
Hoitoon sitoutuminen/potilaan käsitys
Vaikka päätös suositella hoitoa voi olla monimutkainen ja riippuu monista tekijöistä, kun lääkäri ja potilas ovat sopineet hoidon aloittamisesta, tietyt taustatekijät on tunnustettava ja peruslähtökohtia on käytettävä.
Klikkaa kuvaa suurentaaksesi.
Näkökentän eteneminen ja taudin vaikeusaste ovat yhteydessä huonoon hoitoon sitoutumiseen.37 Kroonisia sairauksia sairastavat potilaat käyttävät erään tutkimuksen mukaan keskimäärin 30-70 prosenttia heille määrätyistä lääkeannoksista, ja 50 prosenttia heistä lopettaa lääkityksensä ensimmäisten hoitokuukausien aikana.38 Glaukoomalääkkeiden noudattaminen on yhtä huonoa kuin muiden kroonisten sairauksien.38 Näin ollen voi olla olemassa tehokkuus-vaikuttavuus-kuilu, jossa, vaikka paikallisesti käytettävien lääkkeiden tehokkuus on osoitettu laajoissa kliinisissä tutkimuksissa, ne voivat olla käytännössä tehottomia, koska potilaat eivät noudata sääntöjä.39
Glaukooman huonoon hoitoon sitoutumiseen vaikuttavat muun muassa seuraavat tekijät: lääkkeiden sivuvaikutusprofiili, hoidon kustannukset, potilaan koulutus ja lääkärin ja potilaan välinen suhde40. Lisäksi tauti voi olla oireeton vasta myöhäisessä vaiheessa, jolloin näkökentän heikkenemisestä ei olla tietoisia.41
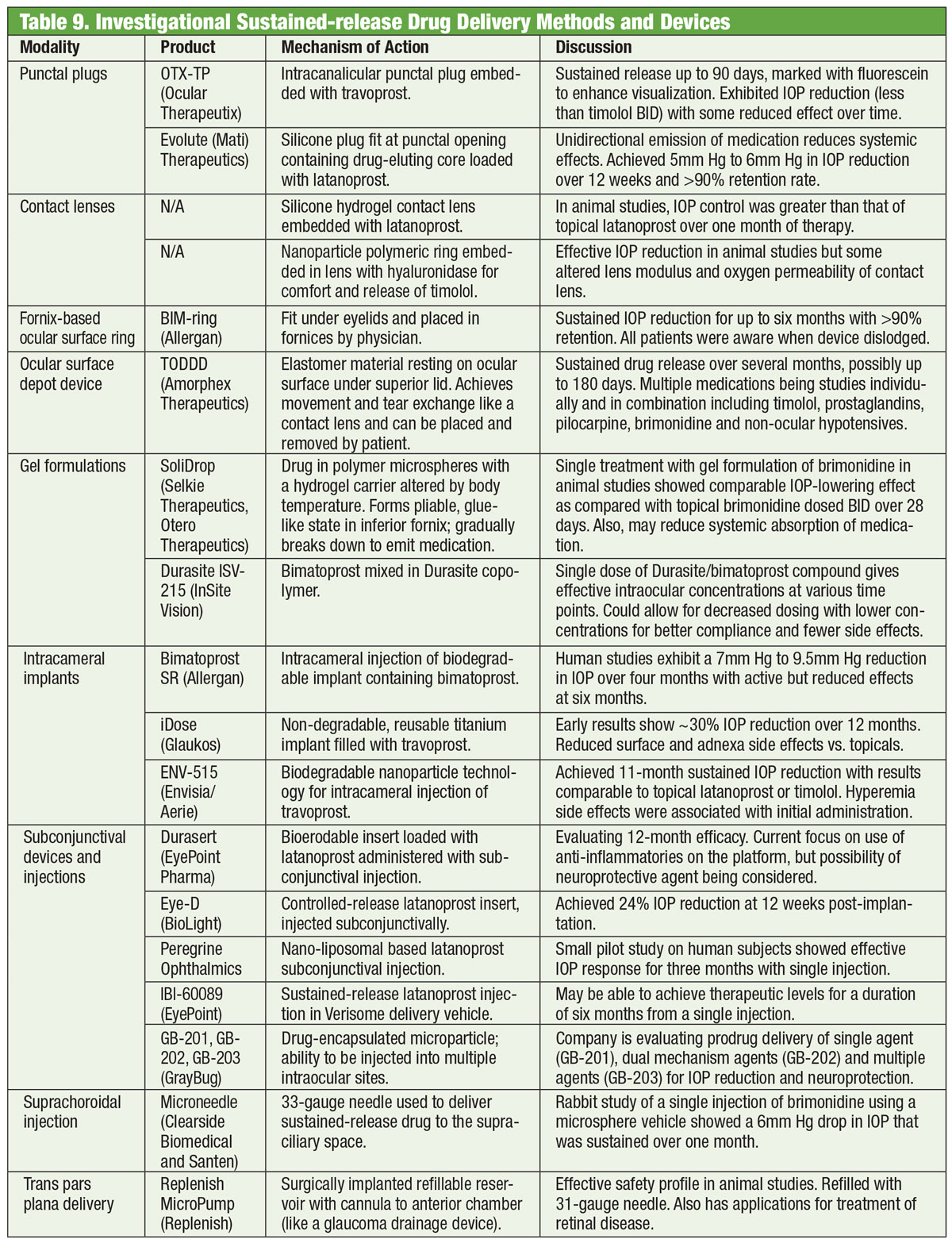
And Now For Something Completely Different
Lääkkeet ovat olleet glaukooman hoidon selkäranka jo reilusti yli vuosisadan ajan, ja uusien lääkkeiden kehittäminen jatkuu kiihtymättä. Jotkut tutkijat etsivät kuitenkin vaihtoehtoja pullon ulkopuolelta. Sähkömagneettisella kelalla varustetut silmälasit yhdistettynä kultaa sisältävään piilolinssiin voivat jonain päivänä auttaa alentamaan silmänpaineen alenemista. Bionode-nimisen yrityksen kehittämä yhdistelmä on suunniteltu tuottamaan sähkövirta, joka virtaa sädekehän lihasten läpi stimuloiden luonnollista tyhjennysreittiä ja alentaen silmänpainetta.
American Academy of Ophthalmology. Silmälasit voivat jonain päivänä hoitaa glaukoomaa. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Accessed July 3, 2018.
Ylimääräinen este noudattamiselle on vaikeus tippojen tiputtamisessa ja annostelusuunnitelmassa.42 Itse asiassa jopa 80 % potilaista kontaminoi tippansa koskettamalla kasvojaan, jopa 61 % ei tiputa täsmälleen yhtä tippaa, ja mikä kriittisintä, jopa 37 %:lla tippa menee ohi silmästä.43 Hoitohenkilökunnan ei koskaan pidä olettaa, että potilas hallitsee tippojen tiputtamisen. Ennen tippahoidon aloittamista potilas on opetettava, miten tippoja tiputetaan asianmukaisesti, ja hänen on näytettävä tippojen tiputtamisen onnistuminen ennen vastaanotolta poistumista. Tämä voidaan siirtää tehokkaasti optometriselle teknikolle, ja sitä voidaan vahvistaa tekniikkaa koskevalla opetusmateriaalilla (tulostettava PDF-tiedosto osoitteessa www.glaucoma.org/treatment/eyedrop-tips.php) sekä käyttämällä videoita, kuten Glaucoma Research Foundationin tuottamaa videota (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Jos potilaalla on huomattavia vaikeuksia silmätippojen tiputtamisessa, mekaaninen annostelun apuväline voi parantaa onnistumisen todennäköisyyttä. Oikean annosteluohjelman noudattaminen paranee, kun käytetään automaattisia televiestintään perustuvia muistutuksia sekä älypuhelimiin ja tabletteihin perustuvia muistutussovelluksia.44,45 Annosteluohjelman noudattamisen parantamiseksi olisi käytettävä vastaanotolla annettavan koulutuksen, tavoitteiden asettamisen, yksinkertaistetun tippaohjelman ja teknologian yhdistelmää.46 Lääkehoidon noudattamisen tunnettujen esteiden poistaminen on välttämätön ensimmäinen askel kohti menestystä.
Paineen alentaminen
IOP on ainoa tunnettu muokattavissa oleva glaukoomariskitekijä, ja sen alentaminen on kiistatta osoittanut vähentävän taudin etenemisen riskiä.47,48 IOP:n tehokkaasta alentamisesta tulee siten tavoite glaukoomapotilaiden hoidossa. Kun tauti on luokiteltu tarkasti, asetetaan yleensä hoitotavoite. Yhdysvalloissa suosittujen käytäntöjen mukaan käytetään sellaista IOP:n tavoitealuetta, jonka kliinikko uskoo vähentävän potilaiden elinikäistä sokeutumisriskiä ja samalla minimoivan hoitoon liittyvän taakan.49-52
Vaikka useita menetelmiä voidaan käyttää apuna alkuperäisen IOP:n tavoitearvon määrittämisessä (kynnysarvo IOP, laskettu IOP:n taso, yhden koon määrittäminen), yksinkertaisin ja näyttöön perustuvin menetelmä on alentaa IOP:ta prosenttimäärän verran siitä vuorokausittaisesta huippu-iOP:stä, jonka kohdalla näköhermon vaurio on syntymässä. Silmänpaine on dynaaminen ja vaihtelee lyhyellä ja pitkällä aikavälillä, minkä vuoksi nykyisin käytettävissä oleva tonometria ei ole täysin toistettavissa. Tämän vuoksi on suositeltavaa, että lääkäri hankkii useita IOP-lukemia eri vuorokaudenaikoina ennen hoidon aloittamista, jotta voidaan yrittää määrittää vuorokausittainen IOP-huippu, jonka perusteella tavoitealue määritetään.53-55 On kuitenkin epätodennäköistä, että todellista huippua saadaan koskaan selville, ellei useita 24 tunnin IOP-käyriä hankita. Lääkärin on viime kädessä arvioitava hoidon onnistumista vähentämällä etenemisnopeutta rakenteellisissa ja toiminnallisissa testeissä.48,56,57
Suositellut IOP:n prosentuaaliset tavoitevähennykset vaihtelevat 20 prosentista 50 prosenttiin tilasta riippuen (esim, glaukoomaepäily, okulaarinen hypertensio, normaalijännitysglaukooma, korkeajännitysglaukooma, kulman sulkeutumisglaukooma) taudin lähtötilanteen vaikeusasteesta ja elinajanodotteesta.58-61
Taulukko: Bruce Onofrey, OD, RPh. Klikkaa kuvaa suurentaaksesi.
Aloittaminen
PGA-lääkkeet on hyväksytty ensilinjan hoitoon Yhdysvalloissa, ja ne alentavat tehokkaammin silmänpaineen alenemista, niiden sivuvaikutusprofiili on suhteellisen rajallinen, ja niitä annostellaan harvemmin (kerran vuorokaudessa) kuin muita lääkitysluokkia.62,63
Kun tietty aine on valittu, potilas tulisi tavata uudelleen viimeistään neljän viikon kuluttua, jotta voidaan arvioida tiputuksen tehoa, ehkäistä mahdollisia haittavaikutuksia, varmistaa potilaan sitoutuminen ja vahvistaa hoidon arvoa.
Yhteenvetona voidaan todeta, että asianmukainen koulutus ja valpas seuranta sekä rakenteelliset ja toiminnalliset testit auttavat minimoimaan näön menetyksen.
Tohtori Dorkowski on SCO:n hoitokodin/avusteisen asumisen ohjelman kliininen koordinaattori.
Tohtori Williamson on Memphisin VA Medical Centerin residenssivalvoja.
Tohtori Rixon on Memphisin veteraaniklinikan ylilääkäri ja Optometric Glaucoma Societyn jäsen.
Tohtori Onofrey on The Ocular Therapeutics Handbook -kirjan kirjoittaja.
1. Zimmerman TJ, William P. BogerIII. Beeta-adrenergiset salpaajat ja glaukooman hoito. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. A history of glaucoma pharmacology. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Muskariinilääkkeiden suorat vaikutukset ihmisen silmän ulosvirtausreitteihin. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. Adrenergisten lääkkeiden vaikutusmekanismi glaukoomassa. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyyli-epinefriini: uusi pro-lääke glaukooman hoidossa. Ophthalmology. 1978;85(3):268-75.
7. Neufeld AH. Kokeelliset tutkimukset timololin vaikutusmekanismista. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. Timololin mekanismi silmänsisäisen paineen alentamisessa: Normaalissa silmässä. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Beeta-adrenergiset reseptorit pigmentoituneissa sädekehän prosesseissa. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Beeta-adrenergisten reseptoreiden jakautuminen ja ominaisuudet ihmisen iiris-ciliaarielimistössä. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. Kaksoisvertailu betaksololin ja timololin välillä avokulmaglaukooman hoidossa. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Silmän beetasalpaajat timololista lähtien. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Timololin arviointi kroonisessa avokulmaglaukoomassa: Kerran päivässä vs. kahdesti päivässä. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Timololin, adrenaliinin ja asetatsolamidin vaikutukset kammiovirtaukseen unen aikana. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Sirkadiaaninen silmänpaineen vaihtelu beetasalpaajilla. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Systeemisen beetasalpaajahoidon vaikutukset paikallisen brimonidiinin ja timololin tehoon ja turvallisuuteen. Brimonidiinitutkimusryhmät 1 ja 2. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaukooma ja systeemisairaudet. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Paikallisten hiilihappoanhydraasin estäjien farmakologiset ja silmänpainetta alentavat ominaisuudet. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Paikallinen lääkeaineen annostelu silmään: dortsolamidi. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamide ophthalmic suspension: katsaus sen farmakologiaan ja käyttöön avokulmaglaukooman ja silmän hypertension hoidossa. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Comparison of the additive intraocular pressure-lowing effect of latanoprost and dorzolamide when added to timolol in patients with open-angle glaucoma or ocular hypertension: a randomized, open-label, multicenter study in Greece. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Brimonidiiniallergian esiintyvyys potilailla, jotka ovat aiemmin olleet allergisia apraklonidiinille. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Brimonidiinin tehokkuus ja turvallisuus lisähoitona potilaille, joilla on kohonnut silmänpaine, laajassa, avoimessa yhteisöllisessä tutkimuksessa. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidiinipuriitti 0,1 % vs. brimonidiinipuriitti 0,15 % kahdesti päivässä glaukoomassa tai silmän hypertensiossa: 12 kuukauden satunnaistettu tutkimus. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidiinin aiheuttama anteriorinen uveiitti. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Päivitys paikallisesti käytettävien prostaglandiinien vaikutusmekanismista silmänsisäisen paineen alentamiseksi. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Latanoprostene bunod 0,024 %:n tehokkuus verrattuna timololiin 0,5 %:iin silmänsisäisen paineen alentamisessa 24 tunnin aikana. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprostene bunod ophthalmic solution 0,024 % IOP:n alentamiseen glaukoomassa ja silmän hypertensiossa. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Latanoprostene bunod 0,024 %:n ja timololimaleaatin 0,5 %:n vertailu avokulmaglaukoomassa tai silmän hypertensiossa: LUNAR-tutkimus. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. Trabekulaarinen silmäverkko: Peruskatsaus muotoon ja toimintaan. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Accessed June 29, 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. ROCK-estäjän netarsudiilin löytäminen avokulmaglaukooman hoitoon. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Kaksi vaiheen 3 kliinistä tutkimusta, joissa verrataan netarsudiilin turvallisuutta ja tehoa timololiin potilailla, joilla on kohonnut silmänpaine: rho kinase elevated iop treatment trial 1 ja 2 (ROCKET-1 ja ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. netarsudiilin, uuden silmänpainetta alentavan aineen löytäminen ja prekliininen kehittäminen glaukooman hoitoon. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. Rock/net-estäjän paikallinen anto edistää verkkokalvon gangliosolujen selviytymistä ja aksonien uudistumista näköhermon vaurion jälkeen. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Prostaglandiinianalogeja käyttävien glaukoomapotilaiden liitännäishoitomallit. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Kiinteät yhdistelmät. Glaucoma Today. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. Korreloivatko hoitomyöntyvyys ja glaukomatoottisen näkökentän eteneminen? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Using pharmacy claims data to study adherence to glaucoma medications: methodology and findings of the Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, ym. silmänpainetta alentavan lääkityksen tehokkuus määritettynä huuhtoutumalla. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Why do people (still) go blind from glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. Näkemys glaukoomasta – Näemmekö sen selvästi? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. The most common barriers to glaucoma medication adherence: A cross-sectional survey. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Pisaroiden instillaatio ja glaukooma. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automated telecommunication-based reminders and adherence with once-daily glaucoma medication dosing: The automated dosing reminder study. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: Potilaiden ja heidän hoitajiensa kiinnostus älypuhelin- ja tablettipohjaista glaukoomasovellusta kohtaan. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Glaukooman lääkehoitoon sitoutumiseen liittyvät ominaisuudet ja sen vaikutukset glaukooman hoitotuloksiin: Näyttöön perustuva katsaus ja mahdolliset strategiat sitoutumisen parantamiseksi. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. Uusia näkökulmia silmänsisäiseen tavoitepaineeseen. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Silmänsisäisen paineen personointi: Tavoitesilmänpaine 24 tunnin silmänpaineen seurannan yhteydessä. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Tavoitepaine glaukooman hoidossa. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Avokulmaglaukoomapotilaan hoito. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Varhainen aggressiivinen silmänpaineen alentaminen, tavoitesilmänpaine ja uusi käsite glaukooman hoidossa. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Vuorokausittaiset silmänpaineen mallit eivät ole toistettavissa lyhyellä aikavälillä terveillä henkilöillä. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Long-term reproducibility of diurnal intraocular pressure patterns in patients with glaucoma. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Silmänsisäisen paineen päivittäinen vaihtelu glaukoomassa ja silmän hypertensiossa. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Kliininen hyöty silmänpaineen seurannasta normaalin virka-ajan ulkopuolella glaukoomapotilailla. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: satunnaistettu tutkimus määrittää, että paikallinen silmänpainetta alentava lääkitys viivästyttää tai ehkäisee primaarisen avokulmaglaukooman puhkeamista. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Intraokulaarisen paineen alentaminen ja glaukooman eteneminen: Results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. Pitkälle edennyttä glaukoomaa koskeva interventiotutkimus (AGIS): The relationship between control of intraocular pressure and visual field deterioration. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Visual field progression in the collaborative initial glaucoma treatment study. Hoidon ja muiden lähtötekijöiden vaikutus. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost glaukooman hoidossa. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Geneerisen latanoprostin käyttöönoton vaikutus glaukooman lääkityksen noudattamiseen. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. A randomised, controlled comparison of latanoprostene bunod and latanoprost 0.005% in the treatment of ocular hypertension and open angle glaucoma: VOYAGER-tutkimus. Br J Ophthalmol. 2015;99(6):738-45.