Lipofiliteetti on mahdollisesti potentiaalisen lääkeaineen tärkein fysikaalis-kemiallinen ominaisuus, sillä se vaikuttaa liukoisuuteen, imeytymiseen, kalvopenetraatioon, plasmaproteiinien sitoutumiseen, jakautumiseen, keskushermostoon tunkeutumiseen ja jakautumiseen muihin kudoksiin tai elimiin, kuten maksaan, ja sillä on vaikutusta puhdistumisreitteihin. Sillä on merkitystä ligandin tunnistamisessa, ei ainoastaan kohdeproteiiniin, vaan myös CYP450-interaktioissa, HERG-sitoutumisessa ja PXR-välitteisessä entsyymi-induktiossa.
LogP on osa Lipinskin 5-sääntöä, joka on nyrkkisääntö liukoisuuden ja läpäisevyyden ennustamiseksi ja josta on tullut lääkeaineen sopivuuden korvike.
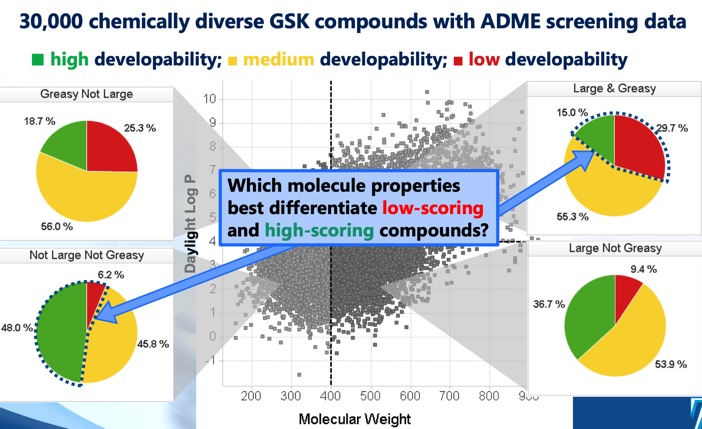
Kehitettävyyspisteytys DOI tunnistaa neljä erillistä cLog P/molekyylipainon aluetta, jotka määrittelevät optimaalisen ja suboptimaalisen kemiallisen tilan, sekä kehitettävyyspisteytyksen, joka on johdettu regressiomalleista, joissa on käytetty liukoisuutta, läpäisevyyttä, proteiiniin sitoutumista ja 3A4:n inhibitiota koskevia seulontatietoja. Vaikka MWt <400, cLogP <4 -sektori viittaa suurimpiin menestymisen mahdollisuuksiin, todettiin, että myös MWt >400, cLogP >4 -sektori sisälsi joitakin kehityskelpoisia molekyylejä, vaikkakin paljon pienemmillä menestymisen mahdollisuuksilla.
Yleisimmin käytetyin lipofiilisyyden mittari on LogP, joka on molekyylin jakautumiskerroin vesipitoisen ja lipofiilisen faasien, tavallisesti oktanolin ja veden, välillä.
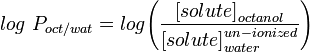
LogP:n mittaaminen voidaan tehdä monella eri tavalla, joista yleisin on ravistelupullomenetelmä, jossa osa kyseisestä liuenneesta aineesta liuotetaan tilavuuteen oktanolia ja vettä, ravistellaan jonkin aikaa ja mitataan sitten liuenneen aineen pitoisuus kussakin liuottimessa. Tämä voi olla aikaa vievää, varsinkin jos ei ole olemassa nopeaa spektroskooppista menetelmää molekyylin pitoisuuden mittaamiseksi faaseissa. Nopeammassa log P -määritysmenetelmässä käytetään korkean suorituskyvyn nestekromatografiaa. Liuenneen aineen log P voidaan määrittää korreloimalla sen retentioaika samankaltaisten yhdisteiden kanssa, joilla on tunnettu log P-arvo doi.
Lipofilian laskeminen
Tavallisesti ei ole käytännöllistä määrittää kokeellisesti jokaisen valmistetun yhdisteen log P:tä (ja log P:n laskeminen ennen synteesin aloittamista voi olla kiinnostavaa), joten käytetään laskettuja tuloksia, joita varten on saatavana useita ohjelmistotyökaluja sekä työpöytä- että verkkokäyttöön (älä käytä luottamuksellisille yhdisteille).
Monet näistä sovelluksista toimivat käyttämällä suurta koulutustietoaineistoa tunnetuista arvoista fragmenttien osuuksien määrittämiseksi alarakenteille ja funktionaalisille ryhmille, mutta logP ei kuitenkaan ole yksinkertainen additiivinen ominaisuus, vaan tarvitaan korjaustermit läheisyysvaikutusten, H-sidosten, elektronisten vaikutusten jne. huomioon ottamiseksi, kuten alla olevissa esimerkeissä on esitetty.
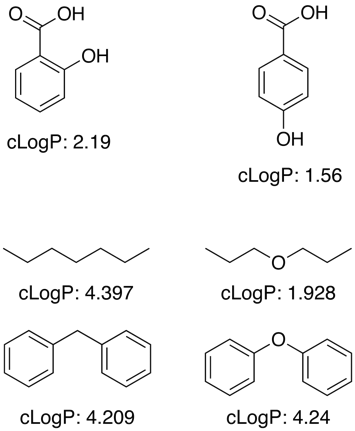
Tuntemattomien funktionaalisten ryhmien kohdalla ohjelmat tekevät usein approksimaation yksittäisten atomien osuuksien avulla.
Erilaiset logP:n laskentamenetelmät voidaan jakaa kolmeen eri lähestymistapaan.
Atomiset (esim. ”AlogP”, ) & Enhanced Atomic / Hybrid (”XlogP”, ”SlogP”)
Fragmenttimenetelmät (”ClogP”, KlogP, ACD/logP)
Ominaisuuksiin perustuvat menetelmät (”MlogP”, ”VlogP”, ”MClogP”, ”TlogP”)
Atomaarisessa logP:ssä otetaan huomioon, että jokaisella atomilla on panos logP:hen ja että panokset loppuarvoon ovat puhtaasti additiivisia. On kuitenkin selvää, että typpi amidissa on erilainen kuin typpi amiinissa tai pyridiinissä, Enhanced Atomic ottaa huomioon atomin tyypin.
Fragmenttimenetelmissä käytetään suurta harjoitusdataa, jossa on tunnettuja arvoja fragmenttien kontribuutioiden määrittämiseksi alarakenteille ja funktionaalisille ryhmille, sekä korjaustermiä läheisyysvaikutusten huomioon ottamiseksi. Nämä menetelmät turvautuvat usein atomimalleihin uusien funktionaalisten ryhmien osalta.
Ominaisuuksiin perustuvilla menetelmillä on taipumus olla laskennallisesti vaativia, eivätkä ne oikein sovellu suurten tietokokonaisuuksien testaamiseen.
Koska harjoitusjoukot ja algoritmit vaihtelevat eri sovellusten välillä, on erittäin tärkeää, ettei eri työkaluilla laskettuja tuloksia yhdistetä.
Joidenkin työkalujen avulla käyttäjä voi laajentaa harjoitusjoukkoa käyttämällä talon sisäisesti mitattuja arvoja, mikä voi olla kriittistä, kun tutkitaan uusia funktionaalisia ryhmiä tai telineitä.
LogD
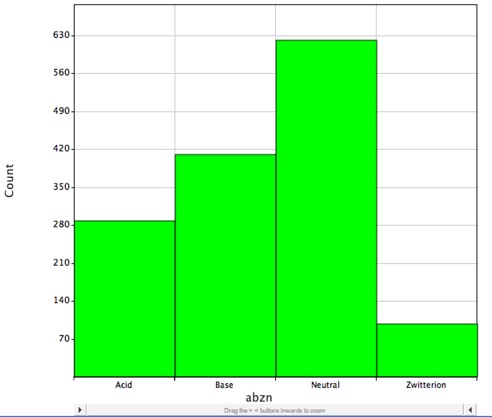
Vaikka suurin osa tunnetuista lääkeaineista sisältää ionisoituvia ryhmiä, kuten alla olevasta histogrammista käy ilmi, tämä osoittaa pienten molekyylien lääkeainejakauman DrugBankin avulla, ja ne ovat todennäköisesti varautuneita fysiologisessa pH-arvossa, ja LogP kuvaa oikein vain neutraalien (varauksettomien) molekyylien jakaantumiskerrointa.
Jakaantumisvakio LogD kuvaa paremmin molekyylin lipofiliaa. Se voidaan määrittää samalla tavalla kuin LogP, mutta veden sijasta vesifaasi säädetään tiettyyn pH-arvoon puskurilla. Log D on siis pH-riippuvainen, joten on määritettävä pH, jossa log D mitattiin. Erityisen kiinnostava on log D pH:ssa = 7,4 (veriseerumin fysiologinen pH).
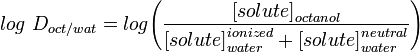
Marvinin kaltaiset sovellukset antavat käyttäjälle mahdollisuuden laskea log D:n, mutta myös näyttää pH-jakaumaprofiilin, kuten alla on esitetty varfariinin osalta.
Yhdisteiden, joiden pKa on lähellä fysiologista pH:ta, kohdalla voi olla kriittisen tärkeää miettiä, mikä voisi olla todellisuudessa pääasiallinen ionisoitunut muoto.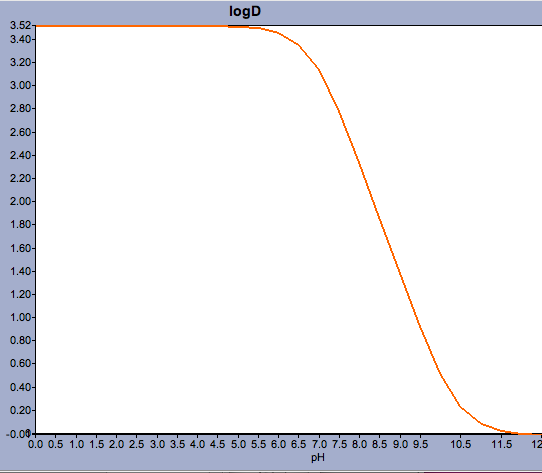
Tämä voi olla arvokasta myös pohdittaessa imeytymistä ruuansulatuskanavan eri alueilta, joissa pH vaihtelee 1-3:sta mahalaukussa 7-8:aan ileumissa.
Erilaisen funktionaalisten ryhmien osuutta LogD:hen on tutkittu ”LogD contributions of substituents commonly used in medicinal chemistry” DOI, tässä tutkimuksessa käytettiin useiden tuhansien yhdisteiden kokeellisista LogD-arvoista, jotka kerättiin ravistelupullomenetelmällä pH:n ollessa = 7,4:n kohdalla tehtyjen kokeellisten logD-arvojen sovitettujen molekyylien analyysiä. He raportoivat keskimääräisen deltaLogD-eron tietyille molekyylipareille, ja tulokset on esitetty jäljempänä tapauksessa, jossa funktionaalinen ryhmä on missä tahansa paikassa fenyylirenkaassa. Olen myös liittänyt mukaan Chemaxon-ohjelmistolla lasketun LogD:n.
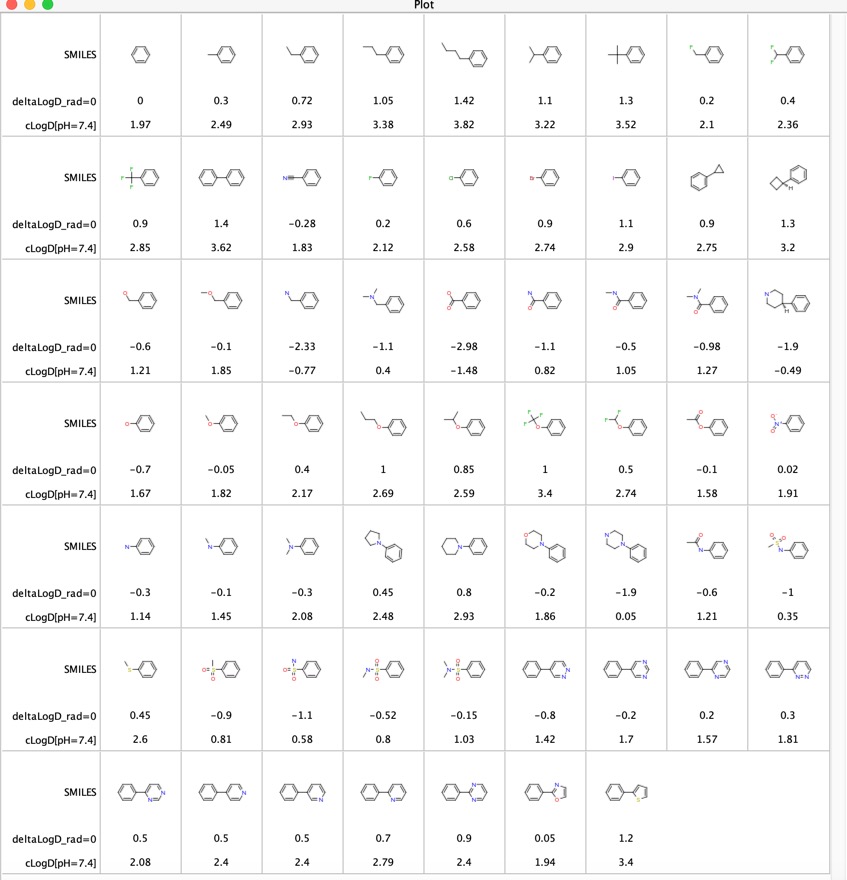
Tämä on hyödyllinen taulukko funktionaalisten ryhmien vertailuun, erityisesti 11 viimeisessä merkinnässä verrataan eri heterosyklien vaikutusta LogD:hen. Näitä heterosyklejä käytetään usein fenyylirenkaan bioisosterisina korvaajina.
Ajattelin, että voisi olla mielenkiintoista verrata sovitettujen molekyyliparien avulla määritettyjä LogD-eroja (deltaLogD_rad=0) Chemaxonin lasketun LogD:n avulla määritettyihin arvoihin (deltacLogD). Kuten alla näkyy, vastaavuus on melko hyvä.
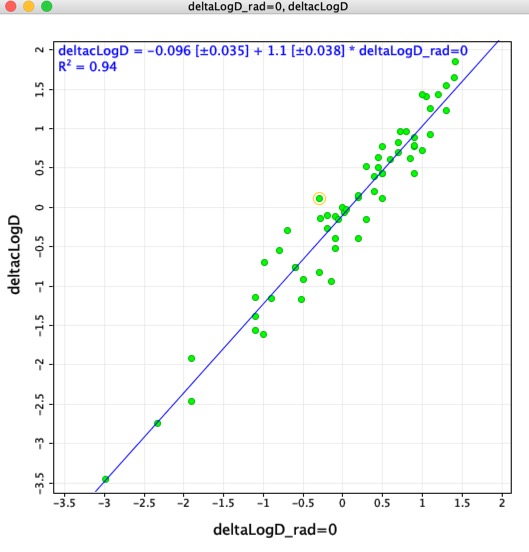
Muistakaa Koska harjoitusjoukot ja algoritmit vaihtelevat sovellusten välillä, on erittäin tärkeää, ettei eri työkaluilla laskettuja tuloksia yhdistetä.
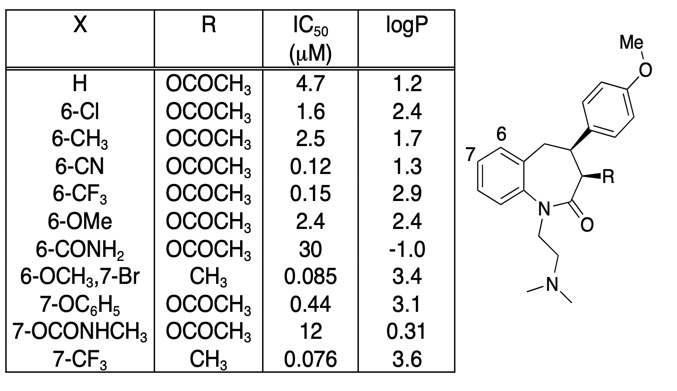
On tärkeää olla varovainen sen suhteen, että sitoutumisaffiniteetin paraneminen ei johdu täysin LogD:n kasvusta, usein on hyödyllistä yksinkertaisesti piirtää sitoutumisaffiniteetti suhteessa LogD:hen. Mielenkiintoisemmat yhdisteen modifikaatiot eivät välttämättä ole niitä, jotka lisäävät affiniteettia eniten, vaan ne voivat olla sellaisia, jotka lisäävät affiniteettia ilman vastaavaa lipofilian lisääntymistä. Kun tarkastellaan alla olevaa taulukkoa, siinä on useita erittäin suuren affiniteetin omaavia yhdisteitä.
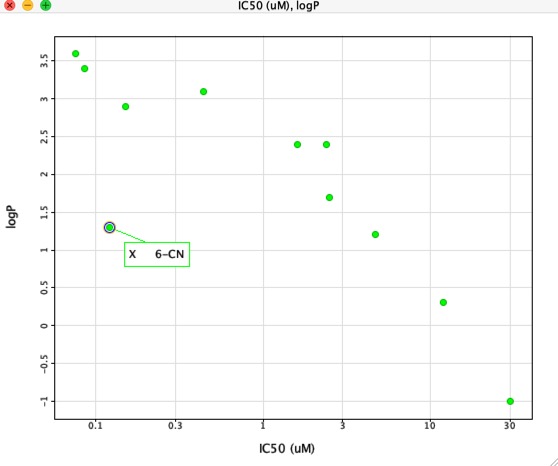
Jos kuitenkin piirretään IC50:n ja LogP:n välinen kuvaaja, kuten alla on esitetty, LogP:n ja IC50:n välillä on hyvin selvä korrelaatio, mutta yksi yhdiste poikkeaa siitä selvästi. Substituentti 6-CN lisää affiniteettia ilman vastaavaa LogP:n kasvua.
Lipofilisuus on myös tärkeä osatekijä monilla kohteen ulkopuolisilla vastuilla, kuten plasmaproteiinien (erityisesti albumiinin) sitoutumisella, HERG:llä, CYP:n vuorovaikutuksilla ja transportaattoreilla, on vahva korrelaatio lipofilian kanssa, ja useissa tutkimuksissa on todettu, että korkea logP on yhteydessä siihen, että yhdisteiden kehitystyössä epäonnistutaan todennäköisesti huonojen ADMET-ominaisuuksien (imeytymis-, jakaantumis-, aineenvaihdunta-, erittymiskykyyn liittyvät ominaisuudet ja toksisuusominaisuudet) vuoksi. Sitä vastoin on usein selvää, että kohtuullisen affiniteettitason saavuttaminen edellyttää tiettyä kokoa ja lipofiliaa. Näiden vaatimusten tasapainottaminen on keskeinen haaste lääkekehityksessä, ja kemianteoreille ehdotetaan, että he pyrkivät löytämään makean pisteen, joka on MWt 250-500 ja LogP 2-4. Yksi tämän lähestymistavan seuraus on tarve asettaa seulonnassa etusijalle pienimolekyylipainoiset ja vähemmän lipofiiliset yhdisteet. Lääkekemian tulisi aluksi keskittyä hyvälaatuisten lähtökohtien valintaan ja sen jälkeen fysikaalis-kemiallisten ominaisuuksien siirtymien tehokkaaseen hallintaan optimointiprosessin aikana.
Lukemisen arvoinen
Finding the sweet spot: the role of nature and nurture in medicinal chemistry DOI
Lipofiilinen tehokkuus: lääkekemian tärkein tehokkuusmetriikka DOI
Viimeisin päivitetty 12.1.2019