Ensyymien rakenteellinen epävakaus
Se, että aktiiviset paikat soveltuvat niin hyvin tiettyjen ympäristöolosuhteiden tarjoamiseen, tarkoittaa myös sitä, että paikallinen ympäristö voi vaikuttaa niihin. On totta, että ympäristön lämpötilan nostaminen lisää yleensä reaktionopeuksia, niin entsyymikatalysoituja kuin muitakin. Lämpötilan nostaminen tai laskeminen optimaalisen alueen ulkopuolelle voi kuitenkin vaikuttaa aktiivisen alueen kemiallisiin sidoksiin siten, että ne soveltuvat huonommin substraattien sitomiseen. Korkeat lämpötilat aiheuttavat lopulta entsyymien, kuten muidenkin biologisten molekyylien, denaturoitumisen, mikä on prosessi, joka muuttaa aineen luonnollisia ominaisuuksia. Samoin paikallisen ympäristön pH voi vaikuttaa entsyymien toimintaan. Aktiivisen alueen aminohappojäännöksillä on omat happamat tai emäksiset ominaisuutensa, jotka ovat katalyysin kannalta optimaaliset. Nämä jäännökset ovat herkkiä pH:n muutoksille, jotka voivat heikentää substraattimolekyylien sitoutumista. Entsyymit soveltuvat toimimaan parhaiten tietyllä pH-alueella, ja kuten lämpötilan kohdalla, ympäristön äärimmäiset pH-arvot (happamat tai emäksiset) voivat aiheuttaa entsyymien denaturoitumista.
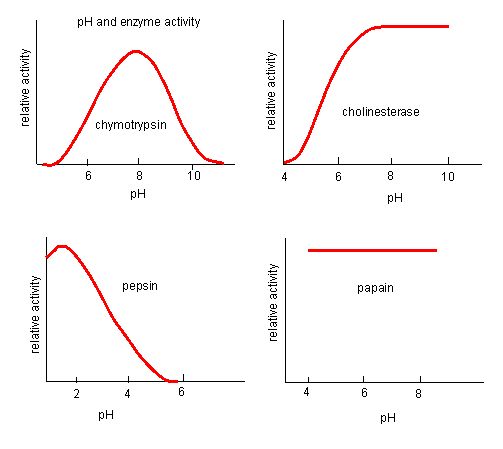
Kuva 4. Entsyymeillä on optimaalinen pH. pH, jossa entsyymi on aktiivisin, on pH, jossa aktiivisen alueen R-ryhmät ovat protonoituneet/deprotonoituneet siten, että substraatti pääsee aktiiviseen kohtaan ja reaktion alkuvaihe voi alkaa. Jotkin entsyymit vaativat hyvin alhaisen (happaman) pH:n ollakseen täysin aktiivisia. Ihmiskehossa nämä entsyymit sijaitsevat todennäköisimmin alavatsassa tai sijaitsevat lysosomeissa (soluelinkeino, jota käytetään suurten yhdisteiden pilkkomiseen solun sisällä).
Lähde: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Prosessi, jossa entsyymit denaturoituvat, alkaa yleensä tertiäärirakenteen purkautumisella tertiäärirakennetta koossa pitävien sidosten epävakautumisen kautta. Vetysidokset, ionisidokset ja kovalenttiset sidokset (disulfidisillat ja peptidisidokset) voivat kaikki häiriintyä lämpötilan ja pH:n suurissa muutoksissa. Tee alla olevan entsyymiaktiivisuutta ja lämpötilaa koskevan kaavion avulla energiatarina punaiselle entsyymille. Selitä, mitä saattaa tapahtua 37 °C:sta 95 °C:een.
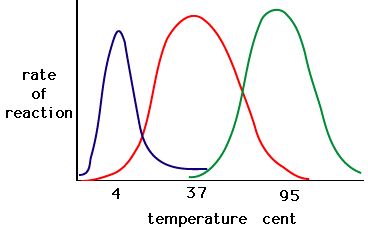
Kuva 5. Entsyymeillä on optimaalinen lämpötila. Lämpötila, jossa entsyymi on aktiivisin, on yleensä lämpötila, jossa entsyymin rakenne on vakaa tai ehjä. Jotkin entsyymit vaativat tietyn lämpötilan pysyäkseen aktiivisina eivätkä denaturoidu. Lähde: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Indusoitu sopivuus ja entsyymin toiminta
Monien vuosien ajan tutkijat luulivat, että entsyymin ja substraatin sitoutuminen tapahtuu yksinkertaisella ”lukko-avain” -periaatteella. Tämä malli väitti, että entsyymi ja substraatti sopivat täydellisesti yhteen yhdessä hetkessä. Nykyinen tutkimus tukee kuitenkin hienostuneempaa näkemystä, jota kutsutaan indusoiduksi sopivuudeksi. Indusoidun sopivuuden malli laajentaa lukko-avain-mallia kuvaamalla dynaamisempaa vuorovaikutusta entsyymin ja substraatin välillä. Kun entsyymi ja substraatti kohtaavat, niiden vuorovaikutus aiheuttaa entsyymin rakenteessa lievän muutoksen, joka vahvistaa tuottavamman sitoutumisjärjestelyn entsyymin ja substraatin siirtymätilan välillä. Tämä energeettisesti suotuisa sitoutuminen maksimoi entsyymin kyvyn katalysoida reaktioaan.
Kun entsyymi sitoutuu substraattiinsa, muodostuu entsyymi-substraatti-kompleksi. Tämä kompleksi alentaa reaktion aktivaatioenergiaa ja edistää sen nopeaa etenemistä jollakin monista tavoista. Perustasolla entsyymit edistävät kemiallisia reaktioita, joissa on mukana useampi kuin yksi substraatti, saattamalla substraatit yhteen optimaalisessa orientaatiossa. Yhden molekyylin sopiva alue (atomit ja sidokset) on vierekkäin sen toisen molekyylin sopivan alueen kanssa, jonka kanssa sen on reagoitava. Toinen tapa, jolla entsyymit edistävät substraattiensa reaktiota, on se, että ne luovat aktiiviseen kohtaan energeettisesti suotuisan ympäristön, jossa reaktio voi tapahtua. Tietyt kemialliset reaktiot saattavat edetä parhaiten hieman happamassa tai poolittomassa ympäristössä. Kemialliset ominaisuudet, jotka johtuvat aminohappojäämien erityisestä sijoittelusta aktiivisessa paikassa, luovat energeettisesti suotuisan ympäristön, jossa entsyymin tietyt substraatit voivat reagoida.
Monien reaktioiden vaatima aktivoitumisenergia sisältää energian, joka liittyy kemiallisten sidosten lievään vääristymiseen niin, että ne voivat helpommin reagoida. Entsyymitoiminta voi auttaa tätä prosessia. Entsyymi-substraatti-kompleksi voi alentaa aktivaatioenergiaa vääristämällä substraattimolekyylejä siten, että sidosten katkeaminen helpottuu. Entsyymit voivat myös alentaa aktivaatioenergiaa osallistumalla itse kemialliseen reaktioon. Aminohappojäännökset voivat tarjota tiettyjä ioneja tai kemiallisia ryhmiä, jotka itse asiassa muodostavat kovalenttisia sidoksia substraattimolekyylien kanssa reaktioprosessin välttämättömänä vaiheena. Näissä tapauksissa on tärkeää muistaa, että entsyymi palaa aina alkuperäiseen tilaansa reaktion päätyttyä. Yksi entsyymien tunnusomaisista ominaisuuksista on, että ne pysyvät lopulta muuttumattomina katalysoimiensa reaktioiden seurauksena. Kun entsyymi on valmis katalysoimaan reaktiota, se vapauttaa tuotteensa (tuotteensa).
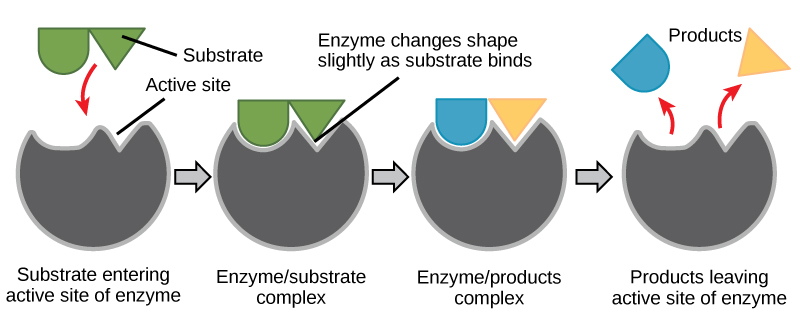
Kuvio 6. Entsyymin katalysoiminen. Indusoidun sovitusmallin mukaan sekä entsyymi että substraatti kokevat dynaamisia konformaatiomuutoksia sitoutumisen yhteydessä. Entsyymi muokkaa substraatin siirtymätilaansa, jolloin reaktion nopeus kasvaa.
Luo energiatarina yllä olevalle reaktiolle
Käyttäen kuvaa 6, vastaa energiatarinassa esitettyihin kysymyksiin.
1. Mitkä ovat reagoivat aineet? Mitkä ovat tuotteet?
2. Minkä työn entsyymi teki?
3. Missä tilassa energia on aluksi? Mihin tilaan energia muuttuu lopputilassa? Tämä voi olla vielä hankalaa, mutta yritä tunnistaa, missä energia on alkutilassa ja lopputilassa.