Although dengue was once a periodic disease that caused long-interval epidemics, today it is considered the most important mosquito-borne virus disease in the world . Maailmassa todetaan vuosittain noin viisikymmentä – sata miljoonaa denguekuumetapausta . Näistä tapauksista puoli miljoonaa johtaa denguekuumeen vakavimpaan muotoon, jota kutsutaan denguekuumeen hemorragiseksi kuumeeksi (DHF) . DHF on tauti, joka koskee pääasiassa alle 15-vuotiaita lapsia, ja sille on ominaista äkillisesti alkava kuume, trombosytopenia ja verisuonten vuoto-oireyhtymä . DHF johtuu Flaviviridae-heimoon kuuluvan dengueviruksen aiheuttamasta infektiosta . Virus on ikosaedrinen, vaipallinen, yksisäikeinen, positiivisen entsyymin omaava RNA . Ikosaedrin ydin on halkaisijaltaan neljäkymmentä – viisikymmentä nanometriä, ja se sisältää C-proteiinin, joka kapseloi viruksen genomin . Ytimen ympärillä on kaksi virusproteiinia, M ja E, jotka muodostavat lipidikuoren . Infektion aiheuttaa yksi dengueviruksen (DENV) neljästä serotyypistä: DENV-1, DENV-2, DENV-3 ja DENV-4 . Tartunta johonkin serotyyppiin ei anna immuniteettia muiden serotyyppien aiheuttamaa tartuntaa vastaan .
Jos henkilö, joka on aiemmin saanut tartunnan, saa tartunnan uudelleen, hänellä on suurentunut riski sairastua dengueshokki-oireyhtymään (DSS) ja DHF-oireyhtymään, joka johtaa verisuoniston heikkenemiseen ja repeämiseen sekä sisäiseen verenvuotoon . Neutraloimattomat vasta-aineet voivat tehostaa viruksen imeytymistä soluihin, jotka ilmentävät Fc-reseptoreita, mikä mahdollistaa vasta-aineesta riippuvaisen tehostumisen DHF:ssä . Eri Aedes-hyttyslajit ovat dengueviruksen vektoreita, ja ne levittävät virusta puremalla ihmisisäntää . Aedes aegypti; pieni, mustavalkoinen, trooppinen ja subtrooppinen hyttynen, jota tavataan Keski-Amerikassa, Latinalaisessa Amerikassa, Kaakkois-Aasiassa ja läntisellä Tyynellämerellä, on pääasiallinen vektori .
Epidemiologia
Tänä päivänä DHF:ää pidetään kansainvälisesti merkittävimpänä hyttysten välittämänä virustautina. Se on endeeminen yli 100 maassa maailmanlaajuisesti, erityisesti trooppisilla ja subtrooppisilla alueilla . Yhdysvalloissa DHF:ää aiheuttavaa Aedes aegyptispecies -lajia esiintyy kausittain Louisianassa, Etelä-Floridassa, New Mexicossa, Arizonassa, Teksasissa, Georgiassa, Alabamassa, Mississippissä, Pohjois- ja Etelä-Carolinassa, Kentuckyssa, Oklahomassa ja Tennesseessä . Viimeisten 50 vuoden aikana denguetaudin esiintyvyys on 30-kertaistunut .
Maailman terveysjärjestön (WHO) mukaan vuosittain arvioidaan esiintyvän 50-100 miljoonaa denguekuumetartuntaa. Näistä tapauksista 500 000 etenee DHF:ksi ja johtaa 22 000 kuolemaan, joista suurin osa on lapsia . WHO:lle toimitettujen virallisten tietojen mukaan denguetapauksia oli Amerikassa, Kaakkois-Aasiassa ja läntisellä Tyynellämerellä yli 1,2 miljoonaa vuonna 2008 ja yli 3 miljoonaa vuonna 2013. Vuonna 2013 pelkästään Amerikassa raportoitiin 2,35 miljoonaa denguetapausta, joista 37 687 oli DHF-tapauksia. Filippiineillä vuosina 1953-1954 ilmenneen ensimmäisen tunnetun DHF-epidemian jälkeen tauti jatkoi leviämistään koko Kaakkois-Aasiaan .
1950- ja 1960-luvuilla ja suurimman osan 1970-luvusta denguekuume-epidemia oli harvinainen suurimmassa osassa Etelä- ja Keski-Amerikkaa, koska ensisijainen hyttysvektori, Aedes aegypti, oli hävitetty. Kun hävittäminen lopetettiin, Aedes aegypti alkoi kuitenkin levitä uudelleen näille alueille. Vuonna 1997 Aedes aegypti ja denguevirus levittäytyivät jälleen maailmanlaajuisesti (kuvat 1,2).WHO:n mukaan nykyään yli 2,5 miljardia ihmistä asuu alueilla, joilla esiintyy endeemistä denguevirusta, ja on vaarassa saada denguevirustartunnan. Useat tekijät edistävät Aedes aegypti -viruksen leviämistä, kuten lämpötila, sademäärät, maalta kaupunkiin suuntautuva muuttoliike, väestönkasvu, varastoitu vesi ja kiinteiden jätteiden lisääntyminen, mikä mahdollistaa toukkien elinympäristön vektorille. Matkailuun liittyviä DHF-tapauksia voi myös esiintyä. Dengue-kuume on maailman laajimmalle levinnyt arbovirusinfektio .
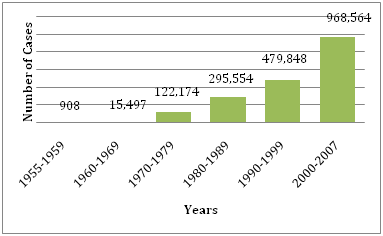
Kuvio 1: WHO:lle ilmoitettujen DF/DHF-tapausten keskimääräinen määrä vuosina .
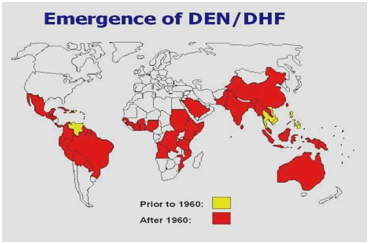
Kuvio 2: Denguekuumeen/ denguekuumeen verenvuotokuumeen levinneisyys Amerikassa, Karibialla, Afrikassa ja Lähi-idässä.
Riskitekijät DF:lle ja dengueviruksen leviämiselle
Dengue-kuumeen esiintyminen on tärkeä niveljalkaisten välityksellä leviävä virustauti . Tutkimukset osoittavat, että Aedes-sukuiset hyttyset, pääasiassa Aedes aegypti ja Aedes albopictus, ovat sopeutuneet elämään lähellä ihmisten asuinalueita ja ovat vastuussa denguekuumeen leviämisestä. Hyttyset ruokailevat päivällä ja suosivat ihmisiä muiden eläinten sijaan. Aedes aegyptiihyttysistä 76,9 prosenttia syö eniten verta ihmisestä, ja seuraavina ovat Aedes albopictus 75 prosentilla ja Aedes vittatus 33,3 prosentilla. DF:n esiintyvyys on yhdistetty kasvillisuuden määrään, puuston peittävyyteen, asumisen laatuun ja ympäröivään maa-alueeseen .
Miehen tekemien lisääntymisalueiden lisäksi myös ilmaston on osoitettu vaikuttavan dengue-ekologiaan vaikuttamalla vektorien dynamiikkaan, taudinaiheuttajien kehitykseen ja hyttysen ja ihmisen vuorovaikutukseen.13 Lämpötila vaikuttaa osaltaan vektorien kehitysnopeuteen, kuolleisuuteen, käyttäytymiseen ja kontrolloi viruksen replikaatiota vektorissa. Lämmin ilmasto mahdollistaa toukkien kehittymisen ja viruksen replikaation nopeutumisen, kun taas kylmä ilmasto hidastaa viruksen kehittymistä ja lyhentää hyttysten eloonjäämisaikaa, mikä vähentää tarttuvan vektorin mahdollisuutta ja vähentää denguekuumeen leviämistä. Lämpötila on myös vuorovaikutuksessa sateiden kanssa haihtumisen pääasiallisena säätelijänä, mikä vaikuttaa suoraan veden elinympäristöjen saatavuuteen ja epäsuorasti maanpeitteeseen ja maankäyttöön, mikä voi edistää tai estää vektoripopulaatioiden kasvua .
Demografiset ja sosiaaliset muutokset, kuten väestönkasvu, kaupungistuminen ja nykyaikainen liikenne, edistävät suuresti denguekuumeen esiintyvyyden lisääntymistä ja maantieteellistä leviämistä . Kun matkustajat liikkuvat endeemisiltä alueilta, he toimivat yleensä välineinä leviämisen jatkumiselle . Viruskannan virulenssi ja dengueviruksen geneettinen vaihtelu lisäävät myös DHF:n epidemian leviämismahdollisuuksia .
Dengue-verenvuotokuumeen patogeneesi
Kun hyttynen syö ihmisisäntää, se ruiskuttaa dengueviruksen (DENV) verenkiertoon ja ympäröivään epidermikseen ja dermikseen. Tämä johtaa epäkypsien Langerhanin solujen ja keratinosyyttien infektioon reseptorivälitteisen endosytoosin kautta . E-proteiini, pintaproteiini, konfiguroituu uudelleen ja mahdollistaa kalvofuusion ja viruksen RNA:n vapautumisen infektoituneeseen soluun. Ei-rakenteelliset proteiinit NS1 ja NS2A kontrolloivat viruksen RNA:n replikaatiota, ja NS1 voi olla osallisena myös komplementtikaskadin aktivoinnissa . Infektoituneet solut voivat sitten kuolla apoptoosin tai nekroosin kautta tai siirtyä imusolmukkeisiin, joissa makrofagit rekrytoituvat (kuva 3). Denguekuumeen neljän serotyypin (DENV-1 – DENV-4) aiheuttama infektio voi useimmissa tapauksissa olla oireeton, koska isännän immuunijärjestelmä pystyy neutraloimaan sen paikallisesti, mutta se voi myös aiheuttaa monenlaisia kliinisiä oireita, joista vakavin on DHF, joka voi edetä DSS:ksi ja kuolemaksi . DHF määritellään kliinisesti 2-7 päivää jatkuneeksi kuumeeksi, johon liittyy limakalvojen tai ihon verenvuotomuodostumia ja johon liittyy trombosytopenia (<100 000 solua/mm3) ja hematokriitti, joka on yli 20 % korkeampi kuin potilaan tai samanikäisen väestön lähtötasolla . DHF:n patologiset tunnusmerkit ovat plasman vuoto pleura- tai vatsakalvopinnoilta ja sisäinen hyytymishäiriö, joka mitataan kliinisesti joko positiivisella puristustestillä tai todisteilla spontaanista verenvuodosta, kuten petekioilla tai ekhymoosilla, ienten verenvuodolla tai epistaxisilla tai ruoansulatuskanavan verenvuodolla .

Kuva 3: Kun kantaja Aedes aegypti -hyttynen on purrut sitä, epäkypsät Langerhansin solut ja keratinosyytit saavat DENV-infektion. Tartunnan saaneet solut siirtyvät sitten imusolmukkeeseen, jossa makrofagit rekrytoituvat . Sieltä infektio leviää eri elimiin, kuten maksaan, pernaan ja luuytimeen. DENV:n aiheuttama luuytimen nekroosi voi johtaa hematopoieettisen toiminnan estymiseen ja veren trombogeneesin vähenemiseen . Tulehdusreaktio, joka johtuu sytokiinien ja sytokiinien vapautumisesta syöttösoluista, makrofageista ja lymfosyyteistä, aiheuttaa lisääntynyttä verisuonten läpäisevyyttä, verihiutaleiden toimintahäiriöitä sekä trombosytopeniaa ja plasmavuotoa . Vaikka mekanismia ei tunneta hyvin, tämä kaskadi näyttää aiheuttavan myös spontaania verenvuotoa, joka johtaa petekioihin, ienten verenvuotoon ja ruoansulatuskanavan verenvuotoon .
Tämän vakavan tautimuodon taustalla on usein sekundaarinen infektio, jossa isäntä saa tartunnan toisesta serotyypistä ja syntyy monimutkainen vuorovaikutus viruksen ja isännän immuunivasteen välillä . Vaikka tämän reaktion aiheuttavaa mekanismia ei tunneta hyvin, todisteet viittaavat siihen, että aiempi infektio voi synnyttää ristireagoivia vasta-aineita, jotka sitovat uutta serotyyppiä, mutta eivät pysty neutraloimaan sitä . Tätä kutsutaan vasta-aineesta riippuvaisen tehostumisen (ADE) teoriaksi . On ajateltu, että aiempien infektioiden aikana DENV:n rakenneproteiineja, kuten E-proteiinia tai prM:ää, vastaan muodostuneet vasta-aineet eivät kykene neutraloimaan uutta patogeeniä, vaan ne johtavat sen sijaan tehostettuun sitoutumiseen Fcγ-reseptoripositiiviseen soluun, mikä mahdollistaa viruksen moninkertaistuneen lisääntymisen . Vastauksena immuunijärjestelmä vapauttaa liioitellun sytokiinivasteen, joka johtaa lisääntyneeseen verisuonten läpäisevyyteen ja koagulopatiaan .
Mastosolut on myös yhdistetty DHF:n patogeneesiin. Joissakin tapauksissa syöttösolut näyttävät tarjoavan suojaavan toiminnon, jossa de-granulaatio vapauttaa viruksenvastaisia molekyylejä ja muut immuunisolut, kuten T-lymfosyytit ja luonnolliset tappajasolut (NK-solut), rekrytoituvat, jotka kaikki auttavat neutraloimaan viruksen . Muissa tapauksissa paikalliset valvontamekanismit eivät kuitenkaan pysty hillitsemään virusta, ja se kulkeutuu verenkierron tai imusuoniston kautta aktivoimaan syöttösoluja muissa elimissä, kuten maksassa, pernassa ja imusolmukkeissa . Kun näissä elimissä tapahtuu de-granulaatiota, proteaaseja vapautuu ja tulehduksen välittäjäaineita, kuten leukotrieenejä ja verisuonten endoteelin kasvutekijää (VEGF), syntetisoidaan, mikä lisää kapillaarien läpäisevyyttä ja johtaa plasmavuotoon . Tämä on tärkeää, koska eri syöttösoluryhmät vapauttavat eri välittäjäaineita de-granulaatioprosessin aikana . Virus-vasta-ainekompleksi, ehkä dengueviruksen NS1-antigeenin kautta, ja sytokiinituotanto johtavat myös komplementin aktivoitumiseen. C3a- ja C5a-fragmenttien vapautumisen tiedetään lisäävän verisuonten läpäisevyyttä ja siten edistävän plasmavuotoa .
Vapautuvien sytokiinien tyypillä ja määrällä on tärkeä merkitys taudin vaikeusasteen sanelemisessa. Makrofagien tulehdusproteiini 1β (MIP-1β) näyttää olevan lievemmän taudin indikaattori, koska sitä vapautuu infektoituneista mononukleaarisista soluista ja aktivoituneista NK-soluista. Se toimii kemologisena houkuttimena useammille NK-soluille ja houkuttelee ne tulehduskohtaan, mikä rajoittaa viruksen replikaatiota ja sytokiinivaikutusta. Interferoni γ:n (IFN-γ) on toisaalta osoitettu aiheuttavan plasmavuotoa ja lisäävän denguehiukkasten ottoa lisäämällä kohdesolujen Fc-reseptoreita, minkä vuoksi se liittyy vakavampiin kliinisiin oireisiin ja huonoon ennusteeseen . Muita sytokiineja, joiden on todettu lisääntyneen DHF:ssä ja joiden on arveltu aiheuttavan plasmavuotoa, ovat interleukiini 2 (IL-2), tuumorinekroositekijä α (TNF- α), makrofagien migraatiota estävä tekijä (MIF), monosyyttien kemotaktinen proteiini-1 (MCP-1), interleukiini-8 (IL-8) ja korkean liikkuvuuden ryhmälaatikko-1 (High Mobility Group Box-1, HMGB-1) . Sytokiinien vapautumisen vaikutukset eivät rajoitu verisuonten läpäisevyyteen ja plasmavuotoon, vaan niillä on osuutta myös DHF:n hemorragisiin ilmenemismuotoihin. DHF:n verenvuotoa aiheuttava mekanismi tunnetaan kuitenkin huonosti. Vaikka suurin osa infektoituneista soluista on alttiita kuolemaan apoptoosin kautta, jonkin verran nekroosia tapahtuu, jolloin vapautuu toksiineja, jotka aktivoivat hyytymis- ja fibrinolyysijärjestelmiä. Kun luuytimessä tapahtuu runsaasti nekroosia suuren viruskuorman vuoksi, hematopoieettinen toiminta estyy, mikä johtaa trombolyysipeniaan . Tästä johtuva trombogeneesin väheneminen ja verihiutaleiden toimintahäiriö voivat aiheuttaa kapillaarien haurautta ja siitä johtuvia DHF:ssä ilmeneviä kliinisiä oireita . Joidenkin tutkimusten mukaan maksan osallistumisella DENV-infektioon voi olla osuutta spontaaniin verenvuototaipumukseen, sillä kohonneiden maksaentsyymiarvojen ja lisääntyneen verenvuototaipumuksen välillä on korrelaatio .
Kliiniset oireet
Taudin kliiniseen ilmenemiseen kuuluu oireeton infektio, lievä denguekuume (DF), denguekuumeen verenvuotokuume (DHF) tai denguekuumeen sokki-oireyhtymä (DSS), joka on usein vakava epänormaalin kapillaarisen läpäisevyyden ja plasmavuodon vuoksi . Vaikeaa denguekuumetta esiintyy yleensä potilailla, jotka ovat saaneet aiemmin denguevirustartunnan (ts. sekundaarinen infektio). Vakavan dengue-infektion on raportoitu esiintyvän runsaasti myös lapsilla, joilla on primaarinen denguevirusinfektio ja jotka ovat syntyneet äideiltä, jotka ovat saaneet aiemmin denguevirustartunnan .
DHF:n alkuvaihe ilmenee denguekuumeena. Tämän alkuvaiheen oireet riippuvat potilaan iästä, ja niihin kuuluu äkillinen korkea kuume (joskus kaksi 2 piikkiä-selkä menosuuntaan), voimakas päänsärky, ruokahalun väheneminen, voimakas myalgia ja nivelkipu, makulopapulaarinen ihottuma, joka ilmaantuu kolme-neljä päivää kuumeen alkamisen jälkeen, retro-orbitaalinen kipu, valonarkuus, lymfadenopatia, lievä verenvuoto (epistaxis, ienverenvuoto, ruoansulatuskanavan verenvuoto, hematuria ja menorragia) ja positiivinen kiristysside. DHF-tapauksille on ominaista neljä tärkeintä kliinistä ilmenemismuotoa, jotka ovat korkea kuume, verenvuotoilmiöt ja usein hepatomegalia ja verenkierron vajaatoiminta. Alkuvaiheelle ominainen akuutti kuumeinen sairaus koostuu yli 39 °C:n lämpötiloista, jotka pysyvät sellaisina 2-7 päivän ajan.
Edellä mainitut alkuvaiheen oireet pahenevat asteittain jatkuvalla kuumeella ja päänsäryllä, voimakkaalla vatsakivulla tai -arkuudella, jatkuvalla oksentelulla, hematemesiksellä, melenalla, petekioilla, helpolla mustelmilla, levottomuudella, letargialla, uneliaisuudella, ärtyneisyydellä, verenvuodolla tai mustelmilla ihon alla . Kun kuume on kestänyt 2-7 päivää, lämpötilan nopeaan laskuun liittyy usein eriasteisia verenkiertohäiriön merkkejä. Potilas voi hikoilla, olla levoton, raajat voivat olla viileät ja pulssissa ja verenpaineessa voi esiintyä muutoksia. Kun DHF:n erityispiirteet ovat alkaneet 24-48 tunnin kuluttua, tunnusomaisina oireina havaitaan epänormaali hemostaasi ja plasmavuoto.
Hyvä indikaattori näistä etenemisvaiheista on maksan yli 2 cm:n suurentuminen, koska hepatomegalia yleensä edeltää plasmavuotoa . Monet potilaat toipuvat neste- ja elektrolyyttihoidolla tai ilman. Vaikeissa tapauksissa plasmanmenetys voi hoitamattomana johtaa sokkiin ja kuolemaan . Tutkimukset viittaavat siihen, että sekä denguekuumeen sekundaarinen infektio että sytokiini-immuunijärjestelmän liioiteltu vastareaktio lisäävät potilaan alttiutta sairastua DHF:ään.
Virustuotteiden, kuten NS1-glykoproteiinin, uskotaan vaikuttavan komplementin aktivaatioon ja verisuonten läpäisevyyteen, mikä johtaa plasmavuotoon, joka kehittyy askitekseksi tai pleuranesteeksi . Sytokiinivaste on myös vastuussa verisuonten läpäisevyyden lisääntymisestä, minkä seurauksena intravaskulaarinen onkoottinen paine laskee ja helpottaa nesteen häviämistä verisuonten ulkopuolisiin osastoihin (kuva 4). Epänormaali hemostaasi koostuu trombosytopeniasta, johon liittyy hematokriitin nousu , pidentyneestä osittaisesta tromboplastiiniajasta ja pienentyneestä fibrinogeenipitoisuudesta sekä aiemmin mainituista petekioista, vakavista ruoansulatuskanavan verenvuodoista, ekhymoosista ja epistaxisista .
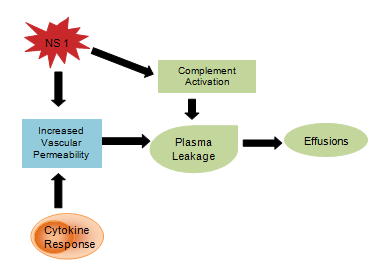
Kuva 4: Sytokiini-immuunijärjestelmän vaste.
DHF:n kuumeisen vireemisen vaiheen aikana trombosytopenian ja sitä seuraavien ilmenemismuotojen uskotaan johtuvan luuydinsuppressiosta. Kuten aiemmin mainittiin, luuytimen suppressio johtuu siitä, että luuydin on viruksen replikaatiopaikka ja hyökkää erityisesti hematopoieettisten esisolujen kimppuun , mutta verihiutaleiden immuunivälitteiseen tuhoutumiseen viittaavat myös DHF-potilaiden verihiutaleiden pinnoilta löydetyt virus-vasta-ainekompleksit.
Epätavallisia kliinisiä ilmenemismuotoja ovat akuutti hepatiitti, maksan vajaatoiminta, akuutti munuaisten vajaatoiminta, enkefalopatia tai kardiomyopatia (akuutti myokardiitti) . Aikuisten kuolemaan johtanutta DHF:ää koskevassa tutkimuksessa tarkasteltiin muita kuolemaan johtaneita syitä kuin Dengue-sokki-oireyhtymää (DSS) potilailla, joilla oli vakava dengue-tauti, ja päädyttiin siihen, että hypotermia, leukosytoosi ja bandemia voivat olla vakavan denguen laukaisevia merkkejä. Tutkimuksessa neuvottiin lisäksi lääkäreitä olemaan tietoisia massiivisen ruoansulatuskanavan verenvuodon mahdollisesta kehittymisestä erityisesti potilailla, joilla on varhainen tajunnanmuutos, syvä trombosytopenia, pitkittynyt PT ja/tai leukosytoosi.
Diagnostiikka, hoito ja hoito
Varhainen ja täsmällinen diagnoosi on kriittinen tekijä asianmukaisen kliinisen hoidon kannalta. Dengue-taudin diagnoosi voidaan tehdä monin eri menetelmin. Diagnoosi voidaan tehdä eristämällä virus, viruksen nukleiinihappo, vasta-aineet ja antigeenit tai kaikkien näiden tekniikoiden yhdistelmällä. Dengueviruksen osoittaminen viljelyllä on lopullinen diagnostinen testi, mutta käytännön näkökohdat rajoittavat sen käyttöä. Viruksen RNA:n osoittaminen on nopeampaa, mutta kontaminaatio voi johtaa vääriin positiivisiin tuloksiin. Myös serologinen testi voi tuottaa väärän positiivisen tuloksen ristireagoivien vasta-aineiden vuoksi.
Akuutit infektiot havaitaan seerumista, plasmasta ja verenkierrossa olevista verisoluista varhaisessa toipumisvaiheessa, joka on ensimmäiset 5-8 päivää oireiden alkamisesta. Tänä aikana primaarinen viruskuorma voi olla jopa 103 RNA-hiukkasta/ml tai yli 106 RNA-hiukkasta/ml sekundaarisissa infektioissa . NS1-antigeeni- ja vasta-ainetestien yhdistelmää sekä molekyylimenetelmiä, kuten reaaliaikaista käänteistranskriptiopolymeraasiketjureaktiota (RT-PCR), käytetään nykyisin yhä useammin diagnoosin tekoon, koska ne antavat nopeampia tuloksia ja voivat olla herkempiä. Immunohistokemiallinen analyysi ja immunofluoresenssi vahvistavat myös viruksen läsnäolon virusantigeenien avulla. IgM-vasta-aineet ilmaantuvat ensimmäisenä 3-5 ensimmäisen päivän kuluessa tartunnasta .
Ne ovat korkeimmillaan 2 viikkoa oireiden ilmaantumisen jälkeen, minkä jälkeen ne laskevat yleensä 30-60 päivän kuluttua havaitsemattomiksi . IgG-vasta-aineet, jotka ovat ristireaktiivisempia, havaitaan alhaisilla tasoilla ensimmäisten 7-9 päivän kuluttua oireiden alkamisesta, ne lisääntyvät hitaasti jopa nelinkertaisiksi ja pysyvät havaittavina useiden kuukausien ja mahdollisesti jopa eliniän jälkeen . Ihmisen antigeeni- ja vasta-ainevaste on riippuvainen isännän immuunitilanteesta, ja niitä esiintyy vain primaari- tai sekundaaritartunnan aikana. Dengue-tautiin ei ole olemassa erityisiä hoitoja tai viruslääkkeitä. Denguetaudin patofysiologia lisää verisuonten läpäisevyyttä, mikä johtaa merkittävään plasman häviämiseen verisuonensisäisestä osastosta verisuonen ulkopuoliseen tilaan.
Tämä nestehukka voi johtaa sokkiin ja ilman asianmukaista korjausta johtaa hypoksiaan, metaboliseen asidoosiin ja lopulta kuolemaan. Siksi ensisijainen hoito edellyttää tukihoitoa sairaalassa neste- ja elektrolyyttitasapainon avulla. Pakattujen solujen tilavuutta on seurattava tunnin välein 4-6 tunnin välein. Merkittävä plasman menetys määritellään >20 %:n lisäykseksi pakattujen solujen tilavuudessa tai hematokriitissä. Kun potilas saavuttaa nämä tasot, tarvitaan nopeaa ja aggressiivista tilavuuskorvausta.
Infuusionesteen korvausnopeus riippuu pakattujen solujen tilavuudesta ja virtsanerityksestä. Plasmahäviön korvaamiseen käytetään useita nesteitä, kuten fysiologista suolaliuosta, Ringerin laktaattia tai Ringerin asetaattia, laimennettua 5-prosenttista glukoosiliuosta, plasmaa tai plasman korvikkeita, kuten dekstriini 40, ja tuoretta kokoverta . Suonensisäisen nestekorvauksen lisäksi elektrolyyttejä voidaan antaa suun kautta, sillä se lievittää jonkin verran kuumeen aiheuttamaa janoa ja nestehukkaa. Kuumeen ja muiden oireiden hoitoon voidaan käyttää tukevia kipulääkkeitä, kuten parasetamolia. Tulehduskipulääkkeitä ja aspiriinia on vältettävä, koska ne voivat aiheuttaa Reyen oireyhtymän.
DHF-potilaiden toipumisen jälkeen on täytettävä seuraavat kriteerit ennen sairaalasta kotiutumista: näkyvä kliininen paraneminen, kuumeettomuus ilman kuumelääkkeiden käyttöä >24 tunnin ajan, lisääntynyt ruokahalu, vakaa hematokriitti, riittävä virtsaneritys, kolmen vuorokauden kuluttua toipuminen vaikeasta metabolisesta asidoosista, verihiutaleiden määrä >50 000/mm3, eikä keuhkopussin effuusiosta johtuvaa hengitysvaikeutta tai askitesta .
Aedes aegypti -lajin ehkäisy ja hävittäminen
Aedes aegypti, joka on dengueviruksen yleisin vektori, on valvonta- ja torjuntatoimien tärkein kohde. Myös muut vektorit, kuten Aedes albopictus, voivat aiheuttaa denguekuumetta, mutta eri vektoreihin kohdistuvia valvonta- ja torjuntatoimia olisi harkittava vain, jos on luotettavaa näyttöä siitä, että kyseisillä vektoreilla on epidemiologisesti merkittävä rooli denguetartuntojen leviämisessä . Ensimmäinen aloite Aedes aegypti -lajin hävittämiseksi tehtiin Kuubassa vuonna 1901. Hyttyspesäkkeiden kaasutus ja hävittäminen tuhoamalla hylättyjä säiliöitä olivat ensimmäisiä askeleita vektorin hävittämiseksi. Keltaisen kuumeen puhjettua Brasiliassa vuosina 1928 ja 1932 kävi ilmeiseksi, että kaupunkiväestön täydellinen suojelu riippui Aedes aegyptimosquiton täydellisestä hävittämisestä; tämä johti siihen, että Pan-Amerikan terveysjärjestö (PAHO) hyväksyi vuonna 1947 Manner-Amerikan kattavan Aedes aegyptimosquiton hävittämissuunnitelman kaupunkien keltakuumeen torjumiseksi. Vuodesta 1947 lähtien Pan American Sanitary Bureau (PASB) edisti intensiivisesti kampanjoita kaikissa maissa, joissa keltatautia esiintyi, ja niiden menestys oli osoitettu vuoteen 1962 mennessä, jolloin 18 Manner-Amerikan maata ja useat Karibian saaret olivat onnistuneet hävittämään keltataudin. Näiden ponnistelujen tuloksena amerikkalainen DENV-2:n genotyyppi V on ainoa nykyään jäljellä oleva denguevirus.
Vektorin hävittämispyrkimyksistä huolimatta Aedes aegypti -lajia ei saatu hävitettyä Kuubasta, Yhdysvalloista, Venezuelasta ja useista Karibian maista . Vuosikymmeniä kestäneet ennennäkemättömät inhimilliset ponnistelut Aedes aegyptin hävittämiseksi kariutuivat hyvin nopeasti ja johtivat nopeasti tartuntoihin. Valvonnan puute ja hävittämisohjelman rakenteen heikkeneminen, riittämätön ympäristön puhtaanapito ja yhteisön riittämätön osallistuminen olivat joitakin tekijöitä, jotka johtivat vektorin hävittämispyrkimysten vähenemiseen . Tällä hetkellä ei ole saatavilla rokotetta denguetartuntojen ehkäisemiseksi. Takeda Vaccines Inc. kehittää parhaillaan elävää, heikennettyä rokotekandidaattia, joka tunnetaan nimellä tetravalentti dengue-rokote (TDV) ja joka koostuu heikennetystä DENV-2-kannasta (TDV-2) ja kolmesta kimeerisestä viruksesta, jotka sisältävät DENV-1:n, -3:n ja -4:n prM- ja E-proteiinigeenit, jotka ilmentyvät heikennetyn TDV-2:n genomin selkärangan yhteydessä (TDV-1, TDV-3 ja TDV-4). Rokote on osoittautunut hyvin siedetyksi ja immunogeeniseksi vaiheen 2 kliinisessä tutkimuksessa, joka tehtiin dengueta endeemisissä maissa aikuisten ja lasten keskuudessa.
Rokote on kehitysvaiheessa 3. Lisäksi Sanofi Pasteur on kehittänyt rekombinanttisen, elävästi heikennetyn, tetravalentin denguekuumerokotteen (CYD-TDV), joka osoitti johdonmukaista turvallisuutta ja tehoa ≥9-vuotiailla henkilöillä endeemisissä maissa; se on myöhäisessä kehitysvaiheessa . Sanofi Pasteurin Dengvaxia (CYD-TDV) rekisteröitiin ensimmäisen kerran Meksikossa joulukuussa 2015, ja sitä on arvioitu 3 annoksen sarjana 0/6/12 kuukauden aikataululla vaiheen III kliinisissä tutkimuksissa . Kliinisissä tutkimuksissa arvioidaan noin viittä muuta rokotekandidaattia . Ennaltaehkäisemiseksi heitä olisi kannustettava valitsemaan majoituspaikat, joissa on hyvin suojatut ikkunat ja ovet, käyttämään hyönteiskarkotteita, käyttämään asianmukaista vaatetusta ja tyhjentämään ja peittämään kaikki seisova vesi, josta voi mahdollisesti tulla hyttysten lisääntymispaikkoja .
Tämänhetkinen maailmanlaajuinen tilanne
Tänään odotetaan, että dengue-taudin esiintyvyys lisääntyy edelleen monien tekijöiden, kuten sosioekonomisen aseman, jatkuvan ilmastonmuutoksen, matkustamisen ja globalisaation vuoksi. Rokotteita kehitetään edelleen, eikä tällä hetkellä ole olemassa mitään erityistä viruslääkehoitoa, jolla voitaisiin torjua denguetaudin kasvavaa uhkaa. Maailmanlaajuinen arvio denguetaudin esiintyvyydestä on 50-200 miljoonaa. Kartografisten lähestymistapojen käyttö viittaa kuitenkin viime aikoina siihen, että esiintyvyys on lähempänä 400 miljoonaa . Vuonna 2012 WHO luokitteli denguetaudin yhdeksi tärkeimmistä hyttysten levittämistä virustauteja aiheuttavista taudeista . Luokitusta perustellaan viruksen ja sen levittäjän merkittävällä maantieteellisellä leviämisellä alueille, jotka eivät ole aiemmin kärsineet taudista (kuva 5).
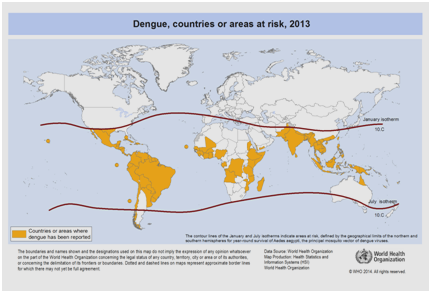
Kuvio 5: Maailman terveysjärjestön keräämien tietojen mukaan maita tai alueita, joissa dengue-tautia raportoitiin vuonna 2013 .
Sitä tukevat myös kustannukset, joita tauti tuo mukanaan. Verrattaessa denguetaudin ja muiden tartuntatautien aiheuttamaa taakkaa tartunta-alueella, dengue aiheuttaa paljon enemmän inhimillistä kärsimystä ja on suurempi taakka kuin muut vektorivälitteiset taudit . WHO:n mukaan dengue on Kaakkois-Aasiassa lasten sairaalahoidon ja kuolemantapausten yleisin syy. Hammond et al. raportoivat tutkimuksessaan, että suurin osa tähän tautiin liittyvästä sairastuvuudesta ja kuolleisuudesta liittyy pikemminkin lapsiin kuin muihin ikäryhmiin. Denguesta kärsivät eniten 4-9 kuukauden ikäiset imeväiset ja 5-9-vuotiaat lapset (kuva 6). Taudin vakavuus näillä lapsilla johtuu usein toissijaisesta DENV-infektiosta. Dıaz-Quijanon ja Waldmanin Latinalaisessa Amerikassa ja Karibialla tekemässä ekologisessa tutkimuksessa todettiin, että denguekuolleisuuden määrääviä tekijöitä näissä väestöissä olivat muun muassa tunnustetun endeemisyyden kesto, väestötiheys ja sademäärä .
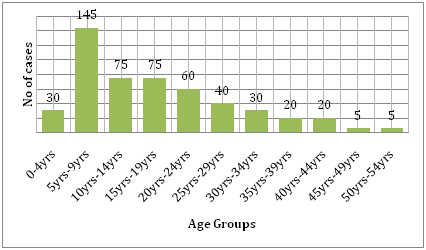
Kuva 6: Leónin tutkimuskohortin ikäjakauma ikäryhmittäin .
Sairastavuuden ja kuolleisuuden vaikutusten lisäksi denguevirus aiheuttaa suuren taloudellisen taakan tartunta-alueille, joista monilla ei ole riittäviä edellytyksiä selviytyä näistä kustannuksista. Vuonna 2010 dengueviruksen aiheuttaman taloudellisen taakan arvioitiin olevan Amerikoissa keskimäärin 2,1 miljardia dollaria vuodessa (vuoden 2010 Yhdysvaltain dollareina), mutta herkkyysanalyyseissä vaihteluväli oli 1-4 miljardia dollaria ja vuosittainen vaihtelu oli huomattavaa. WHO:n mukaan denguevirusta pidetään nyt maailmanlaajuisena huolenaiheena, ja Aasian ja Tyynenmeren alueella on eniten (75 %) denguevirukselle altistuneita ihmisiä maailmassa. Myös läntisellä Tyynellämerellä raportoitujen df-tapausten määrä on kasvanut jatkuvasti viime vuosikymmenen aikana.
Jopa kun DF:n tartuntoja ei esiintynyt 1900-luvun puolivälissä, on nyt havaittavissa, että Amerikoissa on lisääntynyt endeeminen alkuperäisväestön DF-tauti. Pelkästään Amerikassa oli vuonna 2010 yli 1,6 miljoonaa raportoitua denguetapausta, joista 49 000 oli vakavaa dengueta . Afrikassa DF-taudinpurkausten koko ja esiintymistiheys kasvavat, mutta niistä ei ilmoiteta johdonmukaisesti WHO:lle. Käytettävissä olevien taudinpurkaustietojen mukaan 22 Afrikan maata ilmoitti vuosina 1960-2010 satunnaisia tapauksia. Euroopassa ei ole raportoitu DF-epidemioita sitten Kreikassa vuonna 1928 tapahtuneen taudinpurkauksen. Nyt Euroopassa uhkaa puhjeta epidemia, jonka on katsottu johtuvan Aedes albopictus -lajin aiheuttamista matkoista maista, joissa tauti on endeeminen. Arvioidaan, että taudin esiintyvyys lisääntyy tulevina vuosina monitekijäisten riskitekijöiden vuoksi.