Oppimistavoitteet
- Kuvailla kaasun ominaisuuksia.
Aineen kolme yleistä faasia (tai olomuotoa) ovat kaasut, nesteet ja kiinteät aineet. Kaasuilla on näistä kolmesta pienin tiheys, ne ovat hyvin kokoonpuristuvia ja täyttävät täysin minkä tahansa astian, johon ne sijoitetaan. Kaasut käyttäytyvät näin, koska niiden molekyylien väliset voimat ovat suhteellisen heikkoja, joten niiden molekyylit liikkuvat jatkuvasti muista läsnä olevista molekyyleistä riippumatta. Kiinteät aineet sen sijaan ovat suhteellisen tiiviitä, jäykkiä ja kokoonpuristumattomia, koska niiden molekyylien väliset voimat ovat niin voimakkaita, että molekyylit ovat käytännössä lukkiutuneet paikoilleen. Nesteet ovat suhteellisen tiiviitä ja kokoonpuristumattomia, kuten kiinteätkin aineet, mutta ne virtaavat helposti ja mukautuvat säiliönsä muotoon, kuten kaasut. Voidaan siis päätellä, että nesteiden molekyylien välisten voimien summa on kaasujen ja kiinteiden aineiden voimien välillä. Kuvassa 10.1.1 verrataan näitä kolmea olomuotoa ja havainnollistetaan eroja molekyylitasolla.
Kuva 10.1.1 Kaksiatominen aine (O2) kiinteässä, nestemäisessä ja kaasumaisessa olomuodossa
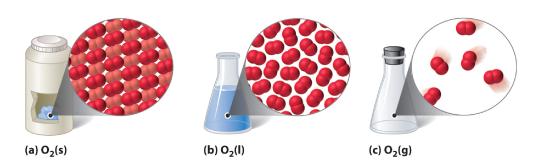
(a) Kiinteällä O2:lla on kiinteä tilavuus ja kiinteä olomuoto, ja molekyylit ovat pakkautuneet tiukasti yhteen. (b) Nestemäinen O2 mukautuu astiansa muotoon, mutta sillä on kiinteä tilavuus; se sisältää suhteellisen tiheään pakkautuneita molekyylejä. (c) Kaasumainen O2 täyttää astiansa kokonaan – riippumatta astian koosta tai muodosta – ja koostuu laajasti toisistaan erillään olevista molekyyleistä.
Tämän aineen tila riippuu voimakkaasti olosuhteista. Esimerkiksi H2O esiintyy yleisesti kaikissa kolmessa tilassa: kiinteässä jäässä, nestemäisessä vedessä ja vesihöyryssä (sen kaasumaisessa muodossa). Useimmissa olosuhteissa kohtaamme veden elämälle välttämättömänä nesteenä; juomme sitä, valmistamme sillä ruokaa ja kylpemme siinä. Kun lämpötila on tarpeeksi kylmä nesteen muuttamiseksi jääksi, voimme hiihtää tai luistella sen päällä, pakata sen lumipalloksi tai lumikartioksi ja jopa rakentaa asumuksia sen avulla. VesihöyryKaasun ja höyryn välinen ero on hienovarainen: termi höyry viittaa sellaisen aineen kaasumaiseen muotoon, joka on normaaliolosuhteissa (25 °C, 1,0 atm) neste tai kiinteä. Typpi (N2) ja happi (O2) ovat siis kaasuja, mutta ilmakehässä olevaa kaasumaista vettä kutsutaan vesihöyryksi. on osa hengittämäämme ilmaa, ja sitä syntyy aina, kun lämmitämme vettä ruoan keittämiseksi tai kahvin tai teen valmistamiseksi. Yli 100 °C:n lämpötilassa olevaa vesihöyryä kutsutaan höyryksi. Höyryä käytetään suurten koneiden, kuten sähköä tuottavien turbiinien, käyttämiseen. Taulukossa 10.1.1
Taulukossa 10.1.1
on yhteenveto veden kolmen olomuodon ominaisuuksista. Atomien, ionien ja molekyylien geometrinen rakenne sekä fysikaaliset ja kemialliset ominaisuudet eivät yleensä riipu niiden olomuodosta; esimerkiksi jään, nestemäisen veden ja höyryn yksittäiset vesimolekyylit ovat kaikki samanlaisia. Sitä vastoin aineen makroskooppiset ominaisuudet riippuvat voimakkaasti sen fysikaalisesta tilasta, joka määräytyy molekyylien välisten voimien ja olosuhteiden, kuten lämpötilan ja paineen, mukaan.
Kuvassa 10.1.2 on esitetty niiden alkuaineiden sijainti jaksollisessa järjestelmässä, jotka esiintyvät yleisesti kaasumaisessa, nestemäisessä ja kiinteässä tilassa. Vetyä lukuun ottamatta luonnossa kaasuina esiintyvät alkuaineet ovat jaksollisen järjestelmän oikealla puolella. Näistä kaikki jalokaasut (ryhmä 18) ovat yksiatomisia kaasuja, kun taas muut kaasumaiset alkuaineet ovat kaksiatomisia molekyylejä (H2, N2, O2, F2 ja Cl2). Happi voi muodostaa myös toisen allotroopin, erittäin reaktiivisen kolmiatomisen molekyylin otsonin (O3), joka on myös kaasu. Bromi (muodossa Br2) ja elohopea (Hg) sen sijaan ovat normaaliolosuhteissa (25 °C ja 1,0 atm, jota kutsutaan yleisesti ”huoneenlämpötilaksi ja -paineeksi”) nesteitä. Gallium (Ga), joka sulaa vain 29,76 °C:ssa, voidaan muuttaa nesteeksi yksinkertaisesti pitämällä sitä sisältävää astiaa kädessä tai pitämällä sitä ilmastoimattomassa huoneessa kuumana kesäpäivänä. Muut alkuaineet ovat normaalioloissa kaikki kiinteitä aineita.
Kuva 10.1.2 Alkuaineet, jotka esiintyvät luonnossa kaasuina, nesteinä ja kiinteinä aineina 25 °C:n lämpötilassa ja 1 atm:n lämpötilassa
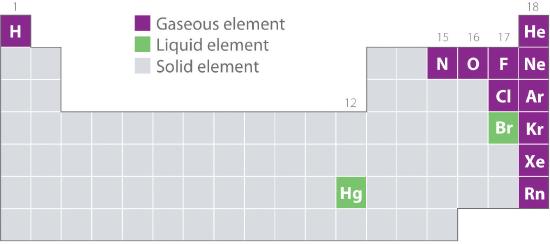
Jalokaasut ja elohopea esiintyvät yksiatomisina lajeina, kun taas kaikki muut kaasut ja bromi ovat kaksiatomisia molekyylejä.
Monet tähän mennessä tapaamistamme alkuaineista ja yhdisteistä esiintyvät tyypillisesti kaasuina; joitakin yleisimpiä niistä on lueteltu taulukossa 10.1.2 . Kaasumaisiin aineisiin kuuluvat monet binääriset hydridit, kuten vetyhalogenidit (HX); kalkogeenien hydridit; ryhmän 15 alkuaineiden N, P ja As hydridit; ryhmän 14 alkuaineiden C, Si ja Ge hydridit; ja diboraani (B2H6). Lisäksi monet epämetallien yksinkertaiset kovalenttiset oksidit ovat kaasuja, kuten CO, CO2, NO, NO2, SO2, SO3 ja ClO2. Myös monet pienimolekyylimassaiset orgaaniset yhdisteet ovat kaasuja, mukaan lukien kaikki hiilivedyt, joissa on neljä tai vähemmän hiiliatomeja, ja yksinkertaiset molekyylit, kuten dimetyylieetteri , metyylikloridi (CH3Cl), formaldehydi (CH2O) ja asetaldehydi (CH3CHO). Kylmäaineet, kuten kloorifluorihiilivedyt (CFC-yhdisteet) ja osittain halogenoidut kloorifluorihiilivedyt (HCFC-yhdisteet), ovat kaasuja, jotka voidaan helposti nesteyttää puristamalla, ja nesteet voidaan puolestaan muuttaa kaasuiksi vähentämällä nesteiden painetta. Jääkaapin sisällä olevissa putkissa tapahtuva faasimuutos nesteestä kaasuksi jäähdyttää, kun taas jääkaapin ala- tai takaosassa olevissa keloissa tapahtuva puristus lämmittää tilaa. Ammoniakki ja SO2 ovat muita kokoonpuristuvia kaasuja, joita on käytetty kylmäaineina, mutta joita ei voida käyttää taloissa niiden myrkyllisyyden vuoksi. Ammoniakkia käytetään edelleen kylmäaineena suurissa kaupallisissa tiloissa sen tehokkuuden ja alhaisen hinnan vuoksi.
Kaikki aiemmin mainitut kaasumaiset aineet (muut kuin yksiatomiset jalokaasut) sisältävät kovalenttisia tai polaarisia kovalenttisia sidoksia ja ovat poolittomia tai polaarisia molekyylejä. Sitä vastoin ionisten yhdisteiden, kuten NaBr:n (kiehumispiste = 1390 °C) tai LiF:n (kiehumispiste = 1673 °C), voimakkaat sähköstaattiset vetovoimat estävät niitä olemasta kaasuina huoneenlämmössä ja -paineessa. Lisäksi minkä tahansa yhdisteryhmän kevyimmät jäsenet ovat todennäköisimmin kaasuja, ja polaaristen yhdisteiden kiehumispisteet ovat yleensä korkeammat kuin saman molekyylimassan omaavien poolittomien yhdisteiden kiehumispisteet. Näin ollen tietyssä yhdisteiden sarjassa kevyimmät ja vähiten pooliset jäsenet ovat todennäköisimmin kaasuja. Suhteellisen harvoja poikkeuksia lukuun ottamatta yhdisteet, joissa on enemmän kuin noin viisi atomia jaksosta 2 tai sen alapuolelta, ovat kuitenkin liian raskaita esiintyäkseen kaasuina normaaliolosuhteissa.
Huomaa kuvio
Kaasumaiset aineet sisältävät usein kovalenttisia tai polaarisia kovalenttisia sidoksia, esiintyvät ei-polaarisina tai lievästi polaarisina molekyyleinä, niillä on suhteellisen alhaiset molekyylimassat ja ne koostuvat viidestä tai sitä pienemmästä määrästä jakson 1 tai 2 atomeja.
Vaikka kaasuilla on monenlaisia käyttötarkoituksia, erityisen synkän kaasumaisen aineen käytön uskotaan olleen persialaisten käyttämä roomalaisten Dura-kaupunkiin Itä-Syyriassa kolmannella vuosisadalla jKr. Persialaiset kaivoivat tunnelin kaupungin muurin alle päästäkseen kaupunkiin ja valloittaakseen sen. Arkeologiset todisteet viittaavat siihen, että kun roomalaiset vastasivat vastatunneleilla pysäyttääkseen piirityksen, persialaiset sytyttivät bitumia ja rikkikiteitä tuottaakseen tiheää, myrkyllistä kaasua. On todennäköistä, että palkeet tai savupiiput levittivät myrkylliset kaasut. Noin 20 roomalaisen sotilaan jäännökset löydettiin kaupungin muurin juurelta alle 2 metriä korkean ja 11 metriä pitkän tunnelin suulta. Koska on erittäin epätodennäköistä, että persialaiset olisivat voineet teurastaa niin monta roomalaista näin ahtaan tilan sisäänkäynnillä, arkeologit arvelevat, että muinaiset persialaiset käyttivät kemiallista sodankäyntiä valloittaakseen kaupungin menestyksekkäästi.
Esimerkki 10.1.1
Minkä yhdisteiden ennustaisit olevan kaasuja huoneenlämmössä ja -paineessa?
- syklohekseeni
- litiumkarbonaatti
- syklobutaani
- vanadiini(III)oksidi
- bentsoehappo (C6H5CO2H)
Annetaan: Yhdisteet
Kysytty: Fysikaalinen olomuoto
Strategia:
A Päätä, onko kukin yhdiste ioninen vai kovalenttinen. Ioninen yhdiste on todennäköisimmin kiinteä aine huoneenlämmössä ja -paineessa, kun taas kovalenttinen yhdiste voi olla kiinteä aine, neste tai kaasu.
B Kovalenttisista yhdisteistä ne, jotka ovat suhteellisen poolittomia ja joilla on pieni molekyylimassa, ovat todennäköisimmin kaasuja huoneenlämmössä ja -paineessa.
Liuos:
A Litiumkarbonaatti on Li2CO3, joka sisältää Li+- ja CO32-ioneja, ja vanadiini(III)oksidi on V2O3, joka sisältää V3+- ja O2-ioneja. Molemmat ovat ensisijaisesti ionisia yhdisteitä, joiden oletetaan olevan kiinteitä aineita. Loput kolme yhdistettä ovat kaikki kovalenttisia.
B Bentsoehapossa on enemmän kuin neljä hiiliatomia ja se on polaarinen, joten se ei todennäköisesti ole kaasu. Sekä syklohekseeni että syklobutaani ovat pohjimmiltaan poolittomia molekyylejä, mutta syklobutaanilla (C4H8) on huomattavasti pienempi molekyylimassa kuin syklohekseenillä (C6H10), jolla taas on enemmän kuin neljä hiiliatomia. Siksi ennustamme, että syklobutaani on todennäköisesti kaasu huoneenlämmössä ja -paineessa, kun taas syklohekseeni on neste. Koska syklohekseenin kiehumispiste on vain 12 °C, kun taas syklohekseenin kiehumispiste on 83 °C, syklobutaani on todellakin kaasu huoneenlämmössä ja -paineessa.
Harjoitus
Minkä yhdisteiden ennustaisit olevan kaasuja huoneenlämmössä ja -paineessa?
- n-butanoli
- ammoniumfluoridi (NH4F)
- ClF
-
eteenioksidi
- HClO4
Vast:
Yhteenveto
Irtoaineet voivat olla kolmessa tilassa: kaasu, neste ja kiinteä. Kaasuilla on näistä kolmesta pienin tiheys, ne ovat hyvin kokoonpuristuvia ja täyttävät säiliönsä kokonaan. Alkuaineet, jotka esiintyvät kaasuina huoneenlämmössä ja -paineessa, ovat ryhmittyneet jaksollisen järjestelmän oikealle puolelle; ne esiintyvät joko yksiatomisina kaasuina (jalokaasut) tai kaksiatomisina molekyyleinä (jotkut halogeenit, N2, O2). Monet epäorgaaniset ja orgaaniset yhdisteet, joissa on neljä tai vähemmän muita kuin vetyatomeja, ovat myös kaasuja huoneenlämmössä ja -paineessa. Kaikille kaasumaisille aineille on ominaista, että niiden muodostavien molekyylien tai atomien väliset vuorovaikutukset ovat heikkoja.
Key Takeaway
- Kaasumaisten aineiden molekyyleissä on usein kovalenttisia tai polaarisia kovalenttisia sidoksia, ne ovat ei-polaarisia tai lievästi polaarisia molekyylejä ja niillä on suhteellisen pieni molekyylimassa.
Käsitteellisiä ongelmia
-
Erittele aineen mikroskooppisten ja makroskooppisten ominaisuuksien eroja. Onko yhdisteen kiehumispiste mikroskooppinen vai makroskooppinen ominaisuus? molekyylimassa? Miksi?
-
Määrittele, ovatko sulamispiste, dipolimomentti ja sähkönjohtavuus aineen makroskooppisia vai mikroskooppisia ominaisuuksia, ja selitä perustelusi.
-
Miten aineen mikroskooppiset ominaisuudet vaikuttavat makroskooppisiin ominaisuuksiin? Osaatko yhdistää molekyylimassan kiehumispisteeseen? Miksi vai miksi ei? Voidaanko poolisuus liittää kiehumispisteeseen?
-
Jos aineessa on kaasu-, neste- ja kiinteäfaasi, järjestä nämä faasit lisääntyvän
- tiheyden mukaiseen järjestykseen.
- molekyylien välisten vuorovaikutusten lujuus.
- tiivistyvyys.
- molekyylien liike.
- järjestys molekyylien tai atomien sijoittelussa.
-
Erittele, mikä tässä väitteessä on väärin: ”Aineen olomuoto määrää pitkälti aineen molekyyliominaisuudet.”
-
Kuvaile tärkeimmät tekijät, jotka määräävät tietyn yhdisteen olomuodon. Mitkä ulkoiset olosuhteet vaikuttavat siihen, esiintyykö aine jossakin kolmesta olomuodosta?
-
Mitkä jaksollisen järjestelmän alkuaineet esiintyvät kaasuina huoneenlämmössä ja -paineessa? Mitkä näistä ovat kaksiatomisia molekyylejä ja mitkä yksiatomisia? Mitkä alkuaineet ovat nesteitä huoneenlämmössä ja -paineessa? Missä jaksollisen järjestelmän osassa on alkuaineita, joiden binääriset hydridit ovat todennäköisimmin kaasuja huoneenlämmössä?
-
Onko seuraava havainto oikein? ”Lähes kaikki ei-metallien binäärihydridit ovat kaasuja huoneenlämmössä, mutta metallihydridit ovat kaikki kiinteitä aineita.” Selitä perustelusi.
-
Pitääkö seuraava havainto paikkansa? ”Kaikki kalkogeenien hydridit ovat kaasuja huoneenlämmössä ja -paineessa lukuun ottamatta hapen binääristä hydridiä, joka on neste.” Selitä perustelusi. Odottaisitko 1-klooripropaanin olevan kaasu? jodipropaanin? Miksi?
-
Selitä, miksi ioniyhdisteet eivät ole kaasuja normaalioloissa.
Vastaukset
-
-
-
Aineen molekyyliominaisuudet ohjaavat aineen olomuotoa tietyissä olosuhteissa, ei päinvastoin. Vahvojen molekyylien välisten voimien esiintyminen suosii tiivistynyttä olomuotoa (nestemäinen tai kiinteä), kun taas hyvin heikko molekyylien välinen vuorovaikutus suosii kaasumaista olomuotoa. Lisäksi molekyylien muoto sanelee, onko tiivistynyt olomuoto neste vai kiinteä olomuoto.
Elementit, jotka esiintyvät kaasuina, ovat pääasiassa jaksollisen järjestelmän oikeassa yläkulmassa ja oikealla puolella. Seuraavat alkuaineet esiintyvät kaasuina: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe ja Rn. Näin ollen puolet halogeeneista, kaikki jalokaasut sekä kevyimmät kalkogeenit ja piknogeenit ovat kaasuja. Näistä kaikki muut paitsi jalokaasut ovat kaksiatomisina molekyyleinä. Vain kaksi alkuaineita esiintyy nestemäisinä tavanomaisessa huoneenlämpötilassa 20 °C-25 °C: elohopea ja bromi. Jaksollisen järjestelmän oikeassa yläosassa on myös suurin osa alkuaineista, joiden binääriset hydridit ovat kaasuja. Lisäksi ryhmien 14-16 alkuaineiden binäärihydridit ovat kaasuja.