Syöpä on seurausta soluja säätelevien kontrollien hajoamisesta. Hajoamisen syynä ovat aina muutokset tärkeissä geeneissä. Nämä muutokset ovat usein seurausta mutaatioista eli muutoksista kromosomien DNA-sekvenssissä. Mutaatiot voivat olla hyvin pieniä muutoksia, jotka vaikuttavat vain muutamaan nukleotidiin, tai ne voivat olla hyvin suuria, jotka johtavat suuriin muutoksiin kromosomien rakenteessa.
Kaikki pienet ja suuret mutaatiot voivat vaikuttaa solujen käyttäytymiseen. Tärkeiden geenien mutaatioiden yhdistelmät voivat johtaa syövän kehittymiseen. Tällä sivulla käsiteltävässä aineistossa kuvataan mutaation ja syövän välistä suhdetta, erilaisia mutaatioita ja niiden aiheuttajia. Lisätietoa tämän sivun aiheista löytyy myös useimmista biologian johdantokirjoista, suosittelemme Campbell Biology, 11. painos.1
Tämän sivun aiheet:
- Mutaatio ja syöpä
- PERINNÖLLISET MUTAATIOT JA SYÖPÄ
- Mutaatiotyypit
- Pistemutaatiot
- Translokaatiot
- Geenin amplifikaatio
- Inversiot, Deletiot ja duplikaatiot
- Aneuploidia
- Epigeneettiset muutokset
- Mutaation syyt
- Yhteenveto mutaatioista
- Know the Flow: Mutaatio ja syöpä
Mutaatio ja syöpä
Syöpäsolujen osoittama epänormaali käyttäytyminen on seurausta sarjasta mutaatioita keskeisissä säätelygeeneissä. Solut muuttuvat asteittain epänormaalimmiksi sitä mukaa, kun yhä useampi geeni vaurioituu. Usein DNA:n korjausta valvovat geenit vaurioituvat itsekin, jolloin solut ovat entistä alttiimpia yhä lisääntyvälle geneettiselle sekasorrolle.
Alhaalla on animaatio, joka havainnollistaa kromosomien, geenien ja DNA:n välistä suhdetta.
Useimpien syöpien uskotaan syntyvän yhdestä mutantista esisolusta. Kun tämä solu jakautuu, syntyvät ”tytärsolut” voivat ajan kuluessa saada erilaisia mutaatioita ja erilaista käyttäytymistä. Ne solut, jotka saavat etulyöntiaseman jakautumisessa tai vastustuskyvyn solukuolemaa vastaan, pyrkivät valtaamaan populaation. Tällä tavoin kasvainsolut pystyvät saamaan monenlaisia ominaisuuksia, joita ei normaalisti esiinny edustamansa solutyypin terveessä versiossa. Syöpäsolujen käyttäytymismuutokset ovat sivuston Syöpäbiologia-osiossa esillä.
Mutaatiot keskeisissä säätelygeeneissä (kasvainsuppressorit ja proto-onkogeenit) muuttavat solujen käyttäytymistä ja voivat mahdollisesti johtaa syövässä havaittavaan sääntelemättömään kasvuun.
Lähes kaikissa tähän mennessä tutkituissa syöpätyypeissä näyttää siltä, että siirtyminen normaalista, terveestä solusta syöpäsoluksi on vaiheittainen etenemisvaihe, joka vaatii monia geneettisiä muutoksia, jotka summautuvat yhteen ja synnyttävät syöpäsolun. Näitä mutaatioita esiintyy sekä onkogeeneissä että kasvainsuppressoreissa. Tämä on yksi syy siihen, miksi syöpä on paljon yleisempi vanhemmilla ihmisillä. Jotta syöpäsolu syntyisi, samassa solussa on tapahduttava useita mutaatioita. Koska minkään geenin mutaation todennäköisyys on hyvin pieni, on selvää, että useiden eri mutaatioiden esiintyminen samassa solussa on todella hyvin epätodennäköistä. Tästä syystä 70-vuotiaan ihmisen elimistön soluilla on ollut enemmän aikaa kerätä syöpäsolujen muodostamiseen tarvittavat muutokset, mutta lapsen soluilla on paljon pienempi todennäköisyys saada tarvittavat geneettiset muutokset. Tietenkin jotkut lapset sairastuvat syöpään, mutta se on paljon yleisempää vanhemmilla ihmisillä. Alla olevassa kaaviossa esitetään paksusuolisyövän määrä Yhdysvalloissa iän mukaan. Kuvaaja on saatu National Cancer Institute -laitokselta. 2
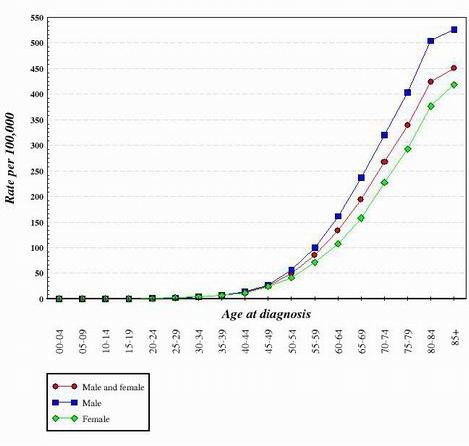
Tarkastelemalla edellä esitetyn kaltaisten käyrien muotoa on päädytty siihen, että syöpäsolujen syntyyn tarvitaan useita geneettisiä muutoksia.
Laboratoriossa tutkijat ovat yrittäneet luoda kasvainsoluja muuttamalla tai lisäämällä niihin keskeisiä säätelyproteiineja. Useissa tutkimuksissa on pyritty määrittelemään syöpäsolun syntymiseen tarvittavien geneettisten muutosten vähimmäismäärä, ja tulokset ovat olleet kiehtovia.3
Luonnossa mutaatiot voivat kerääntyä soluihin ajan mittaan, ja jos ”oikea” ryhmä geenejä mutatoituu, voi syntyä syöpä. Vuonna 2012 tehty tutkimus osoitti, että terveen ihmisen luuytimen kantasoluihin kertyy monia mutaatioita henkilön ikääntyessä. Vain muutama muutos keskeisissä geeneissä voi aiheuttaa syöpää. Tulokset viittaavat siihen, että ”normaalit” solut ja syöpäsolut eivät ehkä olekaan monissa tapauksissa kovin erilaisia.4
Perinnölliset mutaatiot syövässä
Komplisoidakseen asioita on selvää, että syöpäsolun syntymiseen tarvittavat muutokset voidaan saada aikaan monin eri tavoin. Vaikka kaikkien syöpien on voitettava sama säätelytoimintojen kirjo kasvaakseen ja edetäkseen, mukana olevat geenit voivat erota toisistaan. Lisäksi järjestys, jossa geenien säätelystä luovutaan tai ne häviävät, voi myös vaihdella. Esimerkkinä voidaan mainita, että kahden eri henkilön paksusuolen syöpäkasvaimissa voi olla mukana hyvin erilaisia kasvainsuppressoreja ja onkogeenejä, vaikka lopputulos (syöpä) on sama.
Suuri heterogeenisuus, jota syövissä, jopa saman elimen syövissä, on havaittavissa, tarkoittaa, että diagnosointi ja hoito ovat monimutkaisia. Nykyiset edistysaskeleet kasvainten molekyyliluokittelussa mahdollistanevat rationaalisen hoitoprotokollan suunnittelun, joka perustuu kussakin tapauksessa mukana oleviin todellisiin geeneihin. Uusissa diagnostisissa testeissä voidaan seuloa satoja tai tuhansia geenejä, jotta voidaan luoda yksilöllinen kasvainprofiili. Tämän tiedon avulla voitaisiin räätälöidä yksilöllisesti sopivia syöpähoitoja. Lisätietoja tästä on kohdassa Genomiikka/Proteomiikka.
solujen sääntelemättömään kasvuun johtavat geneettiset muutokset voidaan hankkia kahdella eri tavalla. On mahdollista, että mutaatio voi tapahtua vähitellen useiden vuosien kuluessa, mikä johtaa ”sporadisen” syöpätapauksen kehittymiseen. Vaihtoehtoisesti on mahdollista periä geenien toimintahäiriöitä, jotka johtavat tietyn syöpätyypin perinnölliseen muotoon. Esimerkkejä syövistä, joilla tiedetään olevan perinnöllisiä osatekijöitä, ovat:
- Rintasyöpä- BRCA1- ja BRCA2-geenien mutaatioversioiden periytyminen on tunnettu riskitekijä. Vaikka monilla, ellei useimmilla, rintasyöpää sairastavilla henkilöillä ei ole havaittavia muutoksia näissä geeneissä, mutaatiomuodon omaaminen lisää rintasyövän sairastumisen todennäköisyyttä.
- Paksusuolisyöpä- DNA:n korjausgeenien, kuten MSH2:n, vikojen tiedetään altistavan perinnölliselle ei-polypositiiviselle kolorektaalisyövälle (HNPCC).
- Retinoblastooma- Rb-kasvainsuppressorigeenin vikojen tiedetään aiheuttavan tätä silmäsyöpää ja useita muita syöpätyyppejä. Lisätietoja tästä nimenomaisesta sairaudesta on kohdassa Rb
Tämä on epätäydellinen luettelo tunnetuista perinnöllisistä syöpätyypeistä, ja on varmaa, että lisää perinnöllisiä syöpämuotoja tunnistetaan, kun eri syöpätyyppien genetiikkaa selvitetään.
Lisätietoa tästä aiheesta löytyy Robert A. Weinbergin teoksen The Biology of Cancer luvuista 2 ja 4.
Mutaatiotyypit
Valkuaisaineiden valmistusprosessi, translaatio, perustuu transkriptioprosessin kautta tuotetun mRNA:n ”lukemiseen”. Kaikki muutokset geeniä koodaavassa DNA:ssa johtavat tuotetun mRNA:n muuttumiseen. Muuttunut mRNA voi puolestaan johtaa sellaisen proteiinin tuotantoon, joka ei enää toimi asianmukaisesti. Jopa yhden nukleotidin muuttaminen geenin DNA:ssa voi johtaa täysin toimimattomaan proteiiniin.
DNA:ta voidaan muuttaa useilla eri tavoilla. Seuraavassa osassa kuvataan geneettisen muutoksen eri tyyppejä tarkemmin.
Pistemutaatiot
Geneettiset muutokset voidaan jakaa kahteen yleiseen luokkaan. Ensimmäiseen luokkaan kuuluvat muutokset, jotka muuttavat vain yhtä tai muutamaa nukleotidia DNA-juosteessa. Tämäntyyppisiä muutoksia kutsutaan pistemutaatioiksi.
Kun ribosomit lukevat sanansaattaja-RNA-molekyyliä, joka kolmas nukleotidi tulkitaan yhdeksi aminohapoksi. Näitä kolmen kirjaimen koodeja kutsutaan koodoneiksi. Verrattaessa englanninkieliseen lauseeseen: ”Lihava kissa söi rotan” sisältäisi 6 kodonia. Mutaation aiheuttamat muutokset voivat johtaa sellaisiin asioihin kuin ’The fat bat ate the rat.’ tai ’The fa’ tai ’The fat oca tat her at…’. Vaikutus proteiiniin riippuu siitä, missä muutos tapahtuu ja millainen muutos on.
Ribosomien lukemat kolmikirjaimiset koodonit voivat muuttua mutaation seurauksena jollakin kolmesta tavasta:
Nonsense-mutaatiot
Uusi koodoni aiheuttaa proteiinin ennenaikaisen päättymisen, jolloin syntyy proteiini, joka on lyhentynyt ja joka ei useinkaan toimi kunnolla tai ollenkaan.
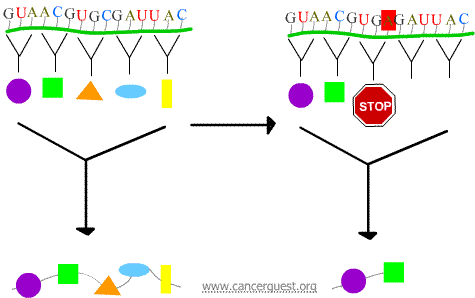
Missense-mutaatiot
Uusi kodoni aiheuttaa väärän aminohapon lisäämisen proteiiniin. Vaikutukset proteiinin toimintaan riippuvat siitä, mitä lisätään normaalin aminohapon tilalle.

Frameshift-mutaatiot
1 tai 2 nukleotidin menetys tai voitto aiheuttaa sen, että kyseinen koodoni ja kaikki sitä seuraavat koodonit luetaan väärin. Tämä johtaa hyvin erilaiseen ja usein toimimattomaan proteiinituotteeseen.
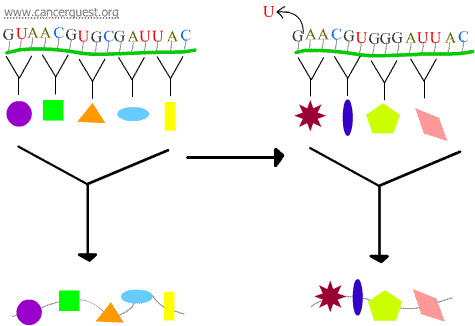
Transkriptiovirheet
Joidenkin DNA-vaurioiden seurauksena syntyy modifioitu nukleotidi tai pieni nukleotidiryhmä, jota RNA-polymeraasi ei voi ”lukea”. Kun RNA-polymeraasikompleksi saavuttaa nämä kohdat, se joskus ohittaa vaurion lisäämällä nukleotideja yrittäessään jatkaa matkaa, vaikka se tarkoittaisikin väärän asian lisäämistä. Tätä prosessia kutsutaan transkriptionaaliseksi mutageneesiksi, ja sillä voi olla merkittävä rooli syövän kehittymisessä.5
Translokaatiot
Toisessa mutaatioluokassa on kyse suurempien DNA-määrien muutoksista, usein kromosomitasolla. Näitä kutsutaan translokaatioiksi, ja niihin liittyy kromosomifragmenttien katkeaminen ja siirtyminen. Usein katkokset kahdessa eri kromosomissa mahdollistavat kahden ”uuden” kromosomin muodostumisen, joissa on uusia geeniyhdistelmiä.
Vaikka saattaisikin vaikuttaa siltä, että tämä ei aiheuttaisi suuria ongelmia, koska kaikki geenit ovat edelleen olemassa, prosessi voi johtaa solun kasvun häiriintymiseen monin tavoin-
1. Geenit eivät ehkä transkriboidu ja käänny asianmukaisesti uudessa sijainnissaan.
2. Geenin siirtyminen voi johtaa sen transkriptiotason nousuun tai laskuun.
3. Katkos ja uudelleen yhdistyminen voi tapahtua myös geenin sisällä (kuten edellä vihreällä on esitetty), mikä johtaa sen inaktivoitumiseen.
Joissakin syöpätaudeissa tietyt translokaatiot ovat hyvin yleisiä, ja niitä saatetaan jopa käyttää taudin diagnosoinnissa. Translokaatiot ovat yleisiä leukemioissa ja lymfoomissa, ja niitä on harvemmin havaittu kiinteiden kudosten syövissä. Esimerkkinä voidaan mainita kromosomien 9 ja 22 välinen kromosominvaihto, jota esiintyy yli 90 prosentilla kroonista myelogeenistä leukemiaa (CML) sairastavista potilaista. Vaihto johtaa kromosomin 22 lyhentyneen muodon muodostumiseen, jota kutsutaan Philadelphian kromosomiksi (sen löytöpaikan mukaan). Tämä translokaatio johtaa onkogeenin muodostumiseen abl-proto-onkogeenista.67
Muita syöpiä, jotka usein (tai aina) liittyvät tiettyihin translokaatioihin, ovat muun muassa Burkittin lymfooma, B-solulymfoomat ja useat leukemiatyypit.
Geenin amplifikaatio
Tässä hyvin epätavallisessa prosessissa DNA:n normaali replikaatioprosessi on vakavasti virheellinen. Tuloksena on, että sen sijaan, että kromosomin alueesta tehtäisiin yksi kopio, syntyy useita kopioita. Tämä johtaa siihen, että kyseisellä kromosomin alueella sijaitsevista geeneistä tuotetaan useita kopioita. Joskus monistetusta alueesta tuotetaan niin monta kopiota, että ne voivat itse asiassa muodostaa omia pieniä pseudokromosomejaan, joita kutsutaan kaksiminuuttisiksi kromosomeiksi.
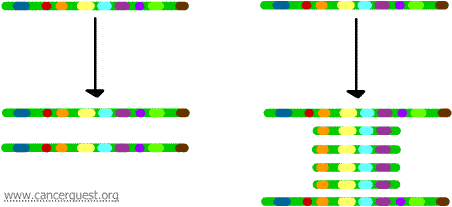
Kullakin kopiolla olevia geenejä voidaan transkriboida ja kääntää, mikä johtaa monistettuja geenejä vastaavan mRNA:n ja proteiinien ylituotantoon, kuten alla näkyy. Kiemurtelevat viivat edustavat mRNA:ta, jota tuotetaan kunkin geenikopion transkription kautta.
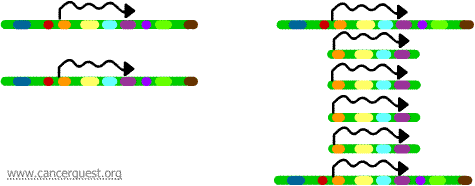
Vaikka tätä prosessia ei nähdä normaaleissa soluissa, sitä esiintyy melko usein syöpäsoluissa. Jos monistuneeseen alueeseen sisältyy onkogeeni, sen seurauksena syntyvä kyseisen geenin yliekspressio voi johtaa häiriintyneeseen solukasvuun. Esimerkkejä tästä ovat myc-onkogeenin monistuminen monissa kasvaimissa ja ErbB-2- tai HER-2/neu-onkogeenin monistuminen rinta- ja munasarjasyövissä. HER-2/neu-onkogeenin tapauksessa kliiniset hoidot on suunniteltu kohdistumaan soluihin, jotka yliekspressoivat proteiinituotetta.
Geenien monistuminen vaikuttaa myös yhteen syövän hoidon suurimmista ongelmista: lääkeresistenssiin. Lääkkeille resistentit kasvaimet voivat jatkaa kasvuaan ja leviämistään jopa kemoterapialääkkeiden läsnäollessa. Tähän yleisesti liittyvää geeniä kutsutaan MDR:ksi, joka tarkoittaa moninkertaista lääkeresistenssiä. Tämän geenin proteiinituote toimii pumppuna, joka sijaitsee solukalvolla. Se pystyy valikoivasti poistamaan molekyylejä solusta, myös kemoterapialääkkeitä. Tämä poistuminen tekee lääkkeet tehottomiksi.
Tätä käsitellään tarkemmin kohdassa Lääkeresistenssi. Eri geenien monistuminen voi tehdä muut kemoterapialääkkeet tehottomiksi.
Inversiot, duplikaatiot ja deletiot
Inversiot
Näissä muutoksissa DNA:n osia irtoaa kromosomista ja asetetaan sitten uudelleen vastakkaiseen suuntaan. Kuten edellisissä esimerkeissä, tämä uudelleenjärjestely voi johtaa epänormaaliin geeniekspressioon joko aktivoimalla onkogeenin tai deaktivoimalla kasvainsuppressorigeenin.
Duplikaatiot/deleetiot
Replikaatiovirheiden vuoksi geeni tai geeniryhmä voi kopioitua kromosomissa useammin kuin kerran. Tämä eroaa geenien monistumisesta siinä, että geenejä ei monisteta kromosomin ulkopuolelle ja ne kopioituvat vain yhden ylimääräisen kerran, ei satoja tai tuhansia kertoja. Geenejä voi hävitä myös monistumisprosessin epäonnistumisen tai muun geneettisen vaurion vuoksi.

Aneuploidia
Aneuploidia on geneettinen muutos, johon liittyy kokonaisten kromosomien häviäminen tai lisääntyminen. Solunjakautumisprosessissa ilmenevien ongelmien vuoksi monistuneet kromosomit eivät välttämättä erotu tytärsoluihin tarkasti. Tämä voi johtaa soluihin, joissa on liikaa kromosomeja tai liian vähän kromosomeja. Esimerkki melko yleisestä aneuploidisesta tilasta, joka ei liity syöpään, on Downin oireyhtymä, jossa kromosomista 21 on ylimääräinen kopio kaikissa sairastuneen yksilön soluissa.
Alla olevassa animaatiossa kahdesta kromosomista muodostetaan kopiot, mutta solun jakaantuessa kromosomit eivät jakaannu tasaisesti kahteen muodostuvaan soluun (tyttären soluihin). Seurauksena on, että toisella solulla on liikaa kromosomeja ja toisella liian vähän.
Syöpäsolut ovat hyvin usein aneuploideja. Ihmisen soluissa on normaalisti 46 kromosomia, mutta syöpäsoluissa on usein paljon enemmän, joskus yli 100. Ylimääräisten kromosomien läsnäolo tekee soluista epävakaita ja häiritsee vakavasti solunjakautumisen kontrollia. Tällä hetkellä käydään keskustelua siitä, ovatko kaikki syövät aneuploideja vai eivät. Riippumatta siitä, onko näin, on selvää, että aneuploidia on yleinen piirre syöpäsoluissa.
Epigeneettiset muutokset
DNA:n sekvenssin varsinaisten muutosten lisäksi geeniekspressiota voidaan muuttaa DNA:n ja kromatiinin muutoksilla, jotka eivät muuta sekvenssiä. Koska nämä muutokset eivät muuta geenien DNA-sekvenssiä, niitä kutsutaan epigeneettisiksi muutoksiksi. Seuraavassa kuvataan kahdenlaisia epigeneettisiä muutoksia.
Metylaatio
Tässä muutoksessa joitakin DNA:n nukleotideja muutetaan lisäämällä emäkselle metyyliryhmä (-CH3). DNA:n metylaatioon liittyy kyseisen DNA-alueen inaktivoituminen. DNA:n epänormaaleja metylaatiomalleja on havaittu syöpäsoluissa. Kuten kuvatut muutokset, metylaatio muuttaa kyseisten geenien ilmentymistä.
Asetylaatio
Tässä epigeneettisessä muutoksessa histoniproteiinit, joiden ympärille DNA:ta kierretään, muuttuvat lisäämällä niihin asetyyli (-CH3CHO) -ryhmiä. Tämä muutos johtaa DNA:histoni-vuorovaikutuksen löystymiseen ja liittyy geeniekspression lisääntymiseen. DNA:n asetyyliryhmien lisäys- ja poistoprosessien muokkaaminen on aktiivinen syövänhoidon tutkimusalue.
Lisätietoa epigeneettisistä muutoksista ja syövänhoidoista.
Mutaation syyt
Kuten olemme nähneet, syöpäsolut syntyvät normaaleista esiasteista geneettisten vaurioiden kasautumisen kautta. Mekanismit, joilla muutokset saadaan aikaan, ovat moninaisia. Laajassa mielessä geneettisten muutosten (mutaatioiden) aiheuttajat kuuluvat pääasiassa alla kuvattuihin luokkiin, ja niitä käsitellään perusteellisesti seuraavassa jaksossa.
Spontaanimutaatiot
Spontaanimutaatiot: DNA:n emäkset (A, T, G, C) muuttuvat tai häviävät korjaamattomien replikaatiovirheiden tai satunnaisten molekyylitapahtumien vuoksi. Esimerkiksi aminoryhmän häviäminen sytosiinista, DNA:ssa normaalisti esiintyvästä emäksestä, johtaa urasiilin syntymiseen, emäksen, jota ei normaalisti esiinny DNA:ssa. Jos tätä muutosta ei havaita ja peruuteta, seurauksena voi olla mutaatio. Toisinaan kokonainen emäs voi kadota DNA:n selkärangan ja emäksen välisen sidoksen katkeamisen seurauksena. Tällöin DNA:n kaksoiskierteeseen syntyy aukko, joka, jos sitä ei korjata, voi johtaa mutaatioon seuraavalla kerralla, kun DNA:ta kopioidaan (eli replikaation aikana).
Indusoidut mutaatiot
Indusoidut mutaatiot: Mutaatioita voidaan indusoida altistamalla organismeja (tai soluja) erilaisille käsittelyille. Joitakin yleisimpiä ovat:
Säteily- Yksi ensimmäisistä tunnetuista mutageeneista, säteily on voimakas mutaatioiden aiheuttaja. Eri säteilytyypit aiheuttavat erityyppisiä geneettisiä muutoksia. Ultraviolettisäteily (UV-säteily) aiheuttaa pistemutaatioita. Röntgensäteily voi aiheuttaa katkoksia DNA:n kaksoiskierteeseen ja johtaa translokaatioihin, inversioihin ja muunlaisiin kromosomivaurioihin. Auringonvalon UV-säteilylle altistuminen on yhdistetty ihosyöpään. Huomaa, että säteilyn DNA:ta vahingoittavia ominaisuuksia on hyödynnetty useissa erilaisissa säteilyyn perustuvissa syöpähoidoissa.
Alhaalla on esitetty eräs ultraviolettisäteilyn aiheuttama mutaatiotyyppi. Tässä esimerkissä DNA:n kaksoiskierteeseen kohdistuva UV-säteiden pommitus saa kaksi emästä liittymään yhteen. Tämä muuttaa DNA:n rakennetta ja voi johtaa pysyviin muutoksiin, jos niitä ei korjata.
Toinen säteilytyyppi on luonnossa esiintyvien radioaktiivisten alkuaineiden (kuten radonin ja uraanin) tai ihmisen tekemien lähteiden, kuten ydinreaktoreissa esiintyvien (ja niissä syntyvien) lähteiden, lähettämä energia. Tämäntyyppistä säteilyä on erityyppistä ja se voi aiheuttaa erilaista vahinkoa soluille ja kudoksille. Säteily voi suoraan vaurioittaa DNA:ta tai aiheuttaa kemikaalien (eli reaktiivisten happilajien eli ROS:ien) muodostumista, jotka voivat sitten vaurioittaa DNA:ta tai muita solun osia.
Radioaktiivisista materiaaleista peräisin olevalle säteilylle altistuminen on hyvin dokumentoitu. Toisen maailmansodan aikana Japaniin pudotetuista atomipommeista eloonjääneiden analyysit osoittivat leukemioiden suurta lisääntymistä pian altistumisen jälkeen ja sitten muiden syöpätyyppien lisääntymistä seuraavien vuosikymmenten aikana.8
Ydinvoimaloista on myös vapautunut vahingossa vaarallisia määriä radioaktiivisia aineita. Tshernobylin ydinreaktorin radioaktiivisten aineiden tahattomasta vapautumisesta johtuva säteilyaltistus on yhdistetty kilpirauhassyövän ja muiden pahanlaatuisten syöpien lisääntymiseen.9
Lääketieteelliset kuvantamislaitteet (kuten röntgenlaitteet ja tietokonetomografiakuvaajat) altistavat myös potilaita säteilylle. Yksittäisessä testissä käytettävien määrien ei uskota aiheuttavan merkittäviä määriä syöpää, mutta monien testien pitkäaikaisvaikutukset useiden vuosien aikana eivät ole selvillä.10 Samoin lentomatkustajien altistumisen kokovartalotutkimuksille lentokentillä ei uskota aiheuttavan syöpäriskiä.11 Lentokoneiden matkustajat altistuvat myös avaruudesta peräisin olevalle säteilylle, mutta se on vähäistä eikä sen uskota aiheuttavan syöpäriskiä edes lentohenkilökunnan jäsenille.1112
Kemialliset mutageenit- Monien eri kemikaalien tiedetään aiheuttavan mutaatioita. Nämä kemikaalit vaikuttavat sitoutumalla DNA:han tai DNA:n rakennusaineisiin ja häiritsemällä replikaatio- tai transkriptioprosesseja. Esimerkkejä voimakkaista mutageeneista ovat bentso-a-pyreeni, kemikaali, jota esiintyy tupakansavussa, ja aflatoksiini, mutageeni, jota esiintyy useimmiten väärin säilytetyissä maataloustuotteissa.
Krooninen tulehdus – Krooninen tulehdus voi johtaa DNA-vaurioihin immuunijärjestelmän solujen tuottamien mutageenisten kemikaalien vuoksi. Esimerkkinä voidaan mainita hepatiittiviruksen aiheuttama pitkäaikainen tulehdus. Lue lisää viruksista ja syövästä.
Happiradikaalit- Mitokondrioissamme tapahtuvan energian talteenoton aikana ravinnosta voi syntyä kemikaaleja, jotka ovat hyvin reaktiivisia ja kykenevät vahingoittamaan solukalvoja ja itse DNA:ta. Näitä reaktiivisia hapen välituotteita (ROI) voi syntyä myös altistettaessa soluja säteilylle, kuten alla on esitetty.
ROI:n mutageeninen aktiivisuus liittyy syövän kehittymiseen sekä useiden syöpähoitojen, kuten säteilyn ja kemoterapian, toimintaan. 131415
Epänormaali solunjakautuminen
Mitoosin aikana on mahdollista, että solunjakautumisprosessi ei onnistu jakamaan monistuneita kromosomeja tarkasti kahdeksi tytärsoluksi. Tällainen virhe johtaa aneuploidisten solujen syntyyn. Soluista joko puuttuu tai niihin on tullut merkittävä määrä geenejä. Tämä harvinainen prosessi voi luoda soluja, jotka ovat alttiimpia sääntelemättömälle solunjakautumiselle. Kuten aiemmin todettiin, suuri osa ihmisistä eristetyistä syövistä on aneuploideja.
Jos solussa on mutaatio geenissä, jonka proteiinituotteen tehtävänä on ”valvoa” solunjakautumisprosessia, asiat voivat riistäytyä nopeasti käsistä, ja jokaisen jakautumisen tyttärisoluista voi tulla yhä epänormaalimpia.
Virukset mutageeneinä
Virusten ajatellaan aiheuttavan merkittävän osuuden syöpätapauksista. Virukset voivat aiheuttaa syöpää monin eri tavoin, ja kunkin virustyypin toimintatapa on todennäköisesti hieman erilainen. Jotkut virukset (mukaan lukien monet retrovirukset) voivat aiheuttaa mutaatioita lisäämällä geenejään tartunnan saaneen solun perimään. Lisätty DNA voi tuhota tai muuttaa vaikutuksen kohteena olevien geenien toimintaa.161718
Virukset voivat aiheuttaa mutaatioita myös epäsuorilla tavoilla. Esim: Hepatiittiviruksen aiheuttama infektio voi kestää useita vuosia. Tuona aikana elimistön puolustusjärjestelmä yrittää päästä eroon viruksesta tuottamalla myrkyllisiä kemikaaleja. Nämä kemikaalit voivat vahingoittaa muuten terveitä ”sivusoluja” ja lähettää ne syöpään johtavalle tielle. On olemassa lukuisia muitakin tapoja, joilla virukset voivat aiheuttaa syöpää. 1920
Koska viruksilla on suuri merkitys monien syöpien synnyssä, olemme luoneet viruksia ja syöpää käsittelevän osion.
Transposonit mutageeneina
Transposonit ovat lyhyitä DNA-sekvenssejä, joilla on kyky siirtyä DNA:n yhdestä paikasta toiseen. Transposonit koodaavat entsyymiä, transposaasia, joka toimii transposonin liittämiseksi uusiin paikkoihin genomissa (ks. transposonin kaaviokuva alla vasemmalla) Transposonit löysi Barbara McClintock, ja hän sai työstään Nobel-palkinnon.2122 Ihmisen genomissa on monia inaktivoituneita transposonien kopioita, jotka ovat menettäneet kykynsä siirtyä tai ”hypätä” uusiin paikkoihin. Noin 50 prosenttia ihmisen genomista koostuu ”kuolleista” transposoneista.23
Aktiivisten transposonien liikkuminen voi johtaa mutaatioihin, jotka muuttavat geenien toimintaa. Näkyvä esimerkki transposonien liikkeestä (jota kutsutaan transpositioksi) on intialaisen maissin siementen väritys (ks. alla oikealla). Ihmisissä aktiivisten transposonien uskotaan olevan osallisena ihmisen sairauksissa, kuten syövässä.242526 .


Mutaatioyhteenveto
Geneettinen muutos (mutaatio) Johdanto
- Syöpäsolujen osoittamat epänormaalit käyttäytymismallit ovat seurausta sarjasta mutaatioita keskeisissä säätelijägeeneissä (eli DNA:n korjaamisgeeneissä).
- Vähäisimmän osan syövistä ajatellaan syntyvän yksittäisestä esiasteesta (prekursorisolusta)
- , joka on saanut riittävät mutaatiot muuttuakseen syöpäsoluksi.
DNA-mutaatiot
- Geettiset muutokset voivat olla pieniä, vain yhteen tai muutamaan nukleotidiin vaikuttavia (pistemutaatiot) tai ne voivat olla varsin suuria, muuttaa kromosomin tai kromosomien rakennetta.
- Pistemutaatiot
- Translaatio on proteiinin tuottamista entsyymeillä, jotka ”lukevat” kolme nukleotidien ”sanaa” (koodoneja) pitkin sanansaattaja-RNA:ta (mRNA).
- Jopa yhden nukleotidin muuttaminen geenin DNA:n varrella voi johtaa täysin toimimattomaan proteiiniin. Mutaatiot ryhmitellään sen mukaan, millaisia muutoksia ne aiheuttavat vaurioituneen geenin tuloksena syntyvään proteiinituotteeseen.
- Nonsense-mutaatiot – Uusi (mutantti) kodoni aiheuttaa proteiinisynteesin ennenaikaisen pysähtymisen.
- Missense-mutaatiot – Muuttunut kodoni johtaa väärän aminohapon lisäämiseen proteiiniin.
- Frameshift-mutaatiot – Yhden tai kahden nukleotidin menetys tai voitto mRNA:ssa aiheuttaa koodonien virheellisen lukemisen. Lopulta tämä johtaa vastaavien proteiinien ylituotantoon.
- Inversiot – DNA:n osia irtoaa kromosomista ja asetetaan sitten uudelleen päinvastaisessa suunnassa.
- Duplikaatiot/deleetiot – Geeni tai geeniryhmä voi kadota kokonaan tai se voi kopioitua useammin kuin kerran kromosomissa.
- Aneuploidia – Geneettinen muutos, johon liittyy kokonaisten kromosomien häviäminen tai lisääntyminen.
- Spontaaneja mutaatioita voi esiintyä korjaamattoman DNA:n tai satunnaisten molekyylitapahtumien vuoksi.
- Aneuploidia on hyvin yleistä syöpäsoluissa.
Epigeneettiset muutokset
- Geenin ilmentymistä voidaan muuttaa DNA:n ja kromatiinin muutoksilla, jotka eivät muuta geneettistä järjestystä. Esimerkkejä ovat DNA:n metylaatio ja histonien asetylaatio.
- Metylaatio – Joitakin DNA:n nukleotideja muokataan lisäämällä metyyliryhmä, joka liittyy kyseisen DNA:n alueen inaktivoitumiseen
- Asetylaatio – Asetyyliryhmien lisääminen irrottaa DNA:ta ja lisää geeniekspressiota.
Indusoidut mutaatiot
- Mutaatioita voidaan indusoida altistamalla organismeja (tai soluja) erilaisille käsittelyille:
- Säteily – UV-säteet aiheuttavat pistemutaatioita ja röntgensäteet aiheuttavat monenlaisia vaurioita.
- Kemialliset mutageenit – Voi sitoutua DNA:han tai DNA:n rakennuspalikoihin ja häiritä replikaatio- tai transkriptioprosesseja.
- Krooninen tulehdus – DNA-vaurio, joka johtuu immuunijärjestelmän solujen tuottamista mutageenisista kemikaaleista
- Happiradikaalit – Syntyy solun energiantuotannossa ja voi vahingoittaa DNA:ta.
Muut geneettiset muutokset
- Solujen poikkeava jakautuminen, joka johtaa kromosomien väärään jakautumiseen, voi johtaa aneuploidiaan.
- Virukset voivat aiheuttaa geneettisiä vaurioita useilla eri tavoilla, ja ne yhdistetään useisiin syöpiin.
Mutaatio ja syöpä
- Näyttää siltä, että siirtyminen normaalista, terveestä solusta syöpäsoluksi on vaiheittainen eteneminen.
- Syövän kehittyminen edellyttää geneettisiä muutoksia useissa eri onkogeeneissä ja kasvainsuppressoreissa.
- Kaikkien syöpien on voitettava sama säätelytoimintojen kirjo kasvaakseen ja edetäkseen, mutta mukana olevat geenit voivat olla erilaisia.
- Syövän heterogeenisuus vaikeuttaa diagnoosia ja hoitoa.
- On mahdollista periä toimintahäiriöisiä geenejä, jotka johtavat tietyn syöpätyypin familiaalisen muodon kehittymiseen.
Know the Flow: Mutation
Know the Flow on interaktiivinen peli, jossa voit testata tietojasi. Pelaaminen:
- Vedä oikealla olevasta sarakkeesta sopivat vaihtoehdot ja aseta ne järjestyksessä vasemmalla oleviin ruutuihin. Huomaa, että käytät vain viittä kuudesta vaihtoehdosta pelin suorittamiseen.
- Kun olet valmis, napsauta ’Tarkista’ nähdäksesi, kuinka monta vaihtoehtoa sait oikein.
- Vääränlaisten vastausten kohdalla napsauta ’Kuvaus’ tarkastellaksesi tietoja prosesseista.
- Yritä uudestaan valitsemalla ’Nollaa’ ja aloittaaksesi uudestaan alusta.
Tiedä virtaus: MutaatioProsessit järjestyksessä-
1
-
2
-
3
-
4
-
5
Prosessit-
LisätietoaSolussa on käynnissä DNA-synteesi
-
LisätietoaKromosomin jostain alueesta tehdään monta kopiota
-
Opi lisääMonistettujen geenien transkriptio
-
Opi lisääMonistettujen geenien transkriptio
-
Opi lisääKerroksen avaimen ylituotantoa proteiini johtaa lääkeresistentin kasvaimen kasvuun
-
Lue lisääDuplikaatio tapahtuu
Tarkista vastaukset Nollaa vastauksetTeit sen!Prosessi on oikeassa järjestyksessä!Pelaa uudelleen
Javascript tarvitaan pelataksesi Know the Flow- 1. Valitse uudelleen. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbellin biologia (11. painos). Pearson.
- 2. Surveillance, Epidemioloy, and End Results (SEER), jota edustaa National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. ”Määriteltyjä geneettisiä elementtejä sisältävien ihmisen kasvainsolujen luominen”. Nature 400: 464-468
- 4. Nature 400: 464-468
- . Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. The origin and evolution of mutations in acute myeloid leukemia. Cell, July 20, 2012
- 5. Cell, July 20, 2012
- . Brégeon D, Doetsch PW. Transkriptiivinen mutageneesi: syyt ja osallistuminen kasvainten kehitykseen. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. ”Normaalien ja leukeemisten ihmisen leukosyyttien kromosomitutkimukset”. J Natl Cancer Inst (1960). 25: 85-100.
- 7. Rowley JD. ”Uusi johdonmukainen kromosomipoikkeavuus kroonisessa myelogeenisessä leukemiassa, joka on tunnistettu kinakriinifluoresenssi- ja Giemsa-värjäyksellä.” Nature (1973). 243: 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. RISK OF CANCER AND NON-CANCER DISEASES IN THE ATOMIC BOMB SURVIVORS. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. The Chernobyl accident–an epidemiological perspective. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 Ma 9. Mar.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Altistuminen matala-annoksiselle ionisoivalle säteilylle lääketieteellisistä kuvantamistoimenpiteistä. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Airport Full-Body Screening: What Is the Risk? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Kosminen säteily kaupallisessa ilmailussa. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. ”Oksidatiivinen stressi, DNA-vauriot ja rintasyöpä”. AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. ”Oksidatiivinen stressi ja kokeellinen karsinogeneesi”. Indian J. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. ”Hapettavat radikaalit, lipidiperoksidaatio ja DNA-vauriot”. (2002)181-182:219-222
- 16. Nair V. Retrovirusten aiheuttama onkogeneesi ja retrovirusvektoreiden turvallisuus. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Epstein-Barr-virus ja Burkittin lymfooma. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogeeniset retrovirukset ja syöpä. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatiitti B -viruksen aiheuttama onkogeneesi. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV:hen liittyvä hepatosellulaarinen karsinooma: Kroonisesta tulehduksesta syöpään. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. Muuttuvien lokusten alkuperä ja käyttäytyminen maississa. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Nobel-palkintoluento
- 23. McClintock, Barbara Nobel Prize lecture
- . Burns KH, Boeke JD. Ihmisen transposonitektoniikka. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Liikkuvat geneettiset elementit ja syöpä. Mutaatioista geeniterapiaan. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Liikkuvat elementit ihmisen genomissa: vaikutukset sairauksiin. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Ihmisen genomien luonnollinen mutageneesi endogeenisten retrotransposonien avulla. Cell. 2010 Jun 25;141(7):1253-61.