Komórki zawierają dużo wody. Jedną z funkcji wody jest rozpuszczanie różnych materiałów. Na przykład, w komórkach znajduje się wiele różnych związków jonowych (soli). Jony są wykorzystywane do utrzymania potencjału komórek i są ważne w sygnalizacji komórkowej i skurczu mięśni.
Jak można stwierdzić, czy związek jest jonowy czy kowalencyjny?
Nie ma prostej odpowiedzi na to pytanie. Wiele wiązań znajduje się gdzieś pomiędzy. W polarnym wiązaniu kowalencyjnym, para elektronów jest dzielona między dwa atomy w celu spełnienia ich oktetów, ale elektrony leżą bliżej jednego końca wiązania niż drugiego. Jest więcej ładunku ujemnego w kierunku jednego końca wiązania, a to pozostawia więcej ładunku dodatniego na drugim końcu.
Patrząc na wartości elektronegativity różnych atomów pomaga nam zdecydować, jak równomiernie para elektronów w wiązaniu jest dzielona. Elektronegatywność wzrasta w kierunku prawego górnego rogu układu okresowego z powodu kombinacji ładunku jądrowego i czynników ekranujących. Atomy w prawym górnym rogu układu okresowego mają większe przyciąganie na ich wspólnych elektronów wiązania, podczas gdy te w lewym dolnym rogu mają słabsze przyciąganie dla elektronów w wiązaniach kowalencyjnych.
W wiązaniu węgiel-tlen, więcej elektronów byłoby przyciągane do tlenu, ponieważ jest na prawo od węgla w jego rzędzie w układzie okresowym. Związki takie jak , eter dimetylowy, CH3OCH3, są trochę polarne. Formaldehyd, CH2O, jest jeszcze bardziej polarny. Elektrony w wiązaniach pi są trzymane luźniej niż elektrony w wiązaniach sigma, z powodów związanych z mechaniką kwantową. To pozwala tlenowi przyciągać elektrony do niego łatwiej w wiązaniu wielokrotnym niż w wiązaniu sigma.

Nie wszystkie polaryzacje są łatwe do określenia przez spojrzenie na układ okresowy. Kierunek dipola w wiązaniu bor-wodór byłby trudny do przewidzenia bez sprawdzenia wartości elektroujemności, ponieważ bor jest bardziej na prawo, ale wodór jest wyżej. Jak się okazuje, wodór jest lekko ujemny.
Wiązanie jest jonowe, jeśli różnica elektroujemności pomiędzy atomami jest na tyle duża, że jeden atom mógłby odciągnąć elektron całkowicie od drugiego. Taka sytuacja występuje w związkach, które łączą pierwiastki z lewego skraju układu okresowego (sód, potas, wapń itp.) z pierwiastkami znajdującymi się w skrajnie prawym górnym rogu układu okresowego (najczęściej tlen, fluor, chlor). Chlorek sodu jest związkiem jonowym.
Wiele wiązań może być kowalencyjnych w jednej sytuacji i jonowych w innej. Na przykład, chlorek wodoru, HCl, jest gazem, w którym wodór i chlor są związane kowalencyjnie, ale jeśli HCl jest bubbled do wody, to jonizuje się całkowicie, aby dać H + i Cl- z roztworu kwasu solnego. Nawet w gazowym HCl, ładunek nie jest rozłożony równomiernie. Chlor jest częściowo ujemny, a wodór jest częściowo dodatni.
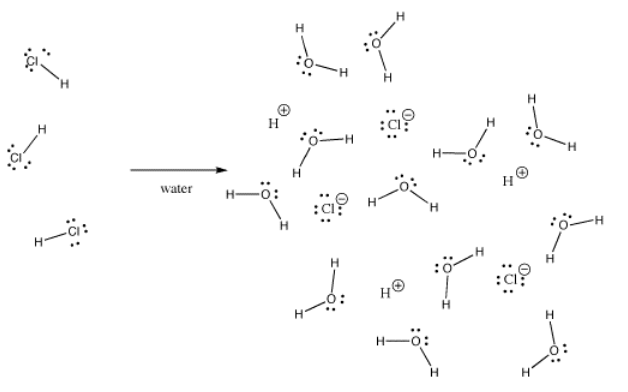
Wodorotlenek potasu, KOH, zawiera jedno wiązanie, które jest kowalencyjne (O-H) i jedno, które jest jonowe (K-O). Wodór jest trudny, ponieważ znajduje się na szczycie układu okresowego, jak również po lewej stronie. Jest on wystarczająco elektroujemny, aby w niektórych przypadkach tworzyć wiązania jonowe. Jest wystarczająco elektroujemny, aby tworzyć wiązania kowalencyjne w innych przypadkach.
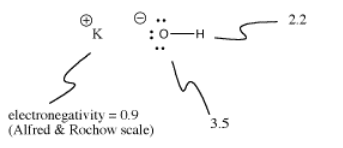
W KOH, wiązanie K-O jest jonowe, ponieważ różnica w elektroujemności między potasem a tlenem jest duża. Różnica w elektronegatywności między tlenem a wodorem nie jest mała. Wiązanie O-H może czasami jonizować, ale nie we wszystkich przypadkach.
Czasami jonizacja zależy od tego, co jeszcze dzieje się w cząsteczce. Ponieważ K-O wiązanie w wodorotlenku potasu jest jonowe, O-H wiązanie nie jest bardzo prawdopodobne, aby jonizować. Na tlenie znajduje się już ładunek ujemny. Rozdzielenie ładunku kosztuje energię, więc trudniej jest dodać drugi ładunek ujemny do tlenu poprzez jonizację również wiązania O-H. Często pierwsze jonizacje w cząsteczkach są o wiele łatwiejsze niż drugie jonizacje.
Ćwiczenie
Przewidź kierunek biegunowości w wiązaniu między atomami w następujących parach:
a) siarka-tlen b) krzem-fluor
c) wodór-sód d) chlor-aluminium
Odpowiedź
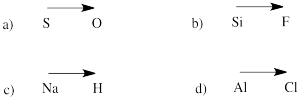
Ponieważ tak często zdarza się, że pierwiastek ze skrajnie lewej strony układu okresowego występuje jako kation, oraz że pierwiastki ze skrajnej prawej strony niosą ładunek ujemny, możemy często założyć, że związek zawierający przykład każdego z nich będzie miał co najmniej jedno wiązanie jonowe.
Ćwiczenie
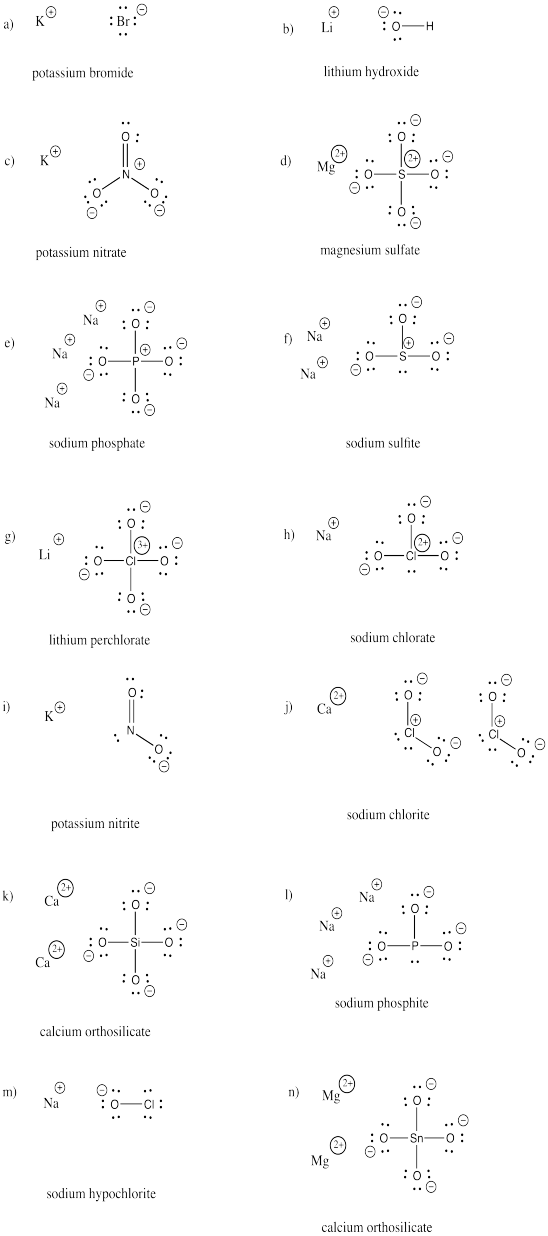
Narysuj struktury następujących związków. Każdy z nich zawiera co najmniej jeden anion i kation.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Odpowiedź
Ćwiczenie
Jon amonowy, NH4+, jest powszechnie występującym jonem cząsteczkowym.
| przedrostek- lub -sufiks |
wspólne znaczenie |
przykładowa nazwa | przykładowy wzór |
| -.ide | atom występuje jako anion | chlorku | Cl – |
| -ate | atom występuje jako oksyanion; zazwyczaj pospolita forma | chloranu | ClO3- |
| -it | atom występuje jako oksyanion, ale z mniejszą liczbą oksygenów (lub niższym „stanem utlenienia”) niż inna powszechna forma | chlorynu | ClO2- |
| per- | atom występuje jako oksyanion, ale z jeszcze większą ilością oksygenów niż forma „-ate” | chloran nadchloranu | ClO4- |
| hypo- | atom występuje jako oksyanion, ale z jeszcze mniejszą liczbą oksygenów niż forma „-itowa” | chloryn | ClO- |
Korzystając z tabeli jako przewodnika, zaproponuj nazwy dla następujących anionów:
a) Br- b) O2- c) F- d) CO32- (pospolity oksyanion) e) NO3- (pospolity oksyanion) f) NO2-
g) S2- h) SO42- (pospolity oksanion) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (pospolity oksyanion) o) PO33- p) I- q) IO3- (wspólny oksyanion) r) IO4-
Odpowiedź b)
tlenek
Odpowiedź c)
fluorek
Odpowiedź d)
węglan
Odpowiedź e)
azotan
Odpowiedź f)
azotyn
Odpowiedź g)
siarczek
Odpowiedź h)
siarczan
Odpowiedź i)
siarczyn
Odpowiedź j)
persulfat
Odpowiedź k)
karbid
Odpowiedź l)
azotek
Odpowiedź m)
arsenek
Odpowiedź n)
fosforan
Odpowiedź o)
fosforyn
Odpowiedź p)
jodek
Odpowiedź q)
jodan
Odpowiedź r)
periodan
Atrybucja
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)
.