Atomowe Widma Emisyjne
Elektrony w atomie mają tendencję do układania się w taki sposób, aby energia atomu była jak najniższa. Stan podstawowy atomu jest najniższym stanem energetycznym atomu. Kiedy te atomy otrzymują energię, elektrony absorbują ją i przechodzą na wyższy poziom energetyczny. Te poziomy energetyczne elektronów w atomach są skwantowane, co oznacza, że elektron musi przechodzić z jednego poziomu energetycznego na drugi w dyskretnych krokach, a nie w sposób ciągły. Stan wzbudzony atomu jest stanem, w którym jego energia potencjalna jest wyższa niż w stanie podstawowym. Atom w stanie wzbudzonym nie jest stabilny. Kiedy powraca z powrotem do stanu podstawowego, uwalnia energię, którą wcześniej uzyskał w postaci promieniowania elektromagnetycznego.
Jak więc atomy uzyskują energię w pierwszej kolejności? Jednym ze sposobów jest przepuszczenie prądu elektrycznego przez zamkniętą próbkę gazu przy niskim ciśnieniu. Ponieważ poziomy energetyczne elektronów są unikalne dla każdego pierwiastka, każda rura wyładowcza będzie świecić z charakterystycznym kolorem w zależności od tożsamości gazu (patrz poniżej).

Znaki „neonowe” są dobrze znanymi przykładami lamp wyładowczych. Jednak tylko znaki, które świecą czerwono-pomarańczowym kolorem widocznym na rysunku, są rzeczywiście wypełnione neonem. Znaki o innych kolorach zawierają inne gazy lub ich mieszaniny.
Naukowcy badali charakterystyczny różowy kolor wyładowania gazowego tworzonego przez gaz wodorowy. Kiedy wąska wiązka tego światła była oglądana przez pryzmat, światło zostało rozdzielone na cztery linie o bardzo określonych długościach fal (i częstotliwościach, ponieważ ∗lambda i ∗nu są odwrotnie proporcjonalne). Widmo emisyjne atomu to układ linii utworzony, gdy światło przechodzi przez pryzmat w celu rozdzielenia go na różne częstotliwości światła, które zawiera. Poniższy rysunek przedstawia atomowe widmo emisyjne wodoru.
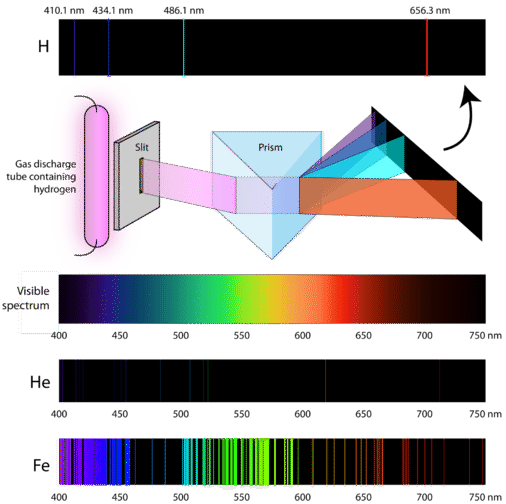
Teoria klasyczna nie była w stanie wyjaśnić istnienia atomowych widm emisyjnych, zwanych też widmami liniowo-emisyjnymi. Zgodnie z fizyką klasyczną atom w stanie podstawowym byłby w stanie zaabsorbować dowolną ilość energii, a nie tylko dyskretne ilości. Podobnie, gdy atomy powracają do niższego stanu energetycznego, dowolna ilość energii może zostać uwolniona. Wynikiem tego byłoby to, co jest znane jako widmo ciągłe, gdzie wszystkie długości fal i częstotliwości są reprezentowane. Białe światło widziane przez pryzmat i tęcza są przykładami widm ciągłych. Atomowe widma emisyjne były kolejnym dowodem na skwantyfikowaną naturę światła i doprowadziły do powstania nowego modelu atomu opartego na teorii kwantowej.