Tendencje okresowe
Po pierwsze, skupimy się na poszczególnych atomach i zastanowimy się nad tendencjami związanymi z pozycją pierwiastka w układzie okresowym. Jako pierwszych modeli użyjemy prostych związków organicznych: etanu, metyloaminy i etanolu, ale koncepcje te odnoszą się również do bardziej złożonych biomolekuł o tych samych funkcjach, na przykład łańcuchów bocznych aminokwasów: alaniny (alkan), lizyny (amina) i seryny (alkohol).
Horyzontalny trend okresowy w kwasowości i zasadowości:
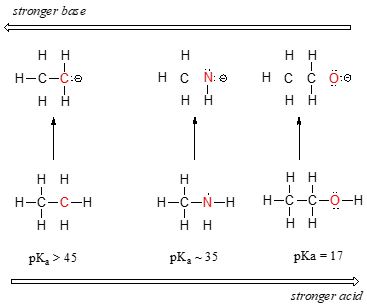
Możemy zauważyć wyraźny trend w kwasowości, gdy poruszamy się od lewej do prawej wzdłuż drugiego rzędu układu okresowego od węgla do azotu do tlenu. Kluczem do zrozumienia tego trendu jest rozważenie hipotetycznej zasady sprzężonej w każdym przypadku: im bardziej stabilna (słabsza) zasada sprzężona, tym silniejszy kwas. Zwróć uwagę, gdzie kończy się ujemny ładunek w każdej sprzężonej zasadzie. W sprzężonej zasadzie etanu ujemny ładunek jest przeniesiony przez atom węgla, podczas gdy w sprzężonych zasadach metyloaminy i etanolu ujemny ładunek znajduje się odpowiednio na azocie i tlenie. Zapamiętaj z sekcji 2.4A, że elektronegatywność również wzrasta, gdy poruszamy się od lewej do prawej wzdłuż rzędu układu okresowego, co oznacza, że tlen jest najbardziej elektronegatywny z trzech atomów, a węgiel najmniej.
Uwaga
Im bardziej elektronegatywny atom, tym lepiej jest on w stanie przenosić ładunek ujemny. Słabsze zasady mają ładunki ujemne na bardziej elektronegatywnych atomach; silniejsze zasady mają ładunki ujemne na mniej elektronegatywnych atomach.
Tak więc, anion mettlenkowy jest najbardziej stabilny (najniższa energia, najmniej zasadowy) z trzech sprzężonych zasad, a anion karbanionu etylowego jest najmniej stabilny (najwyższa energia, najbardziej zasadowy). I odwrotnie, etanol jest najsilniejszym kwasem, a etan najsłabszym kwasem.
Przesuwając się pionowo w obrębie danej kolumny układu okresowego, ponownie obserwujemy wyraźny trend okresowy w kwasowości. Najlepiej widać to na przykładzie halokwasów i halogenków: zasadowość, podobnie jak elektronegatywność, wzrasta wraz z przesuwaniem się w górę kolumny.
Pionowy trend okresowy w kwasowości i zasadowości:

Odwrotnie, kwasowość w halokwasach wzrasta w miarę przesuwania się w dół kolumny.
Aby nadać sens tej tendencji, rozważymy jeszcze raz stabilność zasad sprzężonych. Ponieważ fluor jest najbardziej elektronegatywnym pierwiastkiem halogenowym, moglibyśmy oczekiwać, że fluorek będzie również najmniej zasadowym jonem halogenowym. Ale w rzeczywistości jest on najmniej stabilny i najbardziej zasadowy! Okazuje się, że kiedy poruszamy się pionowo w układzie okresowym, wielkość atomu ma pierwszeństwo przed jego elektroujemnością, jeśli chodzi o zasadowość. Promień atomowy jodu jest około dwa razy większy niż fluoru, więc w jonie jodkowym ładunek ujemny jest rozłożony na znacznie większą objętość:

To ilustruje podstawową koncepcję w chemii organicznej:
Ładunki elektrostatyczne, czy to dodatnie czy ujemne, są bardziej stabilne, gdy są „rozłożone” na większym obszarze.
Spotkamy się z tą ideą wielokrotnie podczas naszych badań nad reaktywnością organiczną, w wielu różnych kontekstach. Na razie zastosujemy tę koncepcję tylko do wpływu promienia atomowego na siłę zasady. Ponieważ fluorki są najmniej stabilne (najbardziej zasadowe) spośród sprzężonych zasad halogenkowych, HF jest najmniej kwaśnym z halokwasów, tylko nieznacznie silniejszym od kwasu karboksylowego. HI, z \(pK_a\) około -9, jest prawie tak silny jak kwas siarkowy.
Co ważniejsze dla badania biologicznej chemii organicznej, trend ten mówi nam, że tiole są bardziej kwaśne niż alkohole. Na przykład, \(pK_a\) grupy tiolowej na łańcuchu bocznym cysteiny wynosi około 8,3, podczas gdy \(pK_a\) dla grupy alkoholowej na łańcuchu bocznym seryny jest rzędu 17.
Pamiętasz pojęcie „siły napędowej”, które zostało wprowadzone w sekcji 6.2? Przypomnijmy, że siła napędowa reakcji jest zwykle oparta na dwóch czynnikach: względnej stabilności ładunku i względnej całkowitej energii wiązania. Zobaczmy jak to się odnosi do prostej reakcji kwasowo-zasadowej pomiędzy kwasem solnym a jonem fluorkowym:
Wiemy, że HCl (pK_a) -7) jest silniejszym kwasem niż HF (pK_a) 3.2), więc równowaga dla tej reakcji leży po stronie produktu: reakcja jest egzergoniczna, a „siła napędowa” popycha reagent do produktu.
Co wyjaśnia tę siłę napędową? Rozważmy najpierw czynnik ładunku: jak właśnie się dowiedzieliśmy, jon chlorkowy (po stronie produktu) jest bardziej stabilny niż jon fluorkowy (po stronie reagenta). To częściowo wyjaśnia siłę napędową przechodzenia od reaktanta do produktu w tej reakcji: przechodzimy od mniej stabilnego jonu do bardziej stabilnego jonu.
Co z całkowitą energią wiązań, innym czynnikiem w sile napędowej? Jeśli spojrzysz na tabelę energii wiązań, zobaczysz, że wiązanie H-F po stronie produktu jest bardziej energetyczne (silniejsze) niż wiązanie H-Cl po stronie reagenta: odpowiednio 570 kJ/mol vs 432 kJ/mol). To również przyczynia się do siły napędowej: przechodzimy od słabszego (mniej stabilnego) wiązania do silniejszego (bardziej stabilnego).