24th Annual Glaucoma Report
Przejdź do poniższych linków, aby przeczytać inne artykuły z corocznej aktualizacji na temat jaskry:
Glaucoma Care with Laser Precision
MIGS Madness: An Atlas of Options
Comanaging Invasive Glaucoma Surgeries
Glaucoma: Lifestyles of the Antioxidant Rich and Famous (Earn 2 CE Credits)
Eksperci nie osiągnęli jeszcze konsensusu w sprawie powszechnie akceptowanej etiologii jaskry. Są jednak zgodni co do tego, że obniżenie ciśnienia wewnątrzgałkowego (intraocular pressure, IOP) jest jedynym modyfikowalnym czynnikiem ryzyka spowalniającym jej postęp. Farmakoterapia miejscowa jest tradycyjną metodą pierwszego rzutu, a możliwości wyboru są większe niż kiedykolwiek.
Ten artykuł, część trzecia naszej serii Take Charge of Glaucoma, omawia wiele leków, które mogą stosować lekarze POZ, wraz z poradami dotyczącymi tego, kiedy należy stosować daną terapię u poszczególnych pacjentów.
Wczesna autonomia
Leki działające na autonomiczny układ nerwowy (tj, cholinergiki i adrenergiki) stanowią podstawę terapii jaskry od XIX wieku.1,2 Cholinergiki wywołują miozę, która rozciąga i stymuluje siatkę trabekularną (TM), zwiększając odpływ cieczy wodnistej do niej i do kanału Schlemmsa.3 Do tej klasy leków należą pilokarpina, karbachol, fizostygmina, neostygmina i ekotiofan. Spośród nich tylko pilokarpina jest nadal w rutynowym użyciu. Leczenie wykazuje odpowiedź zależną od dawki z obniżeniem ciśnienia wewnątrzgałkowego o około 20%, gdy jest przepisywane QID.4
Take Charge of Glaucoma
Przejdź do poniższych linków, aby przeczytać inne artykuły z naszej czteroczęściowej serii dotyczącej jaskry:
Część pierwsza: Glaucoma: A Primary Care Crusade
Część druga: Przygotuj swój zestaw narzędzi diagnostycznych
Część czwarta: Play a Part in Postoperative Glaucoma Care
Aczkolwiek skuteczne, stosowanie leków cholinergicznych jest ograniczone przez ich oczne i ogólnoustrojowe działania niepożądane. Należą do nich skurcz mięśnia rzęskowego (z towarzyszącym bólem głowy i indukowaną krótkowzrocznością), mioza, toksyczność rogówki, zaczerwienienie, zapalenie błony naczyniowej oka, możliwe tworzenie się zaćmy, depresja oddechowa i zaburzenia żołądkowo-jelitowe. Ponadto nowsze leki mają większą skuteczność w obniżaniu ciśnienia wewnątrzgałkowego, co sprawia, że leki cholinergiczne są zarezerwowane dla szczególnych przypadków, w których efekt miotyczny może przynieść dodatkowe korzyści, takie jak ostre zamknięcie kąta.
Agoniści adrenergiczni, z drugiej strony, wpływają na receptory adrenergiczne alfa lub beta (lub oba, jeśli są nieselektywne). Epinefryna, podstawowy nieselektywny środek, obniża IOP poprzez zmniejszenie produkcji wody, a następnie zwiększenie odpływu przez TM.5Niestety, ma ona ograniczone zastosowanie ze względu na znaczące ogólnoustrojowe działania niepożądane. Dipivefrin, prolek epinefryny opracowany w latach 70-tych, umożliwia stosowanie znacznie niższych stężeń związku macierzystego, z mniejszymi efektami ogólnoustrojowymi.6 Nieselektywne adrenergetyki są obecnie stosowane w minimalnym zakresie, z wyjątkiem przypadków, w których inne leki mogą być przeciwwskazane.
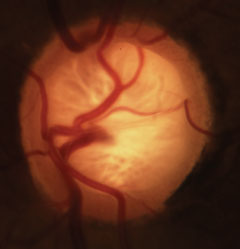
Jaskrawo-migdałkowe zapalenie wnętrza gałki ocznej z charakterystyczną utratą obrzeża neurosiatkówkowego, blaszki i zmianami w naczyniach. Kliknij na obraz, aby powiększyć.
Beta-blokery
Antagoniści adrenergiczni, lub beta (β)-blokery, hamują wytwarzanie cieczy wodnistej i stanowią standard, według którego porównywane są nowe leki. Leki te mogą być nieselektywne, co oznacza, że hamują obie izoformy receptorów β-adrenergicznych (β1 i β2), lub kardioselektywne, które mają znacznie większe powinowactwo do receptora β1. β2 jest dominującym adrenoreceptorem oka, dlatego środki nieselektywne będą miały większy wpływ na kontrolę IOP.9,10
Topowe β-blokery obejmują timolol, lewobunolol, metipranolol, karteolol i betaksolol. Tylko betaksolol jest kardioselektywny, co czyni go pomocnym w pewnych przeciwwskazaniach, ale może być mniej skuteczny w zmniejszaniu IOP.11β-blokery zmniejszają IOP o 20% do 30% i mogą być dawkowane dwa razy dziennie. Mogą być również podawane raz na dobę, szczególnie w przypadku stosowania roztworów żelowych ze względu na dłuższy czas kontaktu z okiem.12,13 Działanie antagonistów adrenergicznych może być słabsze w czasie snu, dlatego należy zachować ostrożność, gdy β-blokery są podawane blisko pory snu, szczególnie jeśli są przepisywane raz na dobę.14,15 Jeśli pacjenci przyjmują ogólnoustrojowe β-blokery, hipotensyjne działanie miejscowych β-blokerów na oczy jest zmniejszone i można rozważyć zastosowanie innych klas leków miejscowych.16
Chociaż tej klasy leków należy unikać głównie w schorzeniach płucnych lub kardiologicznych, w wybranych przypadkach rozsądne może być rozważenie terapii beta-blokerami. Powinno się to jednak odbywać za zgodą odpowiedniego specjalisty (kardiologa lub pulmonologa).
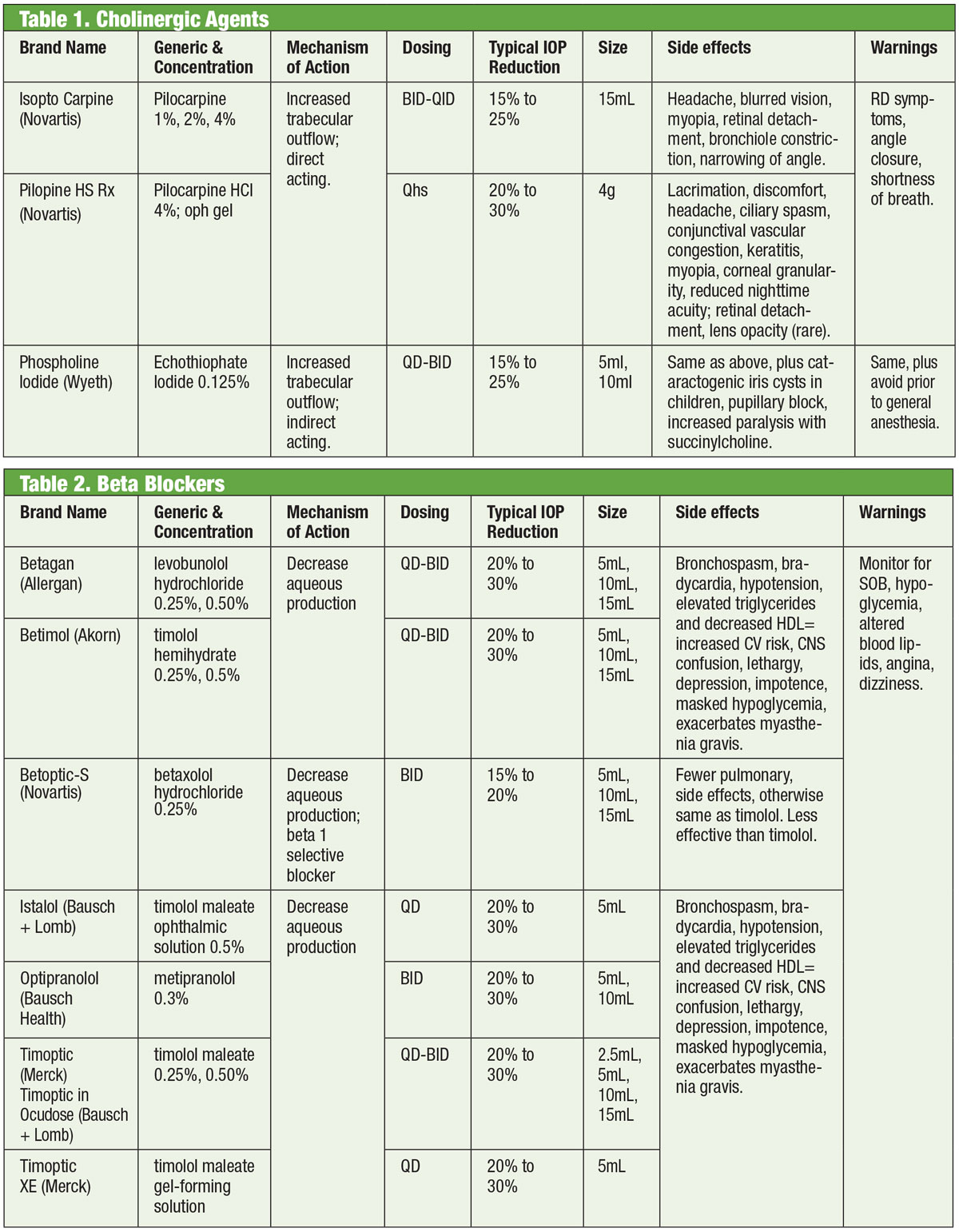
Tabele: Bruce Onofrey, OD, RPh. Kliknij obraz, aby powiększyć.
Ogólnie jednak należy unikać stosowania β-blokerów u osób z blokiem przedsionkowo-komorowym, bradykardią zatokową i obturacyjną chorobą płuc.17.
Inhibitory anhydrazy węglowej
Badacze uznali zdolność doustnych inhibitorów anhydrazy węglowej (CAI) do obniżania ciśnienia wewnątrzgałkowego od lat 50. ubiegłego wieku.18 Osiągają to poprzez hamowanie wytwarzania wody.18 Jednak ogólnoustrojowe działania niepożądane (takie jak zmęczenie, zaburzenia żołądkowo-jelitowe i parestezje) ograniczają ich przewlekłe stosowanie w jaskrze.18 Doustne CAI są nadal stosowane w przypadkach, gdy miejscowe CAI powodują nadwrażliwość lub gdy stosowanie kropli jest wykluczone, a także w przypadkach ostrego zamknięcia kąta.18 Próby opracowania odmiany miejscowej zakończyły się sukcesem – w połowie lat 90. wprowadzono dorzolamid, a wkrótce potem brynzolamid.19
Istnieje co najmniej siedem różnych izoenzymów anhydrazy węglowej (CA), przy czym CA-II w wyrostkach rzęskowych jest głównie zaangażowany w wytwarzanie cieczy wodnistej.18 Zarówno dorzolamid, jak i brynzolamid są silnymi inhibitorami tego izoenzymu, ale mają kilka istotnych klinicznie różnic. Na przykład pH dorzolamidu wynosi 5,6 pH, a brinzolamidu 7,5 pH. Dodatkowo, brynzolamid jest dostępny w postaci zawiesiny. Są to tylko niektóre z właściwości, które mogą odpowiadać za indywidualne działania niepożądane produktów, które mogą obejmować kłucie w przypadku dorzolamidu i niewyraźne widzenie w przypadku brynzolamidu.19
Chociaż leki te są oznaczone przez FDA do dawkowania TID, niektórzy lekarze decydują się na podawanie BID. W przypadku brynzolamidu badania III fazy donoszą o klinicznie równoważnym obniżeniu IOP przy stosowaniu schematów BID lub TID.20 Inni donoszą o braku statystycznie istotnych różnic między dawkowaniem BID lub TID w przypadku dorzolamidu.18 Alternatywnie, inni zalecają dawkowanie TID w monoterapii i dawkowanie BID, gdy lek jest stosowany jako terapia wspomagająca.21
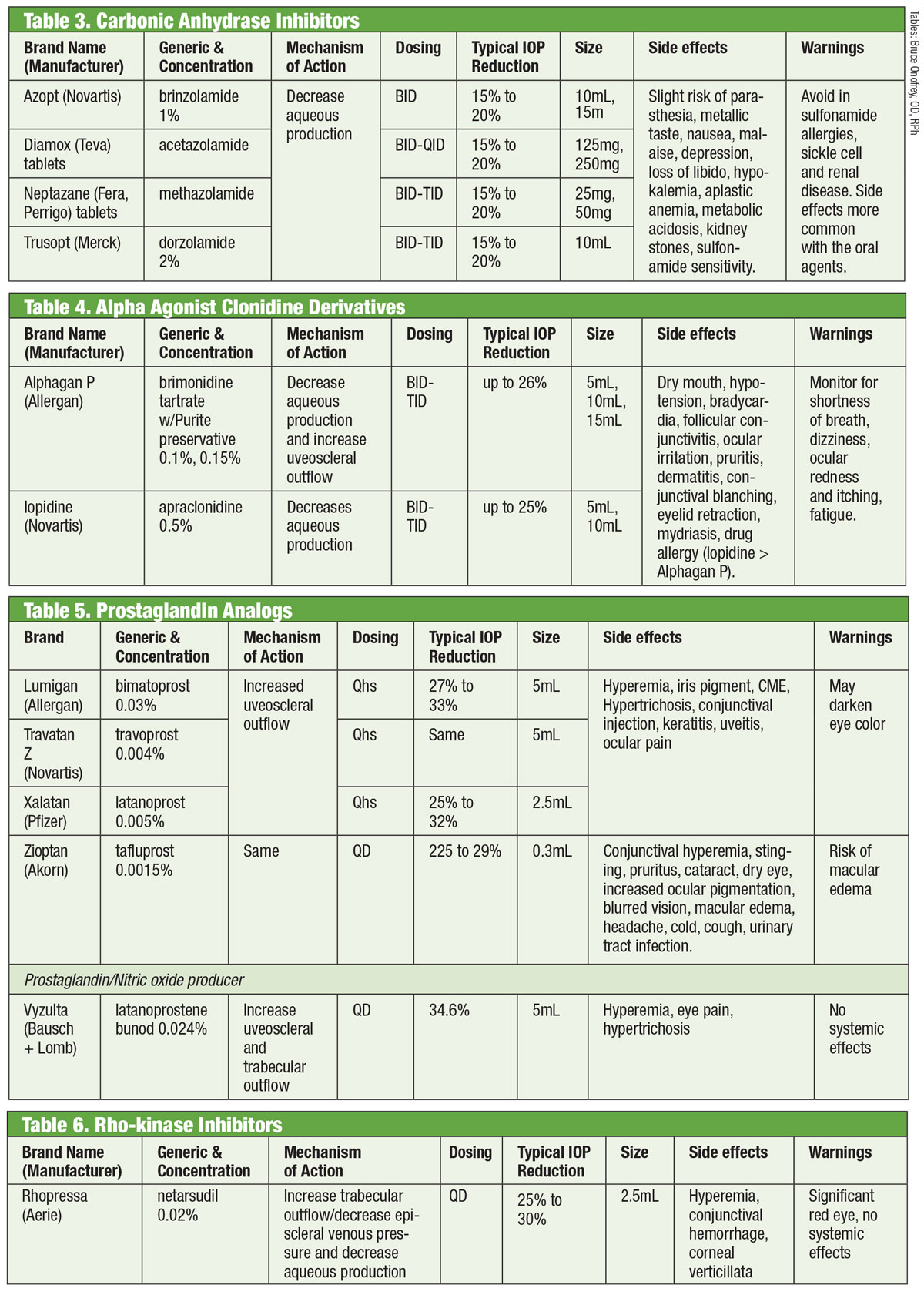
Tabele: Bruce Onofrey, OD, RPh. Kliknij obrazek, aby powiększyć.
Agoniści alfa
Klonidyna była najwcześniejszym agonistą alfa (AA) skutecznym w obniżaniu IOP. Jednak nawet w postaci miejscowej powodowała głębokie ogólnoustrojowe działania niepożądane, takie jak bradykardia, sedacja i hipotensja.22 Zastąpienie grupy amidowej apraklonidyny zmniejszyło penetrację bariery krew-mózg, a tym samym działania niepożądane. Niestety, zmniejszająca się z czasem skuteczność i zwiększona częstość występowania alergii ocznej ograniczają ją do krótkotrwałego stosowania.
The Straight Dope
Medyczna marihuana stała się ostatnio bardzo popularna dzięki licznym zmianom legislacyjnym w Stanach Zjednoczonych. Chociaż jest ona badana jako metoda obniżenia ciśnienia wewnątrzgałkowego od lat 70-tych, badacze odkryli, że jest ona zdolna do obniżenia ciśnienia wewnątrzgałkowego tylko na krótki okres czasu. To, w połączeniu z dość poważnym profilem skutków ubocznych, czyni go słabym kandydatem do leczenia. Jednakże, badania mówią, że może mieć rolę do odegrania dla „pacjentów w końcowym stadium jaskry, którzy zawiedli maksymalną terapię medyczną i operację lub którzy są słabymi kandydatami do operacji.”
Sun X, Xu C, Chadha N,et al. Marijuana for glaucoma: a recipe for disaster or treatment? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Chociaż działania niepożądane w większości korelują ze stosowaniem prostaglandyn, w literaturze można znaleźć informacje o wywołanym przez brimonidynę zapaleniu przedniego odcinka błony naczyniowej.25 Czas trwania wahał się od siedmiu dni do pięciu lat, ze średnią wynoszącą prawie 20 miesięcy.
Analogi prostaglandyn
Zapewniają one najsilniejsze obniżenie ciśnienia wewnątrzgałkowego spośród wszystkich kropli poprzez zwiększenie uveoscleral aqueous outflow. Analogi prostaglandyn (PGA) wiążą się z receptorami w ciele rzęskowym i wywołują rozluźnienie mięśni gładkich oraz zmieniają macierz zewnątrzkomórkową w obrębie mięśnia rzęskowego, zwiększając odpływ cieczy wodnistej drogami naczyniówkowymi.26 PGA, podawane raz dziennie, zwykle w porze snu, obniżają ciśnienie wewnątrzgałkowe o 30% do 35%; do wyboru są latanoprost, bimatoprost, travoprost i tafluprost (podawane w pojedynczej dawce, bez konserwantów).26 Najczęstszym działaniem niepożądanym PGA jest przekrwienie spojówek, często w ciągu pierwszych kilku tygodni po rozpoczęciu terapii.26 Może również wystąpić podrażnienie oka, zaostrzenie istniejących stanów zapalnych (obrzęk plamki, zapalenie tęczówki), zanik okołogałkowej poduszeczki tłuszczowej, pigmentacja skóry okołooczodołowej, rzęs i tęczówki oraz hipertrychoza.26
Nowym wariantem w kategorii analogów prostaglandyn jest latanoprosten bunod 0,024%. Związek ten ma podwójny mechanizm działania: zwiększenie odpływu pęcherzykowego i zwiększenie odpływu przez siatkówkę trabekularną poprzez wpływ tlenku azotu.27 Oko rozkłada latanoprosten bunod dwukrotnie, aby uzyskać składniki aktywne: kwas latanoprostowy i tlenek azotu.28 Ten ostatni wpływa na szlak sygnalizacyjny. Ten ostatni wpływa na szlak sygnałowy, który rozluźnia elementy kurczliwe w TM, co zwiększa odpływ.28 Dodatkowy wpływ spada IOP >1mm Hg vs. latanoprost sam w wielu punktach czasowych, z całkowitą redukcją IOP od 7,5mm Hg do 9,1mm Hg. Efekty uboczne z latanoprostenem bunod były porównywalne do tych z samym latanoprostem, z prawdopodobnie mniejszą pigmentacją okołogałkową i hipertrichozą, według badaczy.28,29
Inhibitory KRK
W normalnym oku, główną drogą drenażu dla cieczy wodnistej jest TM. Opór dla wodnistego humoru przez tę strukturę jest zwiększony u pacjentów z jaskrą, podnosząc IOP.30 Do niedawna leki przeciwjaskrowe nie były ukierunkowane na tę strukturę. Zmieniło się to w 2017 roku wraz z wprowadzeniem leku Rhopressa (netarsudil 0,02%, Aerie), inhibitora kinazy rho (ROCK).
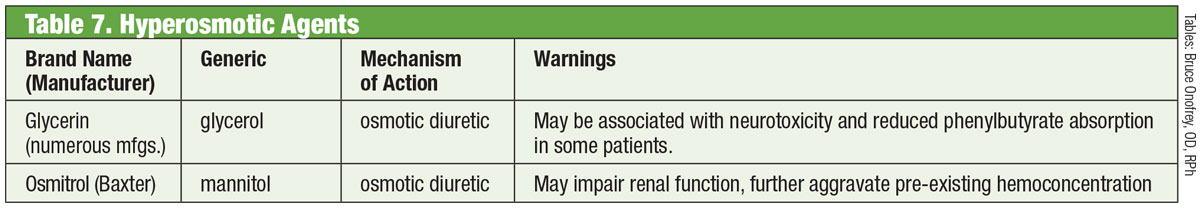
Tabela: Bruce Onofrey, OD, RPh. Kliknij obraz, aby powiększyć.
Rho-kinaza ulega szerokiej ekspresji w wielu tkankach, w tym w TM, gdzie promuje składanie włókien naprężenia aktyny i reguluje skurcz komórek.31. Inhibitory ROCK zwiększają odpływ cieczy wodnistej poprzez zmniejszenie skurczu komórek napędzanego przez aktyny i miozyny oraz zmniejszenie produkcji białek macierzy zewnątrzkomórkowej.32 Rhopressa działa również hamująco na transporter noradrenaliny (NET), co czyni ją inhibitorem ROCK/NET. Mechanizm działania NET może być wynikiem zmniejszonego przepływu krwi do ciała rzęskowego poprzez skurcz naczyń wywołany noradrenaliną, co skutkuje zmniejszeniem wytwarzania cieczy wodnistej.33 Ponadto netarsudil zmniejsza również zewnątrzgałkowe ciśnienie żylne (EVP), zapewniając w ten sposób wiele dróg do obniżenia ciśnienia wewnątrzgałkowego.32 Najczęstszym ocznym działaniem niepożądanym jest przekrwienie oka (u około połowy leczonych pacjentów), które w większości przypadków jest łagodne, przemijające i ustępuje samoistnie.32
Na uwagę zasługuje fakt, że samo rho odgrywa ważną rolę we wzroście i prowadzeniu aksonów, a także w regulacji przeżycia i śmierci neuronów.34 Badacze odkryli, że po uszkodzeniu nerwu wzrokowego miejscowe stosowanie netarsudilu zmniejsza śmierć komórek zwojowych siatkówki i sprzyja regeneracji aksonów.34
Zastosowanie
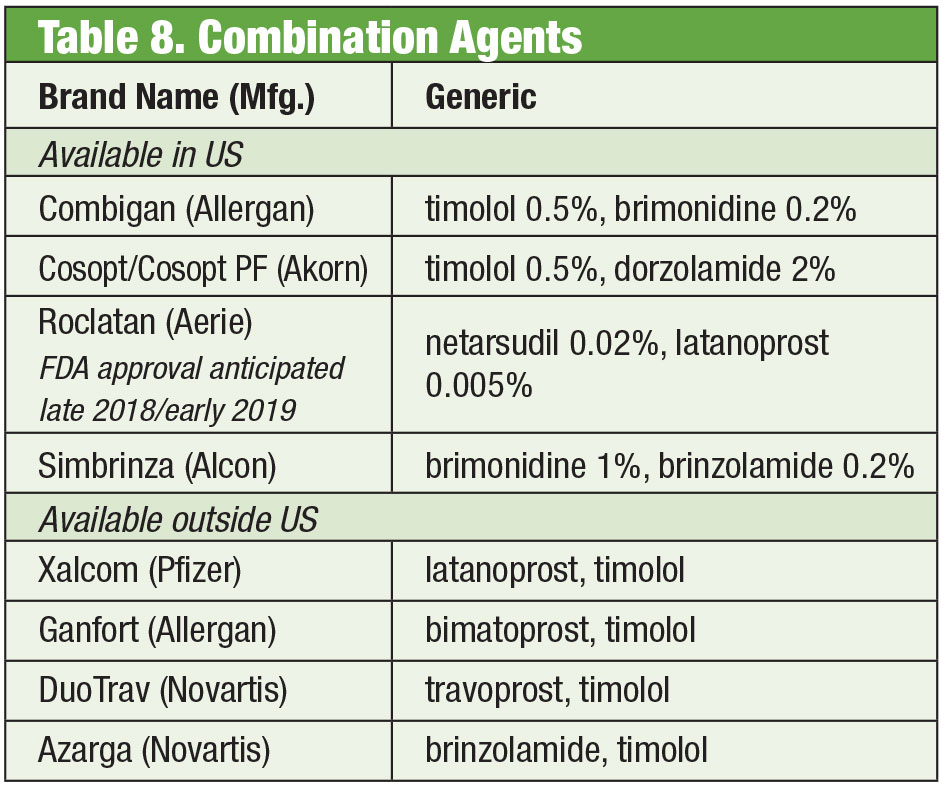
Czasami pacjenci potrzebują więcej niż oferują produkty dostępne na rynku. Wrażliwość pacjenta lub toksyczność powierzchni oka spowodowana przewlekłym stosowaniem środków konserwujących może prowadzić do poszukiwania alternatywnych rozwiązań. Niektóre leki złożone są dostępne bez konserwantów. Jeśli przestrzeganie zaleceń jest problemem, mieszanki te mogą zawierać do czterech leków w jednej butelce. Ponadto wiele stałych kombinacji było skutecznie stosowanych poza Stanami Zjednoczonymi, ale nie są one obecnie zatwierdzone przez FDA; compounding daje amerykańskim lekarzom dostęp do tych schematów. Jeśli koszt jest ograniczeniem, preparaty złożone mogą być dodatkową zaletą. Chociaż produkt złożony często nie jest objęty planem ubezpieczeniowym pacjenta, cena jednego lub dwóch produktów złożonych może być bardziej opłacalna niż cena wielu pojedynczych leków, nawet preparatów generycznych. Dwie apteki oferujące preparaty złożone oferują wiele gotowych wariantów: Simple Drops z Imprimis Pharmaceuticals i linia prodcut Omni z Ocular Science. Dodatkowe dostosowanie jest możliwe od każdego, too.
Ale chociaż poszczególne środki są zatwierdzone przez FDA, szczególne kombinacje mogą nie być. Od lekarza zależy, czy zważy ryzyko i korzyści wynikające z przestrzegania przepisów.
Złożone produkty przeciwjaskrowe:
Krople Imprimis (Imprimis Pharmaceuticals)
Wszystkie dostępne bez konserwantów.
– Tim-Lat PF (timolol/latanoprost)
– Brim-Dor PF (brimonidyna/dorzolamid)
– Tim-Brim-Dor PF (timolol/brimonidyna/dorzolamid)
– Tim-Dor-Lat PF (timolol/dorzolamid/latanoprost)
– Tim-Brim-Dor-Lat PF (timolol/brinzolamid/dorzolamid/latanoprost)
– Dor-Tim (dorzolamid/timolol)
– Dorzolamid PF
– Latanoprost PF
Omni Drops (Ocular Science)
Zawierają chlorek benzalkoniowy, ale w niższych stężeniach (0.001%) niż popularne preparaty generyczne (0,002%).
– Timolol/latanoprost
– Timolol/brimonidyna/dorzolamid (formuła AM)*
– Timolol/brimonidyna/dorzolamid/latanoprost (formuła PM)*
* Przeznaczone do stosowania łącznie, przy czym wersja AM nie zawiera prostaglandyny, która jest powszechnie dawkowana tylko raz na dobę.
Stałe produkty łączone
Mimo skuteczności tych pojedynczych produktów, wielu pacjentów z jaskrą często wymaga stosowania wielu terapii w celu kontrolowania stanu zdrowia.35 Jeśli konieczna jest podwójna terapia, najlepszym rozwiązaniem może być stosowanie tego samego dozownika, co sprzyja lepszemu przestrzeganiu zaleceń i zmniejsza wpływ toksyczności na powierzchnię oka.36 Timolol występuje w połączeniu z brimonidyną (jako Combigan, Allergan) i dorzolamidem (jako Cosopt, Akorn), obydwa są dawkowane dwa razy na dobę, przy czym dla produktu timolol-dorzolamid dostępna jest opcja bez konserwantów. Inne połączenie dwa razy dziennie – Simbrinza – łączy brimonidynę i dorzolamid. Stałe kombinacje wykazują dobrą skuteczność zarówno jako terapia podstawowa, jak i jako uzupełnienie PGA. Działania niepożądane są porównywalne z poszczególnymi składnikami.
Przestrzeganie/percepcja pacjenta
Pomimo że decyzja o zaleceniu leczenia może być złożona i zależy od wielu czynników, gdy lekarz i pacjent zgadzają się na rozpoczęcie terapii, należy uznać pewne fakty i zastosować podstawowe zasady.
Kliknij obrazek, aby powiększyć.
Postęp pola widzenia i nasilenie choroby jest związane ze słabym przestrzeganiem zaleceń.37 Pacjenci cierpiący na przewlekłe schorzenia wykorzystują średnio od 30% do 70% przepisanych im dawek leków, a 50% z nich odstawia leki w ciągu pierwszych kilku miesięcy terapii, jak wynika z jednego z badań.38 Przestrzeganie zaleceń dotyczących leków stosowanych w jaskrze jest podobnie słabe jak w przypadku innych schorzeń przewlekłych.38 W związku z tym może istnieć luka między skutecznością a efektywnością, gdzie mimo udowodnienia skuteczności leków miejscowych w dużych badaniach klinicznych, w praktyce mogą one być nieskuteczne z powodu nieprzestrzegania zaleceń przez pacjentów.39
Główne czynniki, które przyczyniają się do słabego przestrzegania zaleceń w jaskrze, to między innymi: profil działań niepożądanych leków, koszty terapii, edukacja pacjentów oraz relacje lekarz-pacjent.40 Ponadto choroba może przebiegać bezobjawowo aż do późnego stadium, przy braku świadomości utraty pola widzenia.41
And Now For Something Completely Different
Medykamenty stanowią podstawę leczenia jaskry od ponad wieku, a prace nad nowymi lekami trwają nieprzerwanie. Jednak niektórzy badacze szukają alternatywy poza butelką. Okulary osadzone w cewce elektromagnetycznej, w połączeniu z soczewką kontaktową zawierającą ślad złota, mogą pewnego dnia pomóc obniżyć IOP. Opracowane przez firmę o nazwie Bionode, combo jest przeznaczone do generowania prądu elektrycznego, który przepływa przez mięśnie rzęskowe, aby stymulować naturalną drogę drenażu i zmniejszyć IOP.
American Academy of Ophthalmology. Eyeglasses may one day treat glaucoma. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Accessed July 3, 2018.
Dodatkową barierą w przestrzeganiu zaleceń są trudności z instylacją kropli i schematem dawkowania.42 W rzeczywistości do 80% pacjentów zanieczyszcza swoje krople, dotykając twarzy, do 61% nie instyluje dokładnie jednej kropli i, co najbardziej krytyczne, do 37% nie trafia kroplą do oka.43 Lekarz prowadzący nigdy nie powinien zakładać, że pacjent jest biegły w instylacji kropli. Przed rozpoczęciem terapii kroplami należy nauczyć pacjenta, jak prawidłowo wkroplić krople i poprosić go o zademonstrowanie poprawnego wkroplenia przed opuszczeniem gabinetu. Można to skutecznie przekazać technikowi optometrycznemu i wzmocnić za pomocą ulotki edukacyjnej na temat techniki (plik PDF do wydrukowania pod adresem www.glaucoma.org/treatment/eyedrop-tips.php), a także za pomocą filmów wideo, takich jak ten wyprodukowany przez Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Jeśli pacjent ma znaczne trudności z podawaniem kropli do oczu, mechaniczne urządzenie wspomagające dozowanie może zwiększyć prawdopodobieństwo sukcesu. Przestrzeganie prawidłowego schematu dawkowania poprawia się dzięki zastosowaniu automatycznych przypomnień opartych na telekomunikacji, aplikacji przypominających na smartfony i tablety.44,45 Połączenie edukacji w gabinecie, wyznaczania celów, uproszczonego schematu podawania kropli i technologii powinno być stosowane w celu poprawy przestrzegania zaleceń.46 Zajęcie się znanymi barierami w przestrzeganiu zaleceń jest koniecznym pierwszym krokiem do sukcesu.
Obniżanie ciśnienia
IOP jest jedynym znanym modyfikowalnym czynnikiem ryzyka jaskry i niezaprzeczalnie udowodniono, że jego obniżenie zmniejsza ryzyko progresji choroby.47,48 Skuteczne obniżenie IOP staje się więc celem podczas prowadzenia pacjentów z jaskrą. Po dokładnym sklasyfikowaniu choroby zwykle ustala się cel terapeutyczny. Preferowane schematy postępowania w Stanach Zjednoczonych sugerują stosowanie docelowego zakresu ciśnienia wewnątrzgałkowego, który zdaniem klinicysty prospektywnie zmniejszy u pacjenta ryzyko ślepoty w ciągu całego życia, a jednocześnie zminimalizuje obciążenie związane z leczeniem.49-52
Ale wiele metodologii może pomóc w określeniu początkowego docelowego ciśnienia wewnątrzgałkowego (progowe ciśnienie wewnątrzgałkowe, obliczone, jeden rozmiar dla wszystkich), najprostszą i opartą na dowodach metodą jest obniżenie ciśnienia wewnątrzgałkowego o pewien procent w stosunku do podstawowego szczytowego dziennego ciśnienia wewnątrzgałkowego, przy którym dochodzi do uszkodzenia nerwu wzrokowego. IOP jest dynamiczne i wykazuje krótko- i długoterminowe fluktuacje, co sprawia, że obecnie dostępna tonometria nie jest idealnie powtarzalna. Dlatego zaleca się, aby przed rozpoczęciem leczenia klinicysta uzyskał wiele odczytów ciśnienia wewnątrzgałkowego o różnych porach dnia, aby spróbować ustalić dzienny szczyt ciśnienia wewnątrzgałkowego, na podstawie którego można ustalić docelowy zakres.53-55 Jednak w przypadku braku uzyskania wielu 24-godzinnych krzywych ciśnienia wewnątrzgałkowego jest mało prawdopodobne, aby kiedykolwiek udało się uchwycić prawdziwy szczyt. Klinicysta będzie musiał ostatecznie ocenić skuteczność leczenia poprzez zmniejszenie tempa progresji w badaniach strukturalnych i czynnościowych.48,56,57
Zalecane docelowe procentowe obniżenie IOP wynosi od 20% do 50% w zależności od stanu (tzn, podejrzenie jaskry, nadciśnienie oczne, jaskra z normalnym napięciem, jaskra z wysokim napięciem, jaskra z zamknięciem kąta), wyjściowej ciężkości choroby i oczekiwanej długości życia.58-61
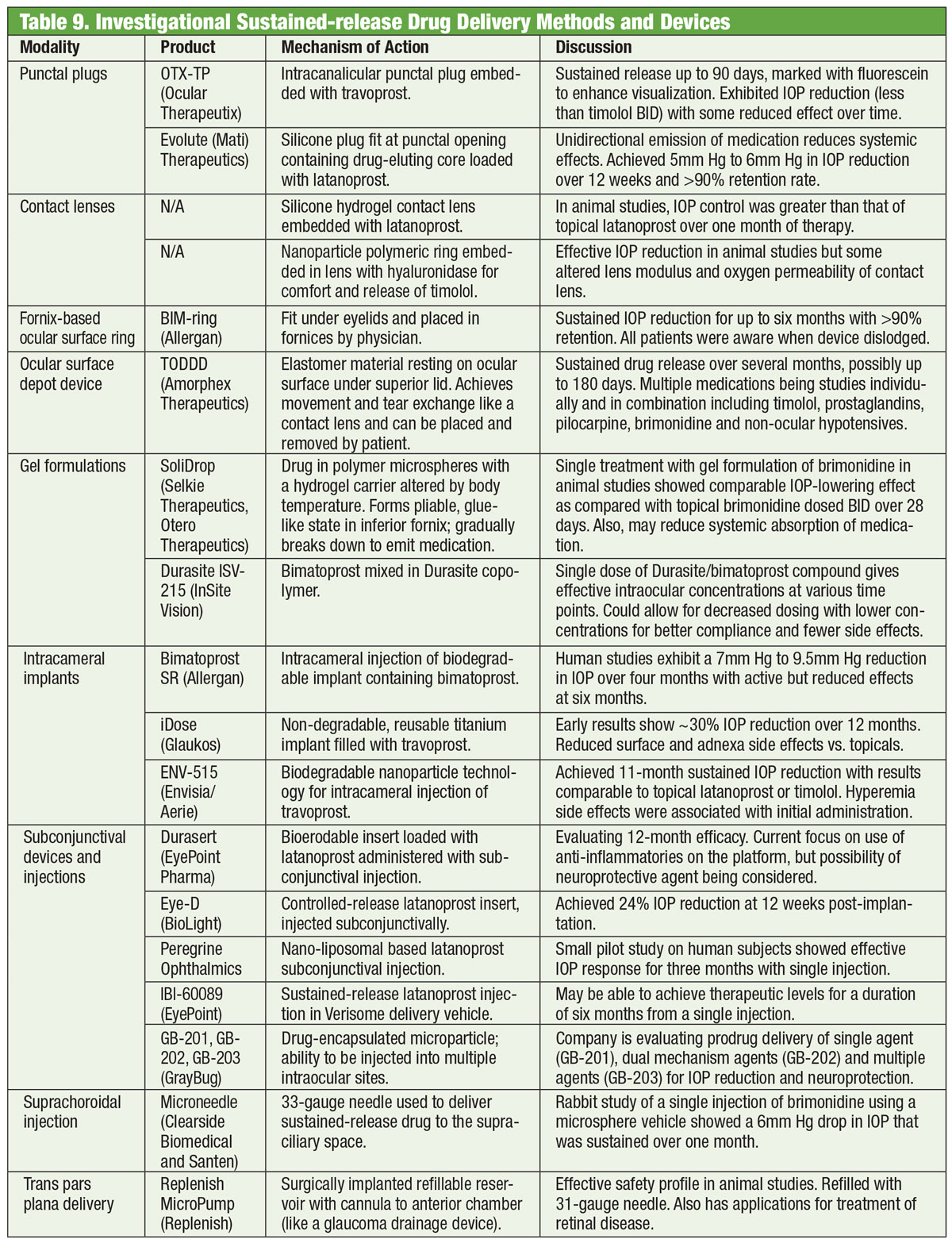
Tabela: Bruce Onofrey, OD, RPh. Kliknij obraz, aby powiększyć.
Getting Started
PGA są zatwierdzone do leczenia pierwszego rzutu w Stanach Zjednoczonych i są bardziej skuteczne w obniżaniu IOP, mają stosunkowo ograniczony profil działań niepożądanych i są dawkowane rzadziej (raz dziennie) niż inne klasy leków.62,63
Po wybraniu konkretnego środka pacjent powinien być ponownie widziany za nie więcej niż cztery tygodnie, aby ocenić skuteczność kropli, zapobiec wszelkim zdarzeniom niepożądanym, które mogą się pojawić, zapewnić przestrzeganie zaleceń przez pacjenta i wzmocnić wartość leczenia.
Ultimately, proper education and vigilant follow-up with structural and functional testing will help minimize vision loss.
Dr Dorkowski jest klinicznym koordynatorem programu Nursing Home/Assisted Living w SCO.
Dr Williamson jest opiekunem rezydentury w Memphis VA Medical Center.
Dr Rixon jest uczestnikiem w Memphis VA i jest członkiem Optometric Glaucoma Society.
Dr. Onofrey jest autorem książki The Ocular Therapeutics Handbook.
1. Zimmerman TJ, William P. BogerIII. The beta-adrenergic blocking agents and the treatment of glaucoma. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. A history of glaucoma pharmacology. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Direct effects of muscarinic agents on the outflow pathways in human eyes. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. The mechanism of action of adrenergic drugs in glaucoma. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl epinephrine: a new pro-drug in the treatment of glaucoma. Ophthalmology. 1978;85(3):268-75.
7. Neufeld AH. Experimental studies on the mechanism of action of timolol. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. The mechanism of timolol in lowering intraocular pressure: In the normal eye. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Beta adrenergic receptors in pigmented ciliary processes. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Distribution and properties of beta-adrenergic receptors in human iris-ciliary body. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. A double-masked comparison of betaxolol vs timolol in the treatment of open-angle glaucoma. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Oftalmiczne beta-blokery od czasu timololu. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Evaluation of timolol in chronic open-angle glaucoma: Once a day vs twice a day. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Effects of timolol, epinephrine, and acetazolamide on aqueous flow during sleep. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Circadian intraocular pressure variation with beta-blockers. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Effects of systemic beta-blocker therapy on the efficacy and safety of topical brimonidine and timolol. Brimonidine Study Groups 1 and 2. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaucoma and systemic diseases. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Pharmacological and ocular hypotensive properties of topical carbonic anhydrase inhibitors. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Topical drug delivery to the eye: dorzolamide. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamide ophthalmic suspension: a review of its pharmacology and use in the treatment of open angle glaucoma and ocular hypertension. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Comparison of the additive intraocular pressure-lowering effect of latanoprost and dorzolamide when added to timolol in patients with open-angle glaucoma or ocular hypertension: a randomized, open-label, multicenter study in Greece. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Incidence of brimonidine allergy in patients previously allergic to apraclonidine. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Effectiveness and safety of brimonidine as adjunctive therapy for patients with elevated intraocular pressure in a large, open-label community trial. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidine-purite 0,1% versus brimonidine-purite 0,15% twice daily in glaucoma or ocular hypertension: a 12-month randomized trial. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidine induced anterior uveitis. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Update on the mechanism of action of topical prostaglandins for intraocular pressure reduction. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Efficacy of latanoprostene bunod 0.024% compared with timolol 0.5% in lowering intraocular pressure over 24 hours. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprostene bunod ophthalmic solution 0,024% for IOP lowering in glaucoma and ocular hypertension. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Comparison of latanoprostene bunod 0,024% and timolol maleate 0,5% in open-angle glaucoma or ocular hypertension: The LUNAR study. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. The trabecular meshwork: A basic review of form and function. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Dostęp 29 czerwca 2018 r.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Discovery of the ROCK inhibitor netarsudil for the treatment of open-angle glaucoma. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Two phase 3 clinical trials comparing the safety and efficacy of netarsudil to timolol in patients with elevated intraocular pressure: rho kinase elevated iop treatment trial 1 and 2 (ROCKET-1 and ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Discovery and preclinical development of netarsudil, a novel ocular hypotensive agent for the treatment of glaucoma. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. Topical administration of a rock/net inhibitor promotes retinal ganglion cell survival and axon regeneration after optic nerve injury. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Adjunctive therapy patterns in glaucoma patients using prostaglandin analogs. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Fixed combinations. Glaucoma Today. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. Do adherence rates and glaucomatous visual field progression correlate? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Using pharmacy claims data to study adherence to glaucoma medications: methodology and findings of the Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Effectiveness of intraocular pressure-lowering medication determined by washout. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Why do people (still) go blind from glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. A view on glaucoma-Are we seeing it clearly? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. The most common barriers to glaucoma medication adherence: A cross-sectional survey. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Drop instillation and glaucoma. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automated telecommunication-based reminders and adherence with once-daily glaucoma medication dosing: The automated dosing reminder study. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: Interest of patients and their caregivers in a smartphone-based and tablet-based glaucoma application. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Attributes associated with adherence to glaucoma medical therapy and its effects on glaucoma outcomes: An evidence-based review and potential strategies to improve adherence. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. New perspectives on target intraocular pressure. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalizing intraocular pressure: Target intraocular pressure in the setting of 24-hour intraocular pressure monitoring. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Target pressure in glaucoma therapy (Ciśnienie docelowe w terapii jaskry). J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Opieka nad pacjentem z jaskrą z otwartym kątem przesączania. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Early aggressive intraocular pressure lowering, target intraocular pressure, and a novel concept for glaucoma care. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Diurnal intraocular pressure patterns are not repeatable in the short term in healthy individuals. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Long-term reproducibility of diurnal intraocular pressure patterns in patients with glaucoma. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Day-to-day variability in intraocular pressure in glaucoma and ocular hypertension. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Reduction of Intraocular Pressure and Glaucoma Progression: Results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. The advanced glaucoma intervention study (AGIS): The relationship between control of intraocular pressure and visual field deterioration. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Visual field progression in the collaborative initial glaucoma treatment study. The impact of treatment and other baseline factors. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost w leczeniu jaskry. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impact of the introduction of generic latanoprost on glaucoma medication adherence. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. A randomised, controlled comparison of latanoprostene bunod and latanoprost 0,005% in the treatment of ocular hypertension and open angle glaucoma: The VOYAGER study. Br J Ophthalmol. 2015;99(6):738-45.