Learning Objectives
- Opisać właściwości gazu.
Trzy wspólne fazy (lub stany) materii to gazy, ciecze i ciała stałe. Gazy mają najmniejszą gęstość z tych trzech, są bardzo ściśliwe i całkowicie wypełniają każdy pojemnik, w którym są umieszczone. Gazy zachowują się w ten sposób, ponieważ ich siły międzycząsteczkowe są stosunkowo słabe, więc ich cząsteczki stale poruszają się niezależnie od innych cząsteczek. Z kolei ciała stałe są stosunkowo gęste, sztywne i nieściśliwe, ponieważ ich siły międzycząsteczkowe są tak silne, że molekuły są w zasadzie zablokowane w miejscu. Ciecze są stosunkowo gęste i nieściśliwe, podobnie jak ciała stałe, ale łatwo dostosowują się do kształtu swoich pojemników, podobnie jak gazy. Można zatem stwierdzić, że suma sił międzycząsteczkowych w cieczach znajduje się pomiędzy siłami występującymi w gazach i ciałach stałych. Rysunek 10.1.1 porównuje te trzy stany materii i ilustruje różnice na poziomie molekularnym.
Rysunek 10.1.1 Substancja okrzemkowa (O2) w stanie stałym, ciekłym i gazowym
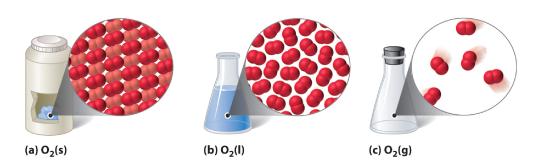
(a) O2 w stanie stałym ma stałą objętość i kształt, a molekuły są ciasno upakowane razem. (b) Ciekły O2 dostosowuje się do kształtu swojego pojemnika, ale ma stałą objętość; zawiera stosunkowo gęsto upakowane cząsteczki. (c) Gazowy O2 wypełnia swój pojemnik całkowicie – niezależnie od wielkości i kształtu pojemnika – i składa się z szeroko rozdzielonych cząsteczek.
Stan danej substancji zależy silnie od warunków. Na przykład, H2O jest powszechnie spotykany we wszystkich trzech stanach: stały lód, ciekła woda i para wodna (jego postać gazowa). W większości warunków spotykamy wodę jako ciecz, która jest niezbędna do życia; pijemy ją, gotujemy z nią i kąpiemy się w niej. Kiedy temperatura jest wystarczająco niska, by zamienić ciecz w lód, możemy jeździć na nartach lub łyżwach, pakować ją do kuli śnieżnej lub rożka śnieżnego, a nawet budować z niej domy. Para wodnaRóżnica między gazem a parą jest subtelna: termin „para” odnosi się do gazowej formy substancji, która w normalnych warunkach (25°C, 1,0 atm) jest cieczą lub ciałem stałym. Azot (N2) i tlen (O2) są więc określane jako gazy, natomiast woda w postaci gazowej w atmosferze nazywana jest parą wodną. jest składnikiem powietrza, którym oddychamy, i powstaje zawsze, gdy podgrzewamy wodę do gotowania jedzenia lub parzenia kawy czy herbaty. Para wodna o temperaturze wyższej niż 100°C nazywana jest parą. Para jest używana do napędzania dużych maszyn, w tym turbin, które wytwarzają energię elektryczną. Właściwości trzech stanów skupienia wody są podsumowane w tabeli 10.1.1
Struktura geometryczna oraz właściwości fizyczne i chemiczne atomów, jonów i cząsteczek zazwyczaj nie zależą od ich stanu skupienia; poszczególne cząsteczki wody w lodzie, wodzie ciekłej i parze wodnej, na przykład, są identyczne. W przeciwieństwie do tego, makroskopowe właściwości substancji zależy silnie od jej stanu fizycznego, który jest określony przez siły międzycząsteczkowe i warunki, takie jak temperatura i ciśnienie.
Rysunek 10.1.2 pokazuje lokalizacje w układzie okresowym tych pierwiastków, które są powszechnie spotykane w stanie gazowym, ciekłym i stałym. Z wyjątkiem wodoru, pierwiastki, które występują naturalnie jako gazy, znajdują się po prawej stronie układu okresowego. Spośród nich wszystkie gazy szlachetne (grupa 18) są gazami jednoatomowymi, podczas gdy inne gazowe pierwiastki są cząsteczkami dwuatomowymi (H2, N2, O2, F2 i Cl2). Tlen może również tworzyć drugi alotrop, wysoce reaktywną trójatomową cząsteczkę ozonu (O3), która również jest gazem. Z kolei brom (Br2) i rtęć (Hg) są cieczami w normalnych warunkach (25°C i 1,0 atm, powszechnie określanych jako „temperatura i ciśnienie pokojowe”). Gal (Ga), który topi się w temperaturze zaledwie 29,76°C, można zamienić w ciecz po prostu trzymając pojemnik z nim w dłoni lub trzymając go w nieklimatyzowanym pomieszczeniu w gorący letni dzień. Pozostałe pierwiastki w normalnych warunkach są ciałami stałymi.
Figure 10.1.2 Elements That Occurly Naturally as Gases, Liquids, and Solids at 25°C and 1 atm
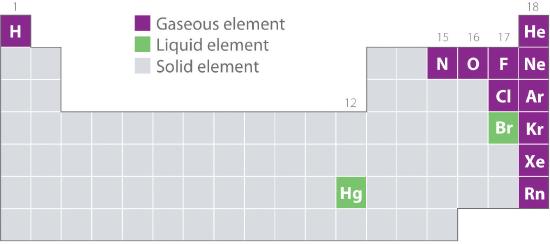
Gazy szlachetne i rtęć występują jako gatunki jednoatomowe, podczas gdy wszystkie inne gazy i brom są cząsteczkami dwuatomowymi.
Wiele pierwiastków i związków chemicznych, z którymi mieliśmy do tej pory do czynienia, występuje zazwyczaj jako gazy; niektóre z bardziej powszechnych są wymienione w tabeli 10.1.2 . Do substancji gazowych należy wiele wodorków dwuskładnikowych, takich jak halogenki wodoru (HX); wodorki chalkogenów; wodorki pierwiastków grupy 15 – N, P i As; wodorki pierwiastków grupy 14 – C, Si i Ge; oraz diboran (B2H6). Ponadto, wiele prostych kowalencyjnych tlenków niemetali to gazy, takie jak CO, CO2, NO, NO2, SO2, SO3 i ClO2. Wiele związków organicznych o małej masie cząsteczkowej również jest gazami, w tym wszystkie węglowodory z czterema lub mniejszą liczbą atomów węgla oraz proste cząsteczki takie jak eter dimetylowy, chlorek metylu (CH3Cl), formaldehyd (CH2O) i aldehyd octowy (CH3CHO). Wreszcie, czynniki chłodnicze, takie jak chlorofluorowęglowodory (CFC) i wodorochlorofluorowęglowodory (HCFC) są gazami, które można łatwo skroplić przez sprężanie, a z kolei ciecze można zamienić w gazy przez obniżenie ciśnienia cieczy. Zmiana fazy z cieczy w gaz w rurkach wewnątrz lodówki powoduje chłodzenie, podczas gdy sprężanie w wężownicach na dole lub z tyłu lodówki ogrzewa pomieszczenie. Amoniak i SO2 to inne ściśliwe gazy, które były używane jako czynniki chłodnicze, ale nie mogą być stosowane w domach ze względu na ich trującą naturę. Amoniak jest nadal używany jako czynnik chłodniczy w dużych obiektach komercyjnych ze względu na jego wydajność i niski koszt.
Wszystkie wymienione wcześniej substancje gazowe (poza monatomowymi gazami szlachetnymi) zawierają wiązania kowalencyjne lub polarne i są cząsteczkami niepolarnymi lub polarnymi. W przeciwieństwie do tego, silne elektrostatyczne atrakcje w związkach jonowych, takich jak NaBr (temperatura wrzenia = 1390 ° C) lub LiF (temperatura wrzenia = 1673 ° C), uniemożliwiają im istnieć jako gazy w temperaturze pokojowej i ciśnienia. Ponadto, najlżejsi członkowie danej rodziny związków są najprawdopodobniej gazami, a temperatury wrzenia związków polarnych są zazwyczaj wyższe niż temperatury wrzenia związków niepolarnych o podobnej masie cząsteczkowej. Dlatego też, w danej serii związków, najlżejsze i najmniej polarne człony są najprawdopodobniej gazami. Ze stosunkowo nielicznymi wyjątkami, jednakże związki o więcej niż około pięciu atomach z okresu 2 lub niższego są zbyt ciężkie, aby istnieć jako gazy w normalnych warunkach.
Zauważ wzór
Substancje gazowe często zawierają kowalencyjne lub polarne wiązania kowalencyjne, istnieją jako cząsteczki niepolarne lub lekko polarne, mają stosunkowo niskie masy cząsteczkowe i zawierają pięć lub mniej atomów z okresu 1 lub 2.
Choć gazy mają szeroki wachlarz zastosowań, uważa się, że szczególnie ponure zastosowanie substancji gazowej zostało wykorzystane przez Persów w rzymskim mieście Dura we wschodniej Syrii w trzecim wieku naszej ery. Persowie wykopali tunel pod murami miasta, aby wejść do miasta i je podbić. Archeologiczne dowody sugerują, że kiedy Rzymianie odpowiedzieli kontr tunelami, by przerwać oblężenie, Persowie zapalili bitum i kryształy siarki, wytwarzając gęsty, trujący gaz. Prawdopodobnie miechy lub kominy rozprowadzały toksyczne opary. Szczątki około 20 rzymskich żołnierzy zostały odkryte u podstawy murów miejskich przy wejściu do tunelu o wysokości mniejszej niż 2 m i długości 11 m. Ponieważ jest bardzo mało prawdopodobne, że Persowie mogli zabić tak wielu Rzymian przy wejściu do tak ciasnej przestrzeni, archeolodzy spekulują, że starożytni Persowie użyli wojny chemicznej, aby skutecznie zdobyć miasto.
Przykład 10.1.1
Które związki przewidziałbyś jako gazy w temperaturze pokojowej i pod ciśnieniem?
- cykloheksen
- węglan litu
- cyklobutan
- tlenek wanadu(III)
- kwas benzoesowy (C6H5CO2H)
Dane: związki
Pytanie o: stan fizyczny
Strategia:
A Rozstrzygnij, czy każdy związek jest jonowy czy kowalencyjny. Związek jonowy jest najprawdopodobniej ciałem stałym w temperaturze pokojowej i ciśnieniu, podczas gdy związek kowalencyjny może być ciałem stałym, cieczą lub gazem.
B Wśród związków kowalencyjnych, te które są stosunkowo niepolarne i mają małe masy cząsteczkowe są najprawdopodobniej gazami w temperaturze pokojowej i ciśnieniu.
Rozwiązanie:
A Węglan litu to Li2CO3, zawierający jony Li+ i CO32-, a tlenek wanadu(III) to V2O3, zawierający jony V3+ i O2-. Oba są głównie związkami jonowymi, które powinny być ciałami stałymi. Pozostałe trzy związki są wszystkie kowalencyjne.
B Kwas benzoesowy ma więcej niż cztery atomy węgla i jest polarny, więc nie jest prawdopodobne, aby być gazem. Zarówno cykloheksen, jak i cyklobutan są cząsteczkami zasadniczo niepolarnymi, ale cyklobutan (C4H8) ma znacznie mniejszą masę cząsteczkową niż cykloheksen (C6H10), który znów ma więcej niż cztery atomy węgla. Przewidujemy zatem, że cyklobutan jest najprawdopodobniej gazem w temperaturze pokojowej i pod ciśnieniem, podczas gdy cykloheksen jest cieczą. W rzeczywistości, z temperaturą wrzenia tylko 12°C, w porównaniu z 83°C dla cykloheksenu, cyklobutan jest rzeczywiście gazem w temperaturze pokojowej i pod ciśnieniem.
Ćwiczenie
Które związki przewidziałbyś jako gazy w temperaturze pokojowej i pod ciśnieniem?
- n-butanol
- fluorek amonu (NH4F)
- ClF
-
tlenek etylenu
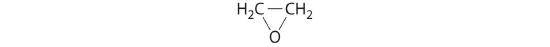
- HClO4
Podpowiedź: c; d
Podsumowanie
Ciało stałe może istnieć w trzech stanach skupienia: gazowym, ciekłym i stałym. Gazy mają najmniejszą gęstość z tych trzech stanów, są bardzo ściśliwe i całkowicie wypełniają swoje pojemniki. Pierwiastki, które istnieją jako gazy w temperaturze pokojowej i pod ciśnieniem są zgrupowane po prawej stronie układu okresowego; występują jako gazy jednoatomowe (gazy szlachetne) lub cząsteczki dwuatomowe (niektóre chlorowce, N2, O2). Wiele związków nieorganicznych i organicznych z czterema lub mniejszą liczbą atomów niewodoru jest również gazami w temperaturze i ciśnieniu pokojowym. Wszystkie substancje gazowe charakteryzują się słabymi oddziaływaniami między cząsteczkami składowymi lub atomami.
Key Takeaway
- Cząsteczki w substancjach gazowych często zawierają wiązania kowalencyjne lub polarne, są cząsteczkami niepolarnymi lub lekko polarnymi i mają stosunkowo małe masy cząsteczkowe.
Problemy pojęciowe
-
Wyjaśnij różnice między mikroskopowymi i makroskopowymi właściwościami materii. Czy temperatura wrzenia związku jest właściwością mikroskopową czy makroskopową? masa cząsteczkowa? Why?
-
Determine whether the melting point, the dipole moment, and electrical conductivity are macroscopic or microscopic properties of matter and explain your reasoning.
-
How do the microscopic properties of matter influence the macroscopic properties? Czy można odnieść masę cząsteczkową do temperatury wrzenia? Dlaczego tak lub dlaczego nie? Czy polarność może być związana z temperaturą wrzenia?
-
Dla substancji, która ma fazy gazowe, ciekłe i stałe, ułóż te fazy w kolejności rosnącej
- gęstości.
- siła oddziaływań międzycząsteczkowych.
- ściśliwości.
- ruchu molekularnego.
- porządku w ułożeniu cząsteczek lub atomów.
-
Wyjaśnij, co jest nie tak w tym stwierdzeniu: „Stan skupienia materii w dużym stopniu decyduje o właściwościach molekularnych substancji.”
-
Opisać najważniejsze czynniki, które decydują o stanie skupienia danego związku. Jakie warunki zewnętrzne wpływają na to, czy substancja występuje w którymś z trzech stanów skupienia materii?
-
Które pierwiastki z układu okresowego występują jako gazy w temperaturze i ciśnieniu pokojowym? Które z nich są cząsteczkami dwuatomowymi, a które jednomolekularnymi? Które pierwiastki w temperaturze pokojowej i pod ciśnieniem są cieczami? Która część układu okresowego zawiera pierwiastki, których wodorki dwuskładnikowe są najprawdopodobniej gazami w temperaturze pokojowej?
-
Czy poniższe spostrzeżenie jest prawdziwe? „Prawie wszystkie niemetalowe wodorki binarne są gazami w temperaturze pokojowej, ale wodorki metali są wszystkie ciałami stałymi”. Wyjaśnij swoje rozumowanie.
-
Czy poniższe spostrzeżenie jest poprawne? „Wszystkie wodorki chalkogenów są gazami w temperaturze pokojowej i pod ciśnieniem, z wyjątkiem wodorku dwusiarczkowego tlenu, który jest cieczą.” Wyjaśnij swoje rozumowanie. Czy spodziewałbyś się, że 1-chloropropan jest gazem? jodopropan? Dlaczego?
-
Wyjaśnij, dlaczego związki jonowe nie są gazami w normalnych warunkach.
Odpowiedzi
-
-
-
.
-
-
Właściwości molekularne substancji kontrolują jej stan skupienia w danych warunkach, a nie na odwrót. Obecność silnych sił międzycząsteczkowych sprzyja skondensowanemu stanowi skupienia materii (ciecz lub ciało stałe), natomiast bardzo słabe oddziaływania międzycząsteczkowe sprzyjają stanowi gazowemu. Ponadto kształt cząsteczek dyktuje, czy faza skondensowana jest cieczą czy ciałem stałym.
-
-
Pierwiastki, które istnieją jako gazy, występują głównie w prawym górnym rogu i po prawej stronie układu okresowego. Następujące pierwiastki występują jako gazy: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe i Rn. Tak więc połowa halogenów, wszystkie gazy szlachetne oraz najlżejsze chalkogeny i piknogeny są gazami. Spośród nich wszystkie, z wyjątkiem gazów szlachetnych, istnieją jako cząsteczki dwuatomowe. Tylko dwa pierwiastki występują w postaci cieczy w normalnej temperaturze pokojowej 20-25°C: rtęć i brom. W prawej górnej części układu okresowego znajduje się również większość pierwiastków, których wodorki dwuskładnikowe są gazami. Ponadto wodorki dwuskładnikowe pierwiastków z grup 14-16 są gazami.
-
-
-
.