Structural instability of enzymes
Fakt, że miejsca aktywne są tak dobrze przystosowane do zapewnienia specyficznych warunków środowiskowych oznacza również, że podlegają one wpływom lokalnego środowiska. Prawdą jest, że zwiększenie temperatury środowiska ogólnie zwiększa szybkość reakcji, katalizowanej enzymatycznie lub w inny sposób. Jednakże, zwiększanie lub zmniejszanie temperatury poza optymalnym zakresem może wpłynąć na wiązania chemiczne w obrębie miejsca aktywnego w taki sposób, że będą one gorzej dostosowane do wiązania substratów. Wysoka temperatura powoduje, że enzymy, podobnie jak inne cząsteczki biologiczne, ulegają denaturacji, czyli procesowi, który zmienia naturalne właściwości substancji. Podobnie, pH lokalnego środowiska może również wpływać na funkcjonowanie enzymów. Reszty aminokwasowe w miejscu aktywnym mają swoje własne kwaśne lub zasadowe właściwości, które są optymalne dla katalizy. Reszty te są wrażliwe na zmiany pH, które mogą zaburzać sposób wiązania cząsteczek substratów. Enzymy są przystosowane do najlepszego funkcjonowania w określonym zakresie pH i, podobnie jak w przypadku temperatury, skrajne wartości pH (kwaśne lub zasadowe) środowiska mogą powodować denaturację enzymów.
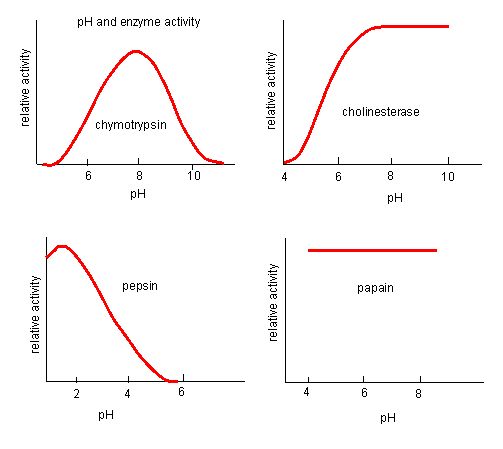
Rysunek 4. Enzymy mają optymalne pH. pH, przy którym enzym jest najbardziej aktywny, to pH, przy którym grupy R w miejscu aktywnym są protonowane/deprotonowane w taki sposób, że substrat może wejść do miejsca aktywnego i może rozpocząć się początkowy etap reakcji. Niektóre enzymy wymagają bardzo niskiego pH (kwaśnego), aby być całkowicie aktywnymi. W organizmie człowieka enzymy te znajdują się najprawdopodobniej w dolnej części żołądka, lub zlokalizowane są w lizosomach (organelle komórkowe służące do trawienia dużych związków wewnątrz komórki).
Źródło: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Proces, w którym enzymy ulegają denaturacji zazwyczaj rozpoczyna się od odwijania struktury trzeciorzędowej poprzez destabilizację wiązań utrzymujących strukturę trzeciorzędową razem. Wiązania wodorowe, jonowe i kowalencyjne (mostki disulfidowe i wiązania peptydowe) mogą być zakłócone przez duże zmiany temperatury i pH. Korzystając z poniższego wykresu aktywności enzymów i temperatury, opracuj historię energetyczną dla czerwonego enzymu. Wyjaśnij, co może się dziać od 37 °C do 95 °C.
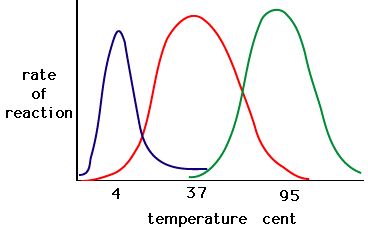
Rysunek 5. Enzymy mają swoją optymalną temperaturę. Temperatura, w której enzym jest najbardziej aktywny, będzie zazwyczaj temperaturą, w której struktura enzymu jest stabilna lub nieulegająca uszkodzeniu. Niektóre enzymy wymagają określonej temperatury, aby pozostać aktywnymi i nie ulegać denaturacji. Źródło: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Pasowanie a funkcja enzymu
Przez wiele lat naukowcy uważali, że wiązanie enzym-substrat zachodziło w prosty sposób „zamek-klucz”. Ten model twierdził, że enzym i substrat pasują do siebie idealnie w jednym natychmiastowym kroku. Jednakże, obecne badania wspierają bardziej wyrafinowany pogląd zwany indukowanym dopasowaniem. Model „induced-fit” rozszerza model „lock-and-key” opisując bardziej dynamiczną interakcję pomiędzy enzymem i substratem. Gdy enzym i substrat zbliżają się do siebie, ich interakcja powoduje łagodną zmianę w strukturze enzymu, która potwierdza bardziej produktywny układ wiązania pomiędzy enzymem a stanem przejściowym substratu. To energetycznie korzystne wiązanie maksymalizuje zdolność enzymu do katalizowania jego reakcji.
Gdy enzym wiąże swój substrat, powstaje kompleks enzym-substrat. Kompleks ten obniża energię aktywacji reakcji i sprzyja jej szybkiemu przebiegowi na jeden z wielu sposobów. Na podstawowym poziomie, enzymy promują reakcje chemiczne, w których bierze udział więcej niż jeden substrat, poprzez łączenie substratów w optymalnej orientacji. Odpowiedni region (atomy i wiązania) jednej cząsteczki jest zestawiony z odpowiednim regionem innej cząsteczki, z którą musi reagować. Innym sposobem, w jaki enzymy promują reakcję swoich substratów, jest stworzenie korzystnego energetycznie środowiska w miejscu aktywnym, aby reakcja mogła zajść. Niektóre reakcje chemiczne mogą przebiegać najlepiej w środowisku lekko kwaśnym lub niepolarnym. Właściwości chemiczne, które wynikają ze szczególnego układu reszt aminokwasowych w miejscu aktywnym, tworzą energetycznie korzystne środowisko dla specyficznych substratów enzymu do reakcji.
Energia aktywacji wymagana dla wielu reakcji obejmuje energię zaangażowaną w nieznaczne zniekształcenie wiązań chemicznych, aby mogły łatwiej reagować. Enzymatyczne działanie może wspomóc ten proces. Kompleks enzym-substrat może obniżyć energię aktywacji poprzez zniekształcenie cząsteczek substratu w taki sposób, aby ułatwić rozerwanie wiązania. Wreszcie, enzymy mogą również obniżyć energię aktywacji poprzez udział w samej reakcji chemicznej. Reszty aminokwasowe mogą dostarczać pewnych jonów lub grup chemicznych, które faktycznie tworzą wiązania kowalencyjne z cząsteczkami substratów jako niezbędny etap procesu reakcji. W takich przypadkach należy pamiętać, że po zakończeniu reakcji enzym zawsze powraca do swojego pierwotnego stanu. Jedną z charakterystycznych właściwości enzymów jest to, że pozostają one ostatecznie niezmienione przez reakcje, które katalizują. Po zakończeniu katalizowania reakcji przez enzym, uwalnia on swój produkt(y).
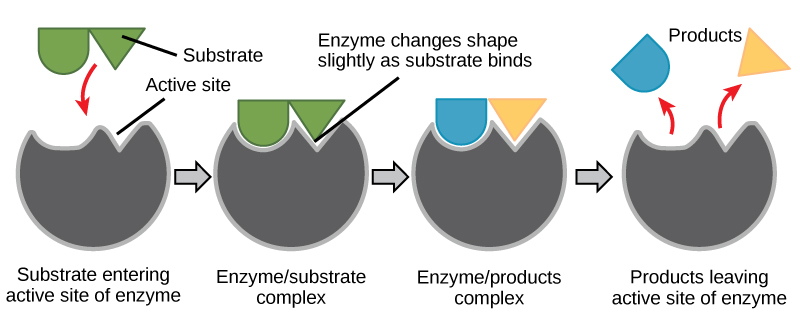
Rysunek 6. Zgodnie z modelem induced-fit, zarówno enzym jak i substrat ulegają dynamicznym zmianom konformacyjnym po związaniu. Enzym przekształca substrat w jego stan przejściowy, zwiększając tym samym szybkość reakcji.
Tworzenie historii energetycznej dla powyższej reakcji
Korzystając z rysunku 6, odpowiedz na pytania postawione w historii energetycznej.
1. Co to są reaktanty? Jakie są produkty?
2. Jaką pracę wykonał enzym?
3. W jakim stanie znajduje się energia na początku? W jaki stan przekształca się energia w stanie końcowym? To może być jeszcze trudne, ale spróbuj określić, gdzie znajduje się energia w stanie początkowym i końcowym.
.