US Pharm.2008;33(11):Epub.
Dysfunkcja seksualna kobiet (FSD) jest bardzo rozpowszechnionym zaburzeniem wpływającym na jakość życia kobiet w ciągu całego życia i na całym świecie. W Stanach Zjednoczonych, zgodnie z wynikami National Health and Social Life Survey, prawie 43% kobiet poniżej 60. roku życia doświadcza pewnego rodzaju dysfunkcji seksualnych.1 Wiadomo, że zaburzenia funkcji seksualnych nasilają się wraz z wiekiem, po wystąpieniu menopauzy. Około 52,4% kobiet w okresie naturalnej menopauzy – szacuje się, że 16 milionów kobiet w wieku 50 lat i starszych – może być dotkniętych niskim pożądaniem seksualnym i objawami FSD.2 Inne choroby współistniejące to cukrzyca, nadciśnienie tętnicze, choroby układu sercowo-naczyniowego, nowotwory, zabiegi chirurgiczne (zwłaszcza operacje dna miednicy) i stosowanie niektórych leków.3 Pełne zrozumienie kontinuum objawów FSD jest niezbędne do zrozumienia funkcji różnych opcji leczenia, które farmaceuci mogą zalecać pacjentom z tym złożonym schorzeniem.
Klasyfikacja kobiecych zaburzeń seksualnych
Według Amerykańskiej Fundacji Chorób Urologicznych i Amerykańskiego Towarzystwa Psychiatrycznego kobiece zaburzenia seksualne można podzielić na cztery szerokie kategorie: zaburzenia zmniejszonego pożądania i awersji seksualnej, podniecenia, orgazmu i bólu seksualnego powodującego osobiste cierpienie.4,5 Zaburzenia zmniejszonego pożądania i awersji seksualnej charakteryzują się uporczywym brakiem wyobrażeń seksualnych, fantazji i receptywności lub całkowitym unikaniem aktywności seksualnej. Niezdolność do osiągnięcia lub utrzymania podniecenia seksualnego (objawy takie jak zmniejszona lub nieobecna lubrykacja pochwy, czucie i rozluźnienie mięśni pochwy) są związane z zaburzeniami podniecenia seksualnego. Nawracające lub uporczywe opóźnienie lub niezdolność do osiągnięcia orgazmu pomimo wystarczającej stymulacji definiuje zaburzenia orgazmu. Dyspareunia (ból narządów płciowych związany ze stosunkiem płciowym) i waginizm (mimowolne skurcze mięśni pochwy, które przeszkadzają w penetracji) są charakterystyczne dla zaburzeń bólu seksualnego u niektórych kobiet. Co ważne, te przejawy FSD można przypisać różnym przyczynom psychologicznym, fizycznym i medycznym, które muszą być zidentyfikowane przed podjęciem skutecznego leczenia.
Przyczyny FSD
Etiologia FSD jest wieloczynnikowa. Ogólny stan fizyczny i psychiczny; wcześniejsze doświadczenia seksualne; poziom stresu, wykształcenie i zatrudnienie; status socjoekonomiczny; tożsamość kulturowa i etniczna; dynamika związku; obecność i stan zdrowia partnera – wszystkie te czynniki wpływają na tożsamość seksualną kobiety i określają jej zwykłe zachowania seksualne. Skróconą listę czynników związanych z każdym z różnych typów FSD przedstawiono w TABELI 1.6,20
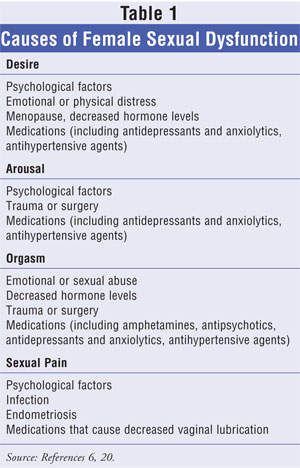
Czynniki psychologiczne związane z problemami emocjonalnymi lub związkowymi; depresja i stosowanie leków przeciwdepresyjnych; niska samoocena i postrzeganie siebie są najbardziej rozpowszechnionymi i często najtrudniejszymi do leczenia przyczynami FSD.6,7 Te psychogenne czynniki wyzwalające mogą być związane z każdą z manifestacji FSD. Dodatkowo, choroba psychiczna i działania niepożądane leków przeciwpsychotycznych mogą czasami manifestować się jako objawy FSD.
Ciało kobiety w ciągu całego życia podlega wpływom hormonalnym i zaburzeniom równowagi, które wpływają na jej fizjologię seksualną, szczególnie w okresie ciąży i menopauzy. Podczas gdy sama ciąża jest ogólnie związana ze zmniejszonym zainteresowaniem seksem, 23% do 57% kobiet zgłasza spadek libido w trzy miesiące po porodzie, a prawie 40% w sześć miesięcy.8,9 Kobiety karmiące piersią często zgłaszają zwiększoną suchość pochwy wtórną do zmniejszonej produkcji estrogenów w tym czasie, a dyspareunia może być związana z samym naturalnym procesem porodu.10 Gdy ciało kobiety przechodzi przez okres menopauzy, zaprzestanie wytwarzania estrogenów przez jajniki wiąże się z atrofią narządów moczowo-płciowych i zmniejszeniem odpowiedzi seksualnej.11 Tym zmianom fizycznym często towarzyszą objawy naczynioruchowe, zmiany nastroju, labilność emocjonalna i obniżenie poczucia dobrostanu, które negatywnie wpływają na funkcje seksualne i jakość życia.12

interwencje niefarmakologiczne
Obecnie nie ma wytycznych dotyczących leczenia ani konsensusów dotyczących opieki nad kobietami z FSD. Ze względu na różnorodność czynników przyczynowych związanych z objawami FSD, modyfikacja stylu życia, zajęcie się przyczynami fizycznymi i psychologicznymi oraz zmiana nawyków behawioralnych związanych z seksem są preferowanymi pierwszymi krokami w leczeniu FSD, które mogą spowodować odwrócenie objawów, jeśli zostaną odpowiednio zaadresowane. Zaprzestanie palenia tytoniu i picia alkoholu, modyfikacja diety, włączenie technik redukcji stresu, rutynowe ćwiczenia fizyczne oraz leczenie takich schorzeń, jak cukrzyca i nadciśnienie tętnicze, które mogą predysponować kobiety do FSD, to podstawowe modyfikacje stylu życia, które według doniesień poprawiają funkcjonowanie seksualne kobiet.21,22 Rozpoznanie i odstawienie leków związanych z objawami może być uzasadnione, jeśli istnieją alternatywy terapeutyczne. W zależności od przyczyny i objawów dysfunkcji seksualnej kobiety, fizyczne modyfikacje związane ze współżyciem – w tym używanie wibratorów lub urządzeń do stymulacji elektrycznej, lubrykantów, ćwiczenia wzmacniające dno miednicy i zmiana pozycji seksualnej – mogą pomóc w zwiększeniu satysfakcji.23,24 Znacząca poprawa w zakresie podniecenia, doznań, orgazmu i ogólnej przyjemności seksualnej została odnotowana u kobiet z fizjologicznymi zaburzeniami podniecenia spowodowanymi niedostatecznym ukrwieniem narządów płciowych, które używały urządzenia do terapii łechtaczki Eros, niefarmakologicznego próżniowego aparatu do stymulacji łechtaczki.25,26 Psychoterapia i poradnictwo prowadzone przez terapeutę seksualnego są szczególnie ważne dla kobiet, których dysfunkcja jest związana z konfliktami w związkach, doświadczeniami seksualnymi z przeszłości, problemami emocjonalnymi, lękiem lub depresją.27 W badaniu klinicznym, którego celem była ocena skuteczności programu modyfikacji poznawczo-behawioralnej u pacjentek z FSD, kobiety zgłaszały poprawę postawy, odczuwały większą przyjemność seksualną i rzadziej zgłaszały dysfunkcję seksualną po zakończeniu terapii.28 Ze względu na wielorakie, złożone i często współistniejące czynniki związane z objawami dysfunkcji seksualnej u kobiet, w celu optymalizacji wyników leczenia często łączy się interwencje niefarmakologiczne i farmakologiczne.
Interwencje farmakologiczne
W przeszłości kobiety z FSD ograniczały się do stosowania hormonalnej terapii zastępczej i lubrykantów dopochwowych w celu poprawy funkcjonalności seksualnej. Ostatnio leki, które z powodzeniem stosowano w leczeniu zaburzeń erekcji u mężczyzn, w tym sildenafil i alprostadil, badano u kobiet.29,30 Skuteczność kliniczna tych środków jest na ogół niewielka, chociaż czasami są one stosowane poza wskazaniami. Do niedawna nie było zatwierdzonych przez FDA leków wskazanych do leczenia dysfunkcji seksualnych u kobiet. W kwietniu 2007 roku FDA rozszerzyła wskazania do stosowania syntetycznych skoniugowanych estrogenów B (Enjuvia) o leczenie suchości pochwy o nasileniu umiarkowanym do ciężkiego, dyspareunii oraz atrofii sromu i pochwy związanej z menopauzą31. Nowsze środki ukierunkowane na neuroprzekaźniki: dopaminę, serotoninę i melanokortynę – neuropeptyd odpowiedzialny za fizjologiczne reakcje seksualne u mężczyzn i kobiet – są obecnie przedmiotem badań klinicznych.32 Porównanie środków stosowanych w leczeniu różnych zaburzeń w FSD przedstawiono w TABELI 3.
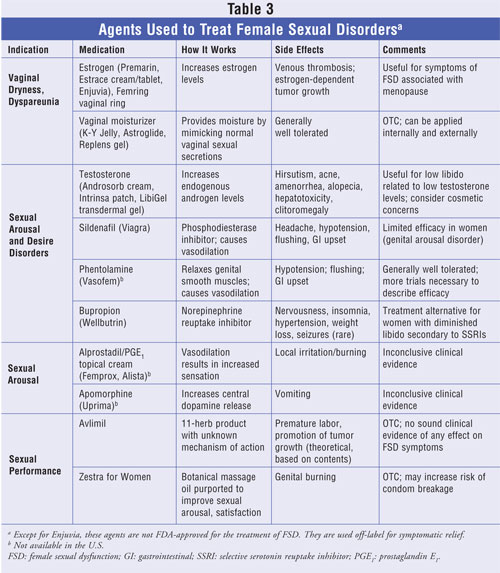
Hormonalna terapia uzupełniająca z użyciem estrogenów lub testosteronu jest stosowana w celu uzupełnienia zmniejszonych poziomów, które uważa się za związane z dysfunkcją seksualną, szczególnie u kobiet w okresie okołomenopauzalnym i pomenopauzalnym.33 Estrogenowa terapia zastępcza (ERT) wiąże się ze znaczną poprawą pożądania seksualnego, orgazmu, objawów dyspareunii i suchości pochwy. Poza poprawą objawów ze strony pochwy, ten sposób leczenia łagodzi również objawy naczynioruchowe, w tym uderzenia gorąca.34,35 Mimo dobrze opisanej skuteczności, ERT nie jest wskazana u kobiet, których objawy nie są związane z dysfunkcją pochwy lub zaburzeniami naczynioruchowymi. Ryzyko związane z ERT, w tym zakrzepica żylna, jest dobrze znane. Ponieważ stężenie androgenów również zmniejsza się z wiekiem, kobiety zgłaszające zmniejszenie pożądania seksualnego i satysfakcji seksualnej – objawy związane z niedoborem testosteronu lub małym stężeniem testosteronu w surowicy – mogą odnieść korzyści z terapii zastępczej testosteronem, chociaż ostatnie wyniki badań sugerują, że nie ma dowodów na to, że małe stężenie testosteronu w surowicy jest w rzeczywistości związane z dysfunkcją seksualną.36-38 Długoterminowa skuteczność i dane dotyczące bezpieczeństwa terapii zastępczej testosteronem nie są znane. Produkty łączące estrogen z testosteronem, w tym estrogeny i metylotestosteron (Estratest; Estratest HS), były również stosowane i są zatwierdzone do stosowania w przypadku objawów menopauzalnych, których nie łagodziła sama suplementacja estrogenami; mogą być one również stosowane poza wskazaniami w przypadku niektórych zaburzeń funkcji seksualnych.
Leki wazoaktywne, szczególnie inhibitory fosfodiesterazy, przyciągnęły wiele uwagi w sferze męskich dysfunkcji seksualnych. U kobiet, sildenafil działa poprzez zmniejszenie metabolizmu cyklicznego monofosforanu guanozyny, powodując wazodylatację i rozluźnienie mięśni gładkich pochwy i łechtaczki za pomocą tlenku azotu. Dane z badań klinicznych u kobiet przed i po menopauzie są sprzeczne, przy czym u młodszych kobiet obserwuje się poprawę w zakresie podniecenia, orgazmu, fantazji seksualnych i aktywności seksualnej, a u starszych minimalną, nieistotną poprawę w zakresie satysfakcji i ogólnych funkcji seksualnych.39,40 Fentolamina, antagonista receptorów alfa-adrenergicznych o właściwościach rozszerzających naczynia krwionośne, zwiększa podniecenie i poprawia nawilżenie pochwy.41,42 Tabletki doustne i roztwory miejscowe nie są dostępne w Stanach Zjednoczonych.
W przypadku kobiet, u których dysfunkcja seksualna jest związana ze stosowaniem leków przeciwdepresyjnych, ulgę może przynieść przejście na bupropion – środek, który wywiera swoje działanie poprzez blokowanie wychwytu zwrotnego noradrenaliny i dopaminy. Bupropion był badany w leczeniu dysfunkcji seksualnych wywołanych selektywnym inhibitorem wychwytu zwrotnego serotoniny i wiązał się z istotną statystycznie poprawą podniecenia i satysfakcji seksualnej.43,44 Apomorfina, krótko działający, nieselektywny agonista dopaminy, była badana jako tabletka podjęzykowa w leczeniu FSD. W jednym badaniu klinicznym na małą skalę środek ten wiązał się ze zwiększeniem przepływu krwi w łechtaczce, pobudzeniem, lubrykacją i orgazmem; jego przydatność ograniczają jednak ograniczające dawkę nudności, wymioty i zawroty głowy.45,46
Alprostadil, analog prostaglandyny dostępny w postaci iniekcji do stosowania u mężczyzn z zaburzeniami erekcji, był badany jako krem do stosowania miejscowego na narządy płciowe w zaburzeniach podniecenia seksualnego u kobiet. Pomimo niejednoznacznych wyników badań klinicznych, preparat jest ogólnie dobrze tolerowany. Jest on związany z przemijającym miejscowym podrażnieniem.30
Wniosek
Dysfunkcja seksualna dotyczy milionów kobiet w Stanach Zjednoczonych i na całym świecie. Farmaceuci mogą pomóc w budowaniu relacji roboczych z pacjentkami cierpiącymi na to zaburzenie, otwierając komunikację, która może być dla nich trudna do zainicjowania. Farmaceuci mogą również odegrać ważną rolę w edukacji pacjentek na temat niefarmakologicznych i farmakologicznych interwencji w FSD.
1. Laumann EO, Paik A, Rosen RC. Sexual dysfunction in the United States: prevalence and predictors. JAMA. 1999;281:537-544.
2. West SL, D’Aloisio AA, Agans RP, et al. Prevalence of low sexual desire and hypoactive sexual desire disorder in a nationally representative sample of US women. Arch Intern Med. 2008;168:1441-1449.
3. Modelska K, Milian ML. Treatment of female sexual dysfunction in postmenopausal women–what is the evidence? Rev Gynaecological Pract. 2004;4:121-131.
4. Basson R, Berman J, Burnett A, et al. Report of the international consensus development conference on female sexual dysfunction: definitions and classifications. J Urol. 2000;163:888-893.
5. Amerykańskie Towarzystwo Psychiatryczne. Diagnostic and Statistical Manual of Mental Disorders (DSM-IV). 4th ed. Text revision. Washington, DC: Amerykańskie Towarzystwo Psychiatryczne; 2000:535.
6. Berman JR, Berman L, Goldstein I. Female sexual dysfunction: incidence, pathophysiology, evaluation, and treatment options. Urology. 1999;54:385-391.
7. Basson R. Sexual desire and arousal disorders in women. N Engl J Med. 2006;354:1497-1506.
8. Barrett G, Pendry E, Peacock J, et al. Women’s sexuality after childbirth: a pilot study. Arch Sex Behav. 1999;28:179-191.
9. Robson KM, Brant HA, Kumar R. Maternal sexuality during first pregnancy and after childbirth. Br J Obstet Gynaecol. 1981;88:882-889.
10. Barrett G, Pendry E, Peacock J, et al. Women’s sexual health after childbirth. Br J Obstet Gynaecol. 2000;107:186-195.
11. Goldstein I, Traish A, Kim N, Munarriz R. The role of sex steroid hormones in female sexual function and dysfunction. Clin Obstet Gynecol. 2004;47:471-484.
12. Cawood EH, Bancroft J. Hormony steroidowe, menopauza, seksualność i samopoczucie kobiet. Psychol Med.1996;26:925-936.
13. Palmer BF. Sexual dysfunction in men and women with chronic kidney disease and end-stage kidney disease. Adv Ren Replace Ther. 2003;10:48-60.
14. Brassil DF, Keller M. Female sexual dysfunction: definitions, causes, and treatment. Urol Nurs. 2002;22:237-244,284.
15. Harte CB, Meston CM. The inhibitory effects of nicotine on physiological sexual arousal in nonsmoking women: results from a randomized, double-blind, placebo-controlled, cross-over trial. J Sex Med.2008;5:1184-1197.
16. Bump RC, Norton PA. Epidemiology and natural history of pelvic floor dysfunction. Obstet Gynecol Clin North Am. 1998;25:723-746.
17. Heim LJ. Evaluation and differential diagnosis of dyspareunia. Am Fam Physician. 2001;63:1535-1544.
18. Zippe CD, Nandipati KC, Agarwal A, Raina R. Female sexual dysfunction after pelvic surgery: the impact of surgical modifications. BJU Int. 2005;96:959-963.
19. Sipski ML, Alexander CJ, Rosen RC. Sexual response in women with spinal cord injuries: implications for our understanding of the able bodied. J Sex Marital Ther. 1999;25:11-22.
20. Leki powodujące dysfunkcję seksualną: aktualizacja. Med Lett Drugs Ther. 1992;34:73-78.
21. Perkins BA, Greene DA, Bril V. Glycemic control is related to the morphological severity of diabetic sensorimotor polyneuropathy. Diabetes Care. 2001;24:748-752.
22. Pauls RN, Kleeman SD, Karram MM. Female sexual dysfunction: principles of diagnosis and therapy. Obstet Gynecol Surv. 2005;60:196-205.
23. Feldman J, Striepe M. Zdrowie seksualne kobiet. Clin Fam Pract. 2004;6:839-861.
24. Beji NK, Yalcin O, Erkan HA. The effect of pelvic floor training on sexual function of treated patients. Int Urogynecol J Pelvic Floor Dysfunct. 2003;14:234-238.
25. Wilson SK, Delk JR, Billups KL. Treating symptoms of female sexual arousal disorder with the Eros-Clitoral Therapy Device. J Gend Specif Med. 2001;4:54-58.
26. Billups KL, Berman L, Berman J, et al. A new non-pharmacological vacuum therapy for female sexual dysfunction. J Sex Marital Ther. 2001;27:435-441.
27. Heiman JR. Psychologic treatments for female sexual dysfunction: are they effective and do we need them? Arch Sex Behav. 2002;31:445-450.
28. McCabe MP. Evaluation of a cognitive behavior therapy program for people with sexual dysfunction. J Sex Marital Ther. 2001;27:259-271.
29. Basson R, McInnes R, Smith MD, et al. Efficacy and safety of sildenafil citrate in women with sexual dysfunction associated with female sexual arousal disorder. J Womens Health Gend Based Med. 2002;11:367-377.
30. Kiełbasa LA, Daniel KL. Topical alprostadil treatment of female sexual arousal disorder. Ann Pharmacother. 2006;40:1369.
31. Enjuvia (syntetyczne skoniugowane estrogeny, B) ulotka dołączona do opakowania. Pomona, NY: Duramed Pharmaceuticals, Inc; kwiecień 2007.
32. Brown AD, Blagg J, Reynolds DS. Designing drugs for the treatment of female sexual dysfunction. Drug Discov Today. 2007;12:757-766.
33. Cardozo L, Bachmann G, McClish D, et al. Meta-analysis of estrogen therapy in the management of urogenital atrophy in postmenopausal women: second report of the Hormones and Urogenital Therapy Committee. Obstet Gynecol. 1998;92:722-727.
34. Sarrel PM. Seksualność i menopauza. Obstet Gynecol. 1990;75(suppl 4):26S-30S.
35. Myers LS, Dixen J, Morrissette D, et al. Effects of estrogen, androgen, and progestin on sexual psychophysiology and behavior in postmenopausal women. J Clin Endocrinol Metab. 1990;70:1124-1131.
36. Shifren JL, Braunstein GD, Simon JA, et al. Transdermalne leczenie testosteronem u kobiet z upośledzonymi funkcjami seksualnymi po oophorectomii. N Engl J Med. 2000;343:682-688.
37. Braunstein GD, Sundwall DA, Katz M, et al. Safety and efficacy of a testosterone patch for the treatment of hypoactive sexual desire disorder: a randomized, placebo-controlled trial. Arch Intern Med. 2005;165:1582-1589.
38. Davis SR, Davison SL, Donath S, Bell RJ. Circulating androgen levels and self-reported sexual function in women. JAMA. 2005;294:91-96.
39. Caruso S, Intelisano G, Lupo L, Agnello C. Premenopausal women affected by sexual arousal disorder treated with sildenafil: a double-blind, cross-over, placebo-controlled study. Br J Obstet Gynaecol. 2001;108:623-628.
40. Kaplan SA, Reis RB, Kohn IJ, et al. Safety and efficacy of sildenafil in postmen opausal women with sexual dysfunction. Urology. 1999;53:481-486.
41. Rosen RC, Phillips NA, Gendrano NC, Ferguson DM. Oral phentolamine and female sexual arousal disorder: a pilot study. J Sex Marital Ther. 1999;25:137-144.
42. Rubio-Aurioles E, Lopez M, Lipezker M, et al. Phentolamine mesylate in postmenopausal women with female sexual arousal disorder: a psychophysiological study. J Sex Marital Ther. 2002;28(suppl 1):205-215.
43. Clayton AH, Warnock JK, Kornstein SG, et al. A placebo-controlled trial of bupropion SR as an antidote for selective serotonin reuptake inhibitor-induced sexual dysfunction. J Clin Psychiatry. 2004;65:62-67.
44. Segraves RT, Clayton A, Croft H, et al. Bupropion sustained release for the treatment of hypoactive sexual desire disorders in premenopausal women. J Clin Psychopharmacol. 2004;24:339-342.
45. Bechara A, Bertolino MV, Casabé A, Fredotovich N. A double-blind randomized placebo controlled study comparing the objective and subjective changes in female sexual response using sublingual apomorphine. J Sex Med. 2004;1:209-214.
46. Montorsi F. Tolerancja i bezpieczeństwo stosowania apomorfiny SL. Int J Impot Res. 2003;15(suppl 2):S7-S9.
Aby skomentować ten artykuł, należy skontaktować się z [email protected].