Ale denga była kiedyś chorobą okresową, która powodowała epidemie w długich odstępach czasu, dziś jest uważana za najważniejszą chorobę wirusową przenoszoną przez komary na świecie. Rocznie, około pięćdziesiąt do stu milionów przypadków gorączki denga są rejestrowane na całym świecie . Pół miliona z tych przypadków kończy się najcięższą postacią gorączki denga (DF) znaną jako gorączka krwotoczna denga (DHF). DHF jest chorobą, która dotyka przede wszystkim dzieci poniżej 15 roku życia i charakteryzuje się nagłym wystąpieniem gorączki, małopłytkowości i zespołu przecieku naczyniowego. DHF występuje z powodu zakażenia wirusem dengi, który jest częścią rodziny Flaviviridae . Wirus jest ikosahedryczny, otoczony, jednoniciowy, dodatnio-sensowny RNA . Rdzeń ikosahedry ma średnicę od czterdziestu do pięćdziesięciu nanometrów i zawiera białko C, które otacza genom wirusowy . Dwa białka wirusowe, M i E, które składają się na otoczkę lipidową, otaczają rdzeń . Infekcja jest wywoływana przez jeden z czterech serotypów wirusa dengi (DENV): DENV-1, DENV-2, DENV-3, i DENV-4 . Zakażenie jednym z serotypów nie zapewnia odporności na zakażenie innymi serotypami .
Jeśli ktoś, kto był wcześniej zakażony, zostanie zakażony ponownie, ma zwiększone ryzyko rozwoju zespołu wstrząsu dengi (DSS) i DHF, który powoduje osłabienie i pęknięcie naczyń krwionośnych oraz krwawienie wewnętrzne . Przeciwciała nieneutralizujące mogą zwiększyć wchłanianie wirusa przez komórki, które wyrażają receptory Fc, umożliwiając w ten sposób zależne od przeciwciał wzmocnienie w DHF . Różne gatunki komarów Aedes są wektorami wirusa dengi i przenoszą wirusa poprzez ugryzienie ludzkiego żywiciela . Aedes aegypti; mały, czarno-biały, tropikalny i subtropikalny komar występujący w Ameryce Środkowej, Ameryce Łacińskiej, Azji Południowo-Wschodniej i zachodnim Pacyfiku, jest głównym wektorem.
Epidemiologia
Dzisiaj DHF jest uznawany na arenie międzynarodowej za najbardziej znaczącą chorobę wirusową przenoszoną przez komary. Występuje ona endemicznie w ponad 100 krajach na całym świecie, zwłaszcza w regionach tropikalnych i subtropikalnych. W Stanach Zjednoczonych, powodujące DHF gatunki Aedes aegyptispecies można znaleźć sezonowo w Luizjanie, południowej Florydzie, Nowym Meksyku, Arizonie, Teksasie, Georgii, Alabamie, Missisipi, Karolinie Północnej i Południowej, Kentucky, Oklahomie i Tennessee. W ciągu ostatnich 50 lat, częstość występowania dengi wzrosła 30-krotnie .
Według Światowej Organizacji Zdrowia (WHO), szacuje się, że 50 do 100 milionów infekcji gorączki denga występuje rocznie. Spośród tych przypadków 500 000 przechodzi w DHF, co powoduje 22 000 zgonów, głównie wśród dzieci. W oparciu o oficjalne dane przekazane do WHO, przypadki dengi w obu Amerykach, Azji Południowo-Wschodniej i Zachodnim Pacyfiku przekroczyły 1,2 mln w 2008 r. i ponad 3 mln w 2013 r. W 2013 r. w samych obu Amerykach odnotowano 2,35 mln przypadków dengi, z czego 37, 687 przypadków stanowiły przypadki DHF . Po pierwszej znanej epidemii DHF w 1953 do 1954 roku na Filipinach, choroba nadal rozprzestrzeniała się w całej Azji Południowo-Wschodniej .
Podczas 1950s, 1960s, i większość 1970s, denga epidemia była rzadka w większości Ameryki Południowej i Środkowej, ponieważ główny wektor komara, Aedes aegypti, został zlikwidowany. Jednakże, po zaprzestaniu eksterminacji, Aedes aegypti zaczął ponownie zasiedlać te regiony. W 1997 roku Aedes aegypti i wirus dengi ponownie rozpowszechniły się na całym świecie (ryc. 1,2). Według WHO, obecnie ponad 2,5 miliarda ludzi żyje na obszarach, gdzie denga/DHF jest chorobą endemiczną i jest narażonych na ryzyko zakażenia wirusem dengi. Kilka czynników przyczynia się do transmisji wirusa przez Aedes aegypti; w tym temperatura, opady deszczu, migracja wieś-miasto, wzrost populacji, zmagazynowana woda, wzrost odpadów stałych, które pozwalają na siedliska larwalne dla wektora. Mogą również wystąpić ogniska DHF związane z podróżą. Gorączka denga jest najbardziej rozpowszechnionym zakażeniem arbowirusowym na świecie .
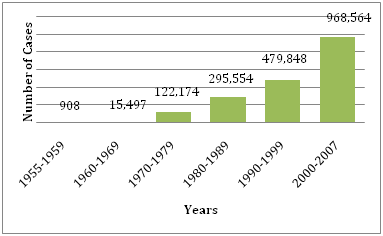
Wykres 1: Średnia liczba zachorowań na DF/DHF zgłoszonych do WHO w podanych latach .
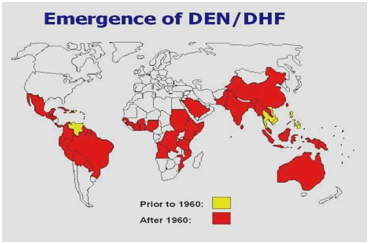
Rysunek 2: Rozmieszczenie dengi/ gorączki krwotocznej dengi w obu Amerykach, na Karaibach, w Afryce i na Bliskim Wschodzie.
Czynniki ryzyka dla DF i przenoszenia wirusa dengi
Gorączka denga jest ważną chorobą wirusową przenoszoną przez stawonogi . Badania pokazują, że komary z rodzaju Aedes, głównie Aedes aegypti i Aedes albopictus, przystosowały się do życia w pobliżu obszarów zamieszkanych przez ludzi i są odpowiedzialne za przenoszenie gorączki denga. Komary te żerują w ciągu dnia i wolą ludzi niż inne zwierzęta. Aedes aegyptii charakteryzuje się najwyższym odsetkiem ludzi żywiących się krwią, wynoszącym 76,9%, a następnie Aedes albopictus i Aedes vittatus, odpowiednio 75% i 33,3%. Występowanie DF jest związane z ilością roślinności, pokryciem drzewami, jakością budynków mieszkalnych i otaczającą je powierzchnią .
Wraz ze stworzonymi przez człowieka terenami lęgowymi, klimat również wpływa na ekologię dengi poprzez oddziaływanie na dynamikę wektora, rozwój czynnika i interakcję komar-człowiek.13 Temperatura wpływa na tempo rozwoju wektora, śmiertelność, zachowanie i kontroluje replikację wirusa w obrębie wektora. Ciepły klimat pozwala na rozwój larwalny i zwiększoną szybkość replikacji wirusa, podczas gdy zimny klimat spowalnia rozwój wirusa i skraca czas przeżycia komarów, zmniejszając w ten sposób możliwość pojawienia się zakaźnego wektora i zmniejszając przenoszenie gorączki denga. Temperatura współdziała również z opadami deszczu jako główny regulator parowania, wpływając w ten sposób bezpośrednio na dostępność siedlisk wodnych i pośrednio wpływając na pokrycie terenu i użytkowanie gruntów, co może promować lub utrudniać wzrost populacji wektorów. Zmiany demograficzne i społeczne, takie jak wzrost populacji, urbanizacja i nowoczesny transport, w znacznym stopniu przyczyniają się do wzrostu zachorowalności i geograficznego rozprzestrzeniania się aktywności dengi. Ponieważ podróżni przemieszczają się z obszarów endemicznych, mają tendencję do służenia jako pojazdy do dalszego rozprzestrzeniania się. Wirulencja szczepu wirusowego i zmienność genetyczna wirusa dengi również przyczyniają się do zwiększenia potencjału przenoszenia epidemii DHF.
Patogeneza gorączki krwotocznej denga
Jak komar żywi się ludzkim żywicielem, wstrzykuje wirusa dengi (DENV) do krwiobiegu oraz otaczającego go naskórka i skóry właściwej. W wyniku tego dochodzi do zakażenia niedojrzałych komórek Langerhansa i keratynocytów poprzez endocytozę pośredniczoną przez receptor. Białko E, białko powierzchniowe, ulega rekonfiguracji i umożliwia fuzję błonową oraz uwolnienie wirusowego RNA do zainfekowanej komórki. Niestrukturalne białka NS1 i NS2A kontrolują replikację wirusowego RNA, a NS1 może być również zaangażowane w aktywację kaskady dopełniacza. Zakażone komórki mogą następnie obumierać w wyniku apoptozy lub martwicy albo migrować do węzłów chłonnych, gdzie rekrutują się makrofagi (rysunek 3). Zakażenie którymkolwiek z czterech serotypów dengi (DENV-1 do DENV-4) może w większości przypadków przebiegać bezobjawowo, ponieważ układ odpornościowy gospodarza jest w stanie zneutralizować je miejscowo, ale może również powodować spektrum objawów klinicznych, z których najcięższą formą jest DHF, która może przejść w DSS i śmierć. DHF jest klinicznie definiowana jako ciągła gorączka trwająca od 2 do 7 dni z objawami krwotocznymi ze strony błon śluzowych lub skóry związanymi z trombocytopenią (<100,000 komórek/mm3) i hematokrytem większym niż 20% powyżej wartości wyjściowej dla pacjenta lub populacji w tym samym wieku. Patologicznymi cechami DHF są wyciek osocza z powierzchni opłucnej lub otrzewnej i wewnętrzna koagulopatia, która jest klinicznie mierzona albo dodatnim wynikiem testu opaski uciskowej, albo dowodem spontanicznego krwawienia, takiego jak wybroczyny lub wybroczyny, krwawienie z dziąseł lub krwotok z nosa, lub krwotok z przewodu pokarmowego.

Obraz 3: Po ugryzieniu przez komara Aedes aegypti, niedojrzałe komórki Langerhansa i keratynocyty są zakażone wirusem DENV. Zakażone komórki wędrują następnie do limfy, gdzie rekrutują się makrofagi. Stąd zakażenie rozprzestrzenia się do różnych narządów, w tym do wątroby, śledziony i szpiku kostnego. Martwica szpiku kostnego przez DENV może prowadzić do supresji układu krwiotwórczego i zmniejszenia trombogenezy we krwi. Odpowiedź zapalna, spowodowana uwalnianiem chemokin i cytokin z komórek tucznych, makrofagów i limfocytów, powoduje zwiększoną przepuszczalność naczyń krwionośnych, dysfunkcję płytek krwi, małopłytkowość i wyciek osocza. Chociaż mechanizm nie jest dobrze poznany, kaskada ta wydaje się również powodować spontaniczne krwawienie, prowadzące do klinicznych objawów wybroczyn, krwawienia z dziąseł i krwotoku z przewodu pokarmowego.
Ta ciężka postać choroby często jest wynikiem wtórnego zakażenia, w którym gospodarz zostaje zakażony drugim serotypem i dochodzi do złożonej interakcji między wirusem a odpowiedzią immunologiczną gospodarza. Chociaż mechanizm, który powoduje tę reakcję nie jest dobrze zrozumiany, dowody sugerują, że wcześniejsze zakażenie może tworzyć przeciwciała reagujące krzyżowo, które wiążą nowy serotyp, ale nie są w stanie go zneutralizować. Nazywa się to teorią wzmocnienia zależnego od przeciwciał (ADE) . Uważa się, że przeciwciała powstałe podczas wcześniejszych infekcji przeciwko białkom strukturalnym DENV, takim jak białko E lub prM, nie są w stanie zneutralizować nowego patogenu i zamiast tego prowadzą do zwiększonego wiązania się z komórką posiadającą receptor Fcγ, umożliwiając wzmocnioną replikację wirusa. W odpowiedzi układ odpornościowy uwalnia przesadną odpowiedź cytokinową, co prowadzi do zwiększonej przepuszczalności naczyń krwionośnych i koagulopatii.
Komórki tuczne zostały również implikowane w patogenezie DHF. W niektórych przypadkach, komórki tuczne wydają się zapewniać funkcję ochronną, gdzie cząsteczki przeciwwirusowe są uwalniane przez de granulację i inne komórki odpornościowe, takie jak limfocyty T i naturalne komórki zabójcze (NK) są rekrutowane, z których wszystkie pomagają neutralizować wirusa. Jednak w innych przypadkach, lokalne mechanizmy kontroli nie może zawierać wirusa, a on przemieszcza się przez krwiobieg lub układ limfatyczny do aktywacji komórek tucznych w innych narządach, takich jak wątroba, śledziona i węzły chłonne . Kiedy de granulacja występuje w tych narządach, proteazy są uwalniane i mediatory zapalne, takie jak leukotrieny i czynnik wzrostu śródbłonka naczyniowego (VEGF), są syntetyzowane, zwiększając przepuszczalność naczyń włosowatych i prowadząc do wycieku osocza. Jest to ważne, ponieważ różne grupy mastocytów uwalniają różne mediatory podczas procesu ziarninowania. Kompleks wirus-przeciwciało, być może poprzez antygen NS1 wirusa dengi, oraz produkcja cytokin również prowadzi do aktywacji dopełniacza. Wiadomo, że uwalnianie fragmentów C3a i C5a zwiększa przepuszczalność naczyń, a tym samym przyczynia się do wycieku osocza .
Rodzaj i ilość uwalnianych cytokin odgrywa ważną rolę w dyktowaniu ciężkości choroby. Makrofagowe białko zapalne 1β (MIP-1β) wydaje się być wskaźnikiem mniej ciężkiej choroby, ponieważ jest uwalniane przez zakażone komórki jednojądrowe i aktywowane komórki NK. Działa ono jako chemo atraktant dla większej liczby komórek NK, wabiąc je do miejsca zapalenia, ograniczając replikację wirusa i efekt cytokinowy. Z drugiej strony wykazano, że interferon γ (IFN-γ) indukuje wyciek z osocza i zwiększa wychwyt cząstek dengi poprzez zwiększenie receptorów Fc na komórkach docelowych i dlatego jest związany z cięższymi objawami klinicznymi i złym rokowaniem. Inne cytokiny, których wzrost stwierdzono w DHF, a które zostały powiązane z indukowaniem przecieku osocza, to interleukina 2 (IL-2), czynnik martwicy nowotworów α (TNF- α), czynnik hamujący migrację makrofagów (MIF), białko chemo-taktyczne monocytów-1 (MCP-1), interleukina-8 (IL-8) i pole 1 grupy o dużej ruchliwości (HMGB-1). Skutki uwalniania cytokin nie ograniczają się do przepuszczalności naczyń i przecieku osocza, ale są również związane z krwotocznymi objawami DHF. Jednak podstawowy mechanizm, który powoduje krwawienie w DHF jest słabo poznany. Chociaż większość zakażonych komórek jest podatna na śmierć poprzez apoptozę, to jednak dochodzi do martwicy, w wyniku której uwalniane są toksyny aktywujące układ krzepnięcia i fibrynolizy. Kiedy w szpiku kostnym występuje wysoki poziom martwicy spowodowany wysoką wiremią, dochodzi do supresji układu krwiotwórczego, co skutkuje trombolitycznąpenią. Wynikający z tego spadek trombogenezy i dysfunkcja płytek krwi mogą powodować kruchość naczyń włosowatych i wynikające z tego objawy kliniczne obserwowane w DHF. Niektóre badania wskazują, że udział wątroby w zakażeniu DENV może mieć związek z tendencjami do spontanicznego krwawienia, z korelacją pomiędzy podwyższonym poziomem enzymów wątrobowych i zwiększoną tendencją do krwotoków.
Objawy kliniczne i symptomy
Kliniczna manifestacja choroby obejmuje bezobjawowe zakażenie, łagodną gorączkę denga (DF), gorączkę krwotoczną denga (DHF) lub zespół wstrząsu denga (DSS), który jest często ciężki z powodu nieprawidłowej przepuszczalności naczyń włosowatych i wycieku osocza. Ciężka postać dengi występuje zazwyczaj u pacjentów, którzy zostali wcześniej zakażeni wirusem dengi (tj. zakażenie wtórne). Wysokie wskaźniki ciężkiego zakażenia dengą odnotowano również u niemowląt z pierwotnym zakażeniem wirusem dengi, urodzonych przez matki, które były wcześniej zakażone wirusem dengi.
Faza początkowa DHF objawia się jako gorączka denga. Symptomatologia tej początkowej fazy zależy od wieku pacjenta i obejmuje nagłą, wysoką gorączkę (czasami z dwoma szczytami), silny ból głowy, zmniejszony apetyt, silną mialgię i artralgię, plamistą wysypkę skórną, która pojawia się trzy do czterech dni po początkowym wystąpieniu gorączki, ból zaoczodołowy, światłowstręt, powiększenie węzłów chłonnych, łagodne krwawienie (krwawienie z nosa, krwawienie z dziąseł, krwawienie z przewodu pokarmowego, krwiomocz i krwawienie miesiączkowe) oraz dodatni wynik testu opaski uciskowej. Przypadki DHF charakteryzują się czterema głównymi objawami klinicznymi, którymi są wysoka gorączka, zjawiska krwotoczne, a często także hepatomegalia i niewydolność krążenia. Ostra choroba gorączkowa charakterystyczna dla fazy początkowej składa się z temperatury wyższej niż 39°C i utrzymuje się przez 2-7 dni.
Wspomniane objawy fazy początkowej stopniowo się pogarszają, z ciągłą gorączką i bólem głowy, silnym bólem lub tkliwością brzucha, uporczywymi wymiotami, krwiomoczem, meleną, wybroczynami, łatwym siniaczeniem, niepokojem, sennością, drażliwością, krwawieniem lub zasinieniem pod skórą. Po 2-7 dniach gorączki, szybkiemu spadkowi temperatury często towarzyszą objawy zaburzeń krążenia o różnym nasileniu. Pacjent może się pocić, być niespokojny, mieć chłodne kończyny i wykazywać zmiany w tętnie i ciśnieniu krwi. Po 24-48 godzinach od wystąpienia DHF specyficzne cechy, nieprawidłowa hemostaza i wyciek osocza są obserwowane jako objawy charakterystyczne.
Dobrym wskaźnikiem tych postępów jest większe niż 2 cm powiększenie wątroby, ponieważ hepatomegalia ma tendencję do poprzedzania wycieku osocza. Wielu pacjentów wraca do zdrowia z lub bez leczenia płynami i elektrolitami. W ciężkich przypadkach, utrata osocza może postępować do wstrząsu i śmierci, jeśli nie są leczone . Badania sugerują, że zarówno wtórne zakażenie dengą, jak i przesadny odwet odpowiedzi układu immunologicznego na cytokiny zwiększają predylekcję pacjenta do rozwoju DHF.
Uważa się, że produkty wirusowe, takie jak glikoproteina NS1, wpływają na aktywację dopełniacza i przepuszczalność naczyń krwionośnych, powodując przeciek osocza, który rozwija się w wodobrzusze lub wysięki opłucnowe. Odpowiedź cytokinowa jest również odpowiedzialna za zwiększenie przepuszczalności naczyń, w wyniku czego wewnątrznaczyniowe ciśnienie onkotyczne jest zmniejszone i ułatwia utratę płynu do przedziałów pozanaczyniowych (rysunek 4). Zaburzenia hemostazy objawiają się małopłytkowością z jednoczesnym zwiększeniem hematokrytu, wydłużeniem czasu częściowej tromboplastyny i zmniejszeniem stężenia fibrynogenu, a także wspomnianymi wcześniej wybroczynami, silnymi krwotokami z przewodu pokarmowego, wybroczynami i krwotokami z nosa.
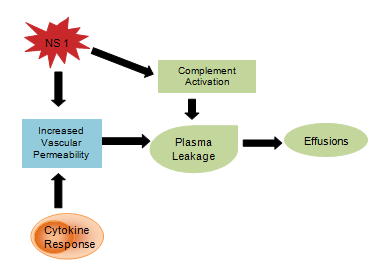
Rycina 4: Cytokinowa odpowiedź układu odpornościowego.
Podczas gorączkowej fazy wiremicznej DHF, uważa się, że małopłytkowość i późniejsze objawy występują z powodu supresji szpiku kostnego. Jak wcześniej wspomniano, supresja szpiku kostnego jest wynikiem tego, że jest on miejscem replikacji wirusa, a w szczególności atakuje krwiotwórcze komórki progenitorowe. Jednakże, immunologiczne niszczenie płytek krwi zostało również zasugerowane przez odkrycie kompleksów wirus-przeciwciało znalezionych na powierzchniach płytek krwi pacjentów z DHF.
Nierzadkie kliniczne manifestacje obejmują ostre zapalenie wątroby, niewydolność wątroby, ostrą niewydolność nerek, encefalopatię lub kardiomiopatię (ostre zapalenie mięśnia sercowego). W badaniu dotyczącym śmiertelnego DHF u dorosłych analizowano przyczyny śmiertelności inne niż zespół wstrząsu denga (DSS) u pacjentów z ciężką postacią dengi i stwierdzono, że hipotermia, leukocytoza i bandemia mogą być objawami wyzwalającymi ciężką postać dengi. Badanie dalej radzi klinicystom, aby byli świadomi możliwego rozwoju masywnego krwawienia z przewodu pokarmowego, szczególnie u pacjentów z wczesną zmienioną świadomością, głęboką małopłytkowością, przedłużonym PT i/lub leukocytozą .
Diagnoza, leczenie i postępowanie
Wczesna i dokładna diagnoza jest krytyczna dla właściwej opieki klinicznej. Istnieje wiele metod, dzięki którym można postawić diagnozę dengi. Diagnostyka może być przeprowadzona poprzez izolację wirusa, wirusowego kwasu nukleinowego, przeciwciał i antygenów lub połączenie wszystkich tych technik. Wykrywanie wirusa dengi za pomocą hodowli jest ostatecznym testem diagnostycznym, ale względy praktyczne ograniczają jego zastosowanie. Wykrywanie wirusowego RNA jest szybsze, ale zanieczyszczenie może prowadzić do fałszywie pozytywnych wyników. Również test serologiczny może dawać fałszywie dodatni wynik z powodu przeciwciał reagujących krzyżowo.
Ostre infekcje są wykrywane w surowicy, osoczu i krążących komórkach krwi podczas wczesnej fazy rekonwalescencji, która trwa 5-8 dni od wystąpienia objawów. W tym czasie pierwotna wiremia może wynosić nawet103 cząsteczek RNA/ml lub więcej niż 106 cząsteczek RNA/ml w zakażeniach wtórnych. Obecnie coraz częściej w diagnostyce stosuje się połączenie testów na obecność antygenu NS1 i przeciwciał, a także metody molekularne, takie jak reakcja łańcuchowa odwrotnej transkrypcji-polimerazy w czasie rzeczywistym (RT-PCR), ponieważ pozwalają one na uzyskanie szybszych wyników i są bardziej czułe. Analiza immunohistochemiczna i immunofluorescencja również potwierdzają obecność wirusa poprzez antygeny wirusowe. Przeciwciała IgM pojawiają się jako pierwsze w ciągu pierwszych 3-5 dni od zakażenia.
Ta utrata płynów może prowadzić do wstrząsu, a bez odpowiedniej korekty prowadzi do niedotlenienia, kwasicy metabolicznej i ostatecznie do śmierci. Dlatego podstawowe postępowanie wymaga stacjonarnej opieki wspomagającej z zachowaniem równowagi płynów i elektrolitów. Objętość upakowanych krwinek powinna być monitorowana co godzinę, co 4-6 godzin. Znacząca utrata osocza jest definiowana jako >20% wzrost objętości komórek w płynie lub hematokrytu. Gdy pacjent osiągnie te poziomy, konieczne jest szybkie i agresywne uzupełnianie objętości.
Szybkość wymiany płynu infuzyjnego zależy od objętości komórek upakowanych i ilości wydalanego moczu. Istnieje wiele płynów stosowanych do wymiany utraty osocza, w tym sól fizjologiczna, mleczan Ringera lub octan Ringera, rozcieńczony 5% roztwór glukozy, osocze lub substytuty osocza, takie jak dekstryna 40 i świeża krew pełna . Oprócz dożylnej wymiany płynów, elektrolity mogą być wprowadzane doustnie, ponieważ złagodzi to częściowo pragnienie i odwodnienie spowodowane gorączką. Wspomagające leki przeciwbólowe, takie jak acetaminofen, mogą być stosowane w leczeniu gorączki i innych objawów. Należy unikać leków z grupy NLPZ i aspiryny, ponieważ mogą one nasilić zespół Reye’a.
Po wyzdrowieniu pacjenci z DHF muszą spełniać następujące kryteria przed wypisem ze szpitala: widoczna poprawa stanu klinicznego, stan podgorączkowy bez stosowania leków przeciwgorączkowych przez >24 godziny, zwiększony apetyt, stabilny hematokryt, odpowiednie wydalanie moczu, trzy dni po wyzdrowieniu z ciężkiej kwasicy metabolicznej, liczba płytek krwi >50 000/mm3 i brak zaburzeń oddechowych spowodowanych wysiękiem opłucnowym lub wodobrzuszem.
Zapobieganie i zwalczanie aedes aegypti
Aedes aegypti, najbardziej rozpowszechniony wektor wirusa dengi, jest głównym celem działań w zakresie nadzoru i kontroli. Inne wektory, takie jak Aedes albopictus, mogą wywoływać gorączkę denga, ale nadzór i działania kontrolne w odniesieniu do innych wektorów powinny być rozważane tylko wtedy, gdy istnieją wiarygodne dowody na to, że wektory te odgrywały epidemiologicznie istotną rolę w przenoszeniu zakażeń denga. Pierwsza inicjatywa mająca na celu wyeliminowanie Aedes aegyptiw została podjęta na Kubie w 1901 roku. Fumigacja i eliminacja ognisk komarów poprzez niszczenie porzuconych pojemników były pierwszymi krokami do wyeliminowania wektora. Po wybuchu żółtej gorączki w Brazylii w 1928 i 1932 roku, stało się jasne, że całkowita ochrona ludności miejskiej zależy od absolutnego wyeliminowania komara Aedes aegyptimosquito; doprowadziło to do zatwierdzenia przez Pan American Health Organization (PAHO) kontynentalnego planu zwalczania Aedes aegyptieradication w 1947 roku do walki z miejską żółtą gorączką . Od 1947 roku Panamerykańskie Biuro Sanitarne (PASB) intensywnie promowało kampanie we wszystkich dotkniętych krajach, a ich sukces został zademonstrowany w 1962 roku, kiedy to 18 krajów kontynentalnych i kilka wysp karaibskich osiągnęło eradykację. W wyniku tych wysiłków amerykański DENV-2 genotyp V jest jedynym wirusem dengi, który pozostał do dziś.
Despite wysiłki w celu wyeliminowania wektora, Aedes aegypti nie został wyeliminowany na Kubie, Stany Zjednoczone, Wenezuela, i kilka krajów karaibskich . Dekady bezprecedensowych wysiłków ludzkich w celu wyeliminowania Aedes aegyptifell się bardzo szybko i szybko doprowadził do zakażenia. Brak nadzoru i pogorszenie struktury programu eradykacji , niewystarczające warunki sanitarne środowiska i niewystarczający udział społeczności były niektóre z czynników, które doprowadziły do spadku wysiłków w celu wyeliminowania wektora . Na dzień dzisiejszy nie ma szczepionki dostępnej w celu zapobiegania infekcjom dengi . Takeda Vaccines Inc. opracowuje żywą, atenuowaną szczepionkę kandydacką znaną jako tetrawalentna szczepionka przeciwko dendze (TDV), która składa się z atenuowanego szczepu DENV-2 (TDV-2) oraz trzech chimerycznych wirusów zawierających geny białek prM i E DENV-1, -3 i -4, które zostały wyrażone w kontekście atenuowanego szkieletu genomu TDV-2 (odpowiednio TDV-1, TDV-3 i TDV-4). Wykazano, że szczepionka jest dobrze tolerowana i immunogenna w badaniu klinicznym fazy 2 w krajach endemicznych dengi wśród dorosłych i dzieci.
Szczepionka znajduje się na etapie 3 fazy rozwoju. Ponadto firma Sanofi Pasteur opracowała rekombinowaną, żywą atenuowaną, tetrawalentną szczepionkę przeciwko dendze (CYD-TDV), która wykazała zgodne bezpieczeństwo i skuteczność u osób w wieku ≥9 lat w krajach endemicznych; jest ona w późnej fazie rozwoju . Dengvaxia (CYD-TDV) firmy Sanofi Pasteur została po raz pierwszy zarejestrowana w Meksyku w grudniu, 2015 r. i została oceniona jako seria 3 dawek w schemacie 0/6/12 miesięcy w badaniach klinicznych III fazy . Istnieje około pięciu dodatkowych kandydatów do szczepionki w trakcie oceny w badaniach klinicznych . Podróżujący do obszarów endemicznych dengi są narażeni na ryzyko zachorowania na dengę; dlatego w celu zapobiegania należy zachęcać ich do wybierania zakwaterowania z dobrze osłoniętymi oknami i drzwiami, stosowania środków odstraszających owady, noszenia odpowiedniej odzieży oraz opróżniania i przykrywania wszelkich stojących wód, które mogą ewentualnie stać się miejscami żerowania komarów .
Obecna sytuacja na świecie
Obecnie oczekuje się, że częstość występowania dengi będzie nadal rosła z powodu wielu czynników, w tym statusu społeczno-ekonomicznego, ciągłych zmian klimatycznych, podróży i globalizacji. Szczepionki są nadal w fazie rozwoju i nie istnieje obecnie żadna specyficzna terapia przeciwwirusowa, która mogłaby rozwiązać problem rosnącego zagrożenia dengą. Globalne szacunki zachorowalności na dengę wynoszą od 50 do 200 milionów. Jednak wykorzystanie podejść kartograficznych sugeruje ostatnio, że liczba zachorowań jest bliższa 400 milionom. W 2012 roku WHO sklasyfikowała dengę jako jedną z najważniejszych chorób wirusowych przenoszonych przez komary. Klasyfikacja ta jest uzasadniona znacznym geograficznym rozprzestrzenianiem się wirusa wraz z jego wektorem na obszary, które wcześniej nie były dotknięte tą chorobą (Ryc. 5).
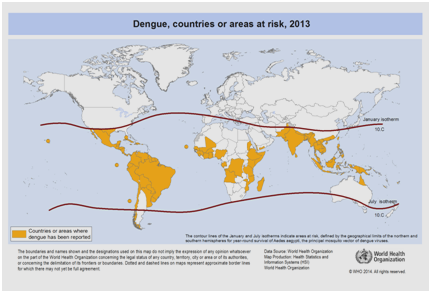
Rycina 5: Kraje lub obszary świata, w których odnotowano dengę w 2013 r., zgodnie z danymi zebranymi przez Światową Organizację Zdrowia .
Przemawiają za tym również koszty, jakie choroba ze sobą niesie. Porównując obciążenie denga i innych chorób zakaźnych w dotkniętym regionie, denga powoduje znacznie więcej ludzkiego cierpienia i jest większym obciążeniem niż inne choroby przenoszone przez wektory. Według WHO denga jest główną przyczyną hospitalizacji i zgonów wśród dzieci w Azji Południowo-Wschodniej. Badanie przeprowadzone przez Hammond et al. wykazało, że większość zachorowalności i śmiertelności związanej z tą chorobą dotyczy dzieci, a nie innych grup wiekowych. Niemowlęta w wieku 4-9 miesięcy i dzieci w wieku 5-9 lat są najbardziej obciążone dengą (ryc. 6). Ciężkość choroby u tych dzieci jest często spowodowana wtórnym zakażeniem DENV. W badaniu ekologicznym przeprowadzonym przez Dıaz-Quijano i Waldman w Ameryce Łacińskiej i na Karaibach stwierdzono, że czynniki determinujące śmiertelność z powodu dengi w tych populacjach obejmowały czas trwania uznanej endemiczności, gęstość zaludnienia i opady deszczu.
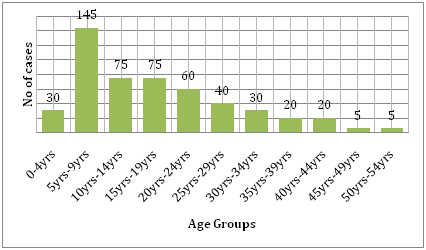
Rys. 6: Rozkład wieku badanej kohorty w León według grup wiekowych .
Oprócz wpływu zachorowalności i śmiertelności, wirus dengi niesie ze sobą duże obciążenie finansowe dla dotkniętych regionów, z których wiele jest źle przygotowanych do ponoszenia tych kosztów. W 2010 roku obciążenie finansowe związane z wirusem dengi oszacowano na średnio 2,1 miliarda dolarów rocznie w obu Amerykach (w dolarach amerykańskich z 2010 roku), z zakresem 1-4 miliardów dolarów w analizach wrażliwości i znaczną zmiennością z roku na rok. Według WHO denga jest obecnie postrzegana jako problem ogólnoświatowy, przy czym w regionie Azji i Pacyfiku występuje największa (75%) globalna populacja narażona na kontakt z wirusem dengi. Zachodni Pacyfik również doświadczył stałego wzrostu liczby zgłoszonych przypadków dengi w ciągu ostatniej dekady.
Nawet przy braku transmisji DF w połowie XX wieku, jest teraz obecność zwiększonej endemiczności rodzimego DF w obu Amerykach. W samych Amerykach, w 2010 roku, było ponad 1,6 miliona zgłoszonych przypadków dengi i 49,000 z nich jest ciężka denga . W Afryce ogniska DF stają się coraz liczniejsze i częstsze, ale nie są konsekwentnie zgłaszane do WHO. W latach 1960-2010 sporadyczne przypadki były zgłaszane przez 22 kraje afrykańskie, co sugerują dostępne dane dotyczące ognisk choroby. W Europie nie odnotowano epidemii DF od czasu wybuchu epidemii w Grecji w 1928 roku. Obecnie istnieje zagrożenie wybuchu epidemii w Europie, którą przypisuje się Aedes albopictus w związku z podróżami z krajów, w których choroba jest endemiczna. Szacuje się, że w najbliższych latach nastąpi wzrost zachorowań ze względu na wieloczynnikowe czynniki ryzyka .