Rak jest wynikiem załamania kontroli, które regulują komórki. Przyczyny załamania zawsze obejmują zmiany w ważnych genach. Zmiany te są często wynikiem mutacji, zmian w sekwencji DNA chromosomów. Mutacje mogą być bardzo małe zmiany, wpływając tylko kilka nukleotydów lub mogą być bardzo duże, co prowadzi do poważnych zmian w strukturze chromosomów.
Mutacje zarówno małe i duże mogą wpływać na zachowanie komórek. Kombinacje mutacji w ważnych genach mogą prowadzić do rozwoju nowotworów. Materiał zawarty na tej stronie opisuje związek między mutacją a rakiem, różne rodzaje mutacji oraz ich przyczyny. Dalsze informacje na tematy poruszane na tej stronie można również znaleźć w większości podręczników wprowadzających do biologii, polecamy Campbell Biology, 11th edition.1
Tematy na tej stronie:
- Mutacje i rak
- Mutacje dziedziczne i rak
- Rodzaje mutacji
- Mutacje punktowe
- Translokacje
- Amplifikacje genów
- Inwersje, Deletions, and Duplications
- Aneuploidia
- Zmiany epigenetyczne
- Causes of Mutation
- Mutation Summary
- Know the Flow: Mutacja
Mutacja i Rak
Nieprawidłowe zachowania demonstrowane przez komórki rakowe są wynikiem serii mutacji w kluczowych genach regulacyjnych. Komórki stają się stopniowo bardziej nieprawidłowe, gdy więcej genów zostaje uszkodzonych. Często geny, które kontrolują naprawę DNA, same ulegają uszkodzeniu, czyniąc komórki jeszcze bardziej podatnymi na coraz wyższe poziomy genetycznego chaosu.
Poniżej znajduje się animacja, która pokazuje związek między chromosomami, genami i DNA.
Większość nowotworów uważa się za powstałe z jednej zmutowanej komórki prekursorowej. Jak ta komórka dzieli się, wynikające z tego komórki „córki” mogą nabyć różne mutacje i różne zachowania przez okres czasu. Te komórki, które zyskują przewagę w podziale lub odporność na śmierć komórki, będą miały tendencję do przejmowania populacji. W ten sposób komórki nowotworowe są w stanie uzyskać szeroki zakres zdolności, które nie są normalnie widoczne w zdrowej wersji reprezentowanego typu komórek. Zmiany w zachowaniu widziane w komórkach nowotworowych są przedmiotem sekcji Biologii Raka witryny.
Mutacje w kluczowych genach regulacyjnych (supresorach nowotworu i proto-onkogenach) zmieniają zachowanie komórek i mogą potencjalnie prowadzić do nieuregulowanego wzrostu widzianego w raku.
Dla prawie wszystkich typów raka badanych do tej pory, wydaje się, że przejście z normalnej, zdrowej komórki do komórki nowotworowej jest stopniowym postępem, który wymaga wielu zmian genetycznych, które sumują się, aby stworzyć komórkę nowotworową. Mutacje te występują zarówno w onkogenach, jak i supresorach nowotworu. Jest to jeden z powodów, dla których rak jest znacznie bardziej powszechny u osób starszych. Aby wygenerować komórkę nowotworową, w tej samej komórce musi wystąpić seria mutacji. Ponieważ prawdopodobieństwo, że jakikolwiek gen ulegnie mutacji jest bardzo małe, to szansa, że kilka różnych mutacji wystąpi w tej samej komórce jest naprawdę bardzo mało prawdopodobna. Z tego powodu, komórki w 70-letnim ciele mają więcej czasu na gromadzenie zmian potrzebnych do tworzenia komórek rakowych, ale te w dziecku są znacznie mniej prawdopodobne, aby nabyć wymagane zmiany genetyczne. Oczywiście, niektóre dzieci mają raka, ale jest on znacznie bardziej powszechny u starszych osób. Poniższy wykres przedstawia zachorowalność na raka jelita grubego w Stanach Zjednoczonych w zależności od wieku. Wykres został uzyskany z National Cancer Institute. 2
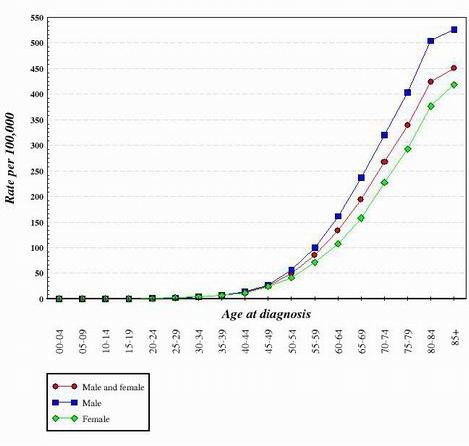
Patrząc na kształt krzywych takich jak przedstawione powyżej, stwierdzono, że do stworzenia komórek, które stają się nowotworowe, wymagane jest kilka zmian genetycznych.
W laboratorium badacze próbowali stworzyć komórki nowotworowe poprzez zmianę lub wprowadzenie kluczowych białek regulacyjnych. W kilku badaniach próbowano określić minimalną liczbę zmian genetycznych potrzebnych do stworzenia komórki nowotworowej, uzyskując intrygujące wyniki.3
W naturze mutacje mogą kumulować się w komórkach w czasie i jeśli „właściwa” grupa genów ulegnie mutacji, może dojść do powstania raka. Badanie z 2012 r. wykazało, że komórki macierzyste szpiku kostnego u zdrowej osoby gromadzą wiele mutacji w miarę starzenia się. Tylko kilka dodatkowych zmian w kluczowych genach może spowodować raka. Wyniki sugerują, że „normalne” komórki i komórki nowotworowe mogą w wielu przypadkach nie różnić się aż tak bardzo.4
Mutacje dziedziczne w raku
Aby skomplikować sprawy, jasne jest, że zmiany potrzebne do stworzenia komórki nowotworowej mogą być osiągnięte na wiele różnych sposobów. Chociaż wszystkie nowotwory muszą pokonać to samo spektrum funkcji regulacyjnych, aby rosnąć i rozwijać się, zaangażowane geny mogą się różnić. Ponadto kolejność, w jakiej geny ulegają rozregulowaniu lub utracie, również może być różna. Na przykład, guzy raka jelita grubego pochodzące od dwóch różnych osób mogą obejmować bardzo różne zestawy supresorów nowotworowych i onkogenów, nawet jeśli wynik (rak) jest taki sam.
Duża heterogenność widoczna w nowotworach, nawet tych z tego samego narządu, oznacza, że diagnostyka i leczenie są skomplikowane. Obecne postępy w molekularnej klasyfikacji nowotworów powinny pozwolić na racjonalne projektowanie protokołów leczenia w oparciu o rzeczywiste geny zaangażowane w danym przypadku. Nowe testy diagnostyczne mogą obejmować badanie setek lub tysięcy genów w celu stworzenia spersonalizowanego profilu guza u danej osoby. Informacje te powinny pozwolić na dostosowanie terapii przeciwnowotworowych do indywidualnych potrzeb. Aby uzyskać więcej informacji na ten temat zobacz sekcję Genomics/Proteomics.
Zmiany genetyczne, które prowadzą do nieuregulowanego wzrostu komórek mogą być nabyte na dwa różne sposoby. Możliwe jest, że mutacja może pojawić się stopniowo w ciągu kilku lat, prowadząc do rozwoju „sporadycznego” przypadku raka. Alternatywnie, możliwe jest dziedziczenie dysfunkcyjnych genów, co prowadzi do rozwoju rodzinnej postaci danego typu nowotworu. Niektóre przykłady nowotworów o znanych komponentach dziedzicznych obejmują:
- Rak piersi – dziedziczenie zmutowanych wersji genów BRCA1 i BRCA2 jest znanym czynnikiem ryzyka. Chociaż wiele, jeśli nie większość, osób z rakiem piersi nie ma wykrywalnych zmian w tych genach, posiadanie zmutowanej formy zwiększa prawdopodobieństwo rozwoju raka piersi.
- Rak jelita grubego – wiadomo, że defekty w genach naprawy DNA, takich jak MSH2, predysponują osoby do zachorowania na dziedzicznego raka jelita grubego niezwiązanego z polipowatością (HNPCC).
- Siatkówczak – wiadomo, że defekty w genie supresorowym guza Rb powodują ten nowotwór oka i kilka innych rodzajów nowotworów. Więcej na temat tej konkretnej choroby można znaleźć w sekcji na Rb
Jest to niekompletna lista znanych dziedzicznych typów raka, i jest pewne, że więcej dziedzicznych form raka będzie zidentyfikowanych jako genetyki różnych typów raka są wyjaśnione.
Więcej informacji na ten temat można znaleźć w rozdziałach 2 i 4 Biologii raka Roberta A. Weinberga.
Rodzaje mutacji
Proces, w którym białka są wykonane, tłumaczenie, opiera się na „czytaniu” mRNA, które zostało wyprodukowane w procesie transkrypcji. Wszelkie zmiany w DNA, który koduje gen, będzie prowadzić do zmiany mRNA produkowane. Zmienione mRNA może z kolei prowadzić do produkcji białka, które nie będzie już prawidłowo funkcjonować. Nawet zmiana pojedynczego nukleotydu wzdłuż DNA genu może prowadzić do powstania całkowicie niefunkcjonalnego białka.
Istnieje kilka różnych sposobów, w jakie DNA może zostać zmienione. Poniższa sekcja opisuje różne rodzaje zmian genetycznych w sposób bardziej szczegółowy.
Mutacje punktowe
Zmiany genetyczne mogą być umieszczone w dwóch ogólnych kategoriach. Pierwsza kategoria składa się ze zmian, które zmieniają tylko jeden lub kilka nukleotydów wzdłuż nici DNA. Te rodzaje zmian są określane jako mutacje punktowe.
Gdy rybosomy odczytują cząsteczkę RNA, każde trzy nukleotydy są interpretowane jako jeden aminokwas. Te trzy literowe kody nazywane są kodonami. Analogicznie do zdania angielskiego: „The fat cat ate the rat” zawierałoby 6 kodonów. Zmiany spowodowane mutacją mogą prowadzić do rzeczy takich jak „Gruby nietoperz zjadł szczura” lub „The fa” lub „The fat oca tat her at…”. Wpływ na białko zależy od miejsca wystąpienia zmiany i jej rodzaju.
Trzyliterowe kodony odczytywane przez rybosomy mogą być zmienione przez mutację na jeden z trzech sposobów:
Mutacje nonsensowne
Nowy kodon powoduje przedwczesne zakończenie białka, wytwarzając białko, które jest skrócone i często nie funkcjonuje prawidłowo lub w ogóle.
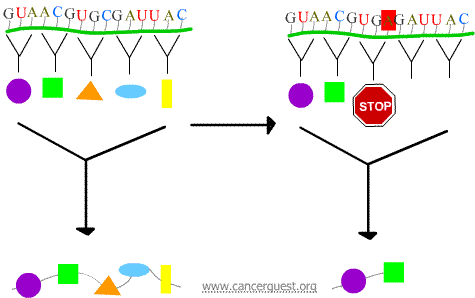
Mutacje typu missense
Nowy kodon powoduje wstawienie nieprawidłowego aminokwasu do białka. Wpływ na funkcję białka zależy od tego, co jest wstawiane w miejsce normalnego aminokwasu.

Mutacje przesunięcia ramki
Utrata lub zysk 1 lub 2 nukleotydów powoduje, że kodon dotknięty mutacją i wszystkie kodony, które po nim następują, są źle odczytywane. Prowadzi to do powstania bardzo różnych i często niefunkcjonalnych produktów białkowych.
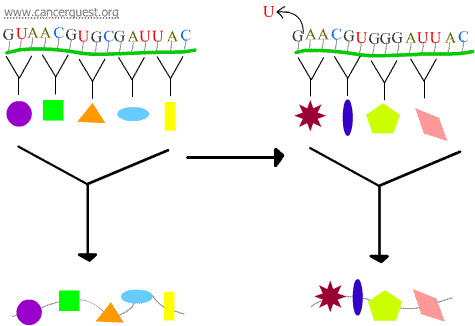
Błędy transkrypcji
Niektóre uszkodzenia DNA powodują powstanie zmodyfikowanego nukleotydu lub małej grupy nukleotydów, które nie mogą być „odczytane” przez polimerazę RNA. Kiedy kompleks polimerazy RNA dociera do tych miejsc, czasami omijają one uszkodzenia, dodając nukleotydy w celu kontynuowania pracy, nawet jeśli oznacza to wprowadzenie niewłaściwej rzeczy. Proces ten jest znany jako mutageneza transkrypcyjna i może odgrywać znaczącą rolę w rozwoju raka.5
Translokacje
Inna kategoria mutacji obejmuje zmiany większych ilości DNA, często na poziomie chromosomu. Są one nazywane translokacjami i obejmują pęknięcia i ruch fragmentów chromosomów. Często przerwy w dwóch różnych chromosomach pozwalają na tworzenie dwóch „nowych” chromosomów, z nowymi kombinacjami genów.
Mimo że mogłoby się wydawać, iż nie spowoduje to większych problemów, ponieważ wszystkie geny są nadal obecne, proces ten może prowadzić do rozregulowania wzrostu komórek na wiele sposobów-
1. Geny mogą nie być odpowiednio przepisywane i tłumaczone w nowej lokalizacji.
2. Przemieszczenie genu może prowadzić do zwiększenia lub zmniejszenia jego poziomu transkrypcji.
3. Złamanie i ponowne połączenie może również wystąpić w obrębie genu (jak pokazano na zielono powyżej), prowadząc do jego inaktywacji.
W przypadku niektórych nowotworów, poszczególne translokacje są bardzo powszechne i mogą być nawet wykorzystywane w diagnozowaniu choroby. Translokacje są powszechne w białaczkach i chłoniakach i rzadziej identyfikowane w nowotworach tkanek stałych. Przykładem może być zamiana pomiędzy chromosomami 9 i 22 występująca u ponad 90% pacjentów z przewlekłą białaczką szpikową (CML). Zamiana ta prowadzi do powstania skróconej formy chromosomu 22 zwanego chromosomem Filadelfia (od miejsca jego odkrycia). Ta translokacja prowadzi do powstania onkogenu z proto-onkogenu abl.67
Inne nowotwory, które są często (lub zawsze) związane z określonymi translokacjami, obejmują chłoniaka Burkitta, chłoniaki B-komórkowe i kilka rodzajów białaczek.
Amplifikacja genu
W tym bardzo nietypowym procesie normalny proces replikacji DNA jest poważnie uszkodzony. Rezultatem jest to, że zamiast tworzenia jednej kopii regionu chromosomu, produkowanych jest wiele kopii. Prowadzi to do produkcji wielu kopii genów, które znajdują się na tym regionie chromosomu. Czasami produkowanych jest tak wiele kopii amplifikowanego regionu, że mogą one faktycznie tworzyć własne małe pseudochromosomy zwane chromosomami podwójnej minuty.
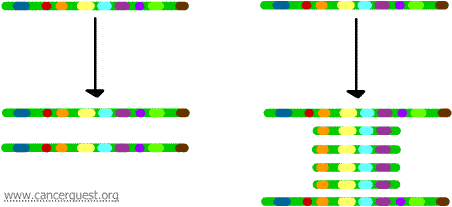
Geny na każdej z kopii mogą być przepisywane i tłumaczone, co prowadzi do nadprodukcji mRNA i białka odpowiadającego amplifikowanym genom, jak pokazano poniżej. Kwadratowe linie reprezentują mRNA produkowane poprzez transkrypcję każdej kopii genu.
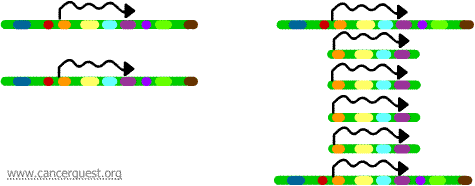
Choć proces ten nie jest widoczny w normalnych komórkach, występuje dość często w komórkach nowotworowych. Jeśli onkogen jest zawarty w amplifikowanym regionie, to wynikająca z tego nadekspresja tego genu może prowadzić do rozregulowania wzrostu komórek. Przykłady tego obejmują amplifikację onkogenu myc w szerokiej gamie nowotworów oraz amplifikację onkogenu ErbB-2 lub HER-2/neu w rakach piersi i jajników. W przypadku onkogenu HER-2/neu, terapie kliniczne zostały zaprojektowane tak, aby celować w komórki wykazujące nadekspresję produktu białkowego.
Amplifikacja genu przyczynia się również do jednego z największych problemów w leczeniu raka: oporności na leki. Nowotwory odporne na leki mogą nadal rosnąć i rozprzestrzeniać się nawet w obecności leków stosowanych w chemioterapii. Gen powszechnie zaangażowany w ten proces nazywany jest MDR, co oznacza oporność na wiele leków. Produkt białkowy tego genu działa jak pompa znajdująca się w błonie komórkowej. Jest on zdolny do selektywnego wyrzucania cząsteczek z komórki, w tym leków stosowanych w chemioterapii. To usunięcie powoduje, że leki stają się nieskuteczne.
Jest to omówione bardziej szczegółowo w sekcji Oporność na leki. Amplifikacja różnych genów może sprawić, że inne leki stosowane w chemioterapii będą nieskuteczne.
Inwersje, duplikacje i delecje
Inwersje
W tych zmianach segmenty DNA są uwalniane z chromosomu, a następnie ponownie wstawiane w przeciwnym kierunku. Podobnie jak w poprzednich przykładach, taka rearanżacja może prowadzić do nieprawidłowej ekspresji genu, albo poprzez aktywację onkogenu, albo dezaktywację genu supresorowego nowotworu.
Duplikacje/delecje
Poprzez błędy replikacji gen lub grupa genów może zostać skopiowana więcej niż jeden raz w obrębie chromosomu. Różni się to od amplifikacji genów tym, że geny nie są replikowane poza chromosom i są kopiowane tylko jeden dodatkowy raz, a nie setki czy tysiące razy. Geny mogą być również utracone z powodu niepowodzenia procesu replikacji lub innego uszkodzenia genetycznego.

Aneuploidia
Aneuploidia to zmiana genetyczna polegająca na utracie lub zyskaniu całych chromosomów. Ze względu na problemy w procesie podziału komórek, replikowane chromosomy mogą nie rozdzielać się dokładnie do komórek potomnych. Może to prowadzić do powstania komórek, które mają zbyt wiele lub zbyt mało chromosomów. Przykładem dość powszechnego stanu aneuploidalnego, który nie jest związany z nowotworem, jest zespół Downa, w którym występuje dodatkowa kopia chromosomu 21 we wszystkich komórkach osoby dotkniętej chorobą.
W poniższej animacji kopie dwóch chromosomów są tworzone, ale kiedy komórka dzieli się, chromosomy nie są rozmieszczone równomiernie w dwóch komórkach, które powstają (komórki córki). W rezultacie jedna z komórek ma zbyt wiele chromosomów, a jedna nie ma ich wystarczająco dużo.
Komórki nowotworowe są bardzo często aneuploidalne. Ludzie normalnie mają 46 chromosomów w swoich komórkach, ale komórki nowotworowe często mają ich znacznie więcej, czasami więcej niż 100. Obecność dodatkowych chromosomów sprawia, że komórki są niestabilne i poważnie zakłóca kontrolę nad podziałem komórek. Obecnie toczy się debata, czy wszystkie nowotwory są aneuploidalne, czy też nie. Niezależnie od tego, czy tak jest, jasne jest, że aneuploidia jest wspólną cechą komórek rakowych.
Zmiany epigenetyczne
Oprócz rzeczywistych zmian w sekwencji DNA, ekspresja genu może być zmieniona przez zmiany w DNA i chromatynie, które nie zmieniają sekwencji. Ponieważ zmiany te nie zmieniają sekwencji DNA w genach, są one określane jako zmiany epigenetyczne. Dwa rodzaje zmian epigenetycznych opisano poniżej.
Metylacja
W tej zmianie, niektóre nukleotydy w DNA są modyfikowane przez dodanie grupy metylowej (-CH3) do zasady. Metylacja DNA jest związana z inaktywacją tego konkretnego regionu DNA. Nieprawidłowe wzorce metylacji DNA zostały zaobserwowane w komórkach nowotworowych. Podobnie jak opisane zmiany, metylacja zmienia ekspresję dotkniętych genów.
Acetylacja
W tej zmianie epigenetycznej, białka histonowe, wokół których nawinięty jest DNA, ulegają modyfikacji poprzez dodanie grup acetylowych (-CH3CHO). Zmiana ta prowadzi do rozluźnienia interakcji DNA:histony i jest związana ze zwiększoną ekspresją genów. Modyfikacja procesów dodawania i usuwania grup acetylowych do DNA jest aktywnym obszarem badań nad leczeniem nowotworów.
Więcej o zmianach epigenetycznych i leczeniu nowotworów.
Przyczyny mutacji
Jak widzieliśmy, komórki nowotworowe powstają z prawidłowych komórek prekursorowych poprzez nagromadzenie uszkodzeń genetycznych. Mechanizmy, dzięki którym zmiany te są indukowane, są zróżnicowane. W szerokim znaczeniu, czynniki zmian genetycznych (mutacji) należą przede wszystkim do kategorii opisanych poniżej i są szczegółowo omówione w następnej sekcji.
Mutacje spontaniczne
Mutacje spontaniczne: Zasady (A, T, G, C) w DNA są zmieniane lub tracone z powodu nienaprawionych błędów replikacji lub przypadkowych zdarzeń molekularnych. Na przykład, utrata grupy aminowej z cytozyny, normalnej zasady występującej w DNA, prowadzi do wytworzenia uracylu, zasady, która normalnie nie występuje w DNA. Jeśli ta zmiana nie zostanie wykryta i odwrócona, może dojść do mutacji. Czasami cała zasada może zostać utracona w wyniku rozszczepienia wiązania między szkieletem DNA a zasadą. Prowadzi to do powstania luki w podwójnej helisie DNA, która, jeśli nie zostanie naprawiona, może doprowadzić do mutacji przy następnym kopiowaniu DNA (tj. podczas replikacji).
Mutacje indukowane
Mutacje indukowane: Mutacje mogą być wywołane przez wystawienie organizmów (lub komórek) na różne zabiegi. Niektóre z najczęstszych to:
Promieniowanie- Jeden z pierwszych znanych mutagenów, promieniowanie jest silnym induktorem mutacji. Różne rodzaje promieniowania powodują różne rodzaje zmian genetycznych. Promieniowanie ultrafioletowe (UV) powoduje mutacje punktowe. Promieniowanie rentgenowskie może powodować pęknięcia w podwójnej helisie DNA i prowadzić do translokacji, inwersji i innych rodzajów uszkodzeń chromosomów. Ekspozycja na promienie UV zawarte w świetle słonecznym jest związana z rakiem skóry. Należy zauważyć, że właściwości promieniowania niszczące DNA zostały wykorzystane w kilku różnych metodach leczenia raka opartych na promieniowaniu.
Poniżej przedstawiono rodzaj mutacji, która jest spowodowana promieniowaniem ultrafioletowym. W tym przykładzie, bombardowanie podwójnej helisy DNA przez promienie UV powoduje, że dwie zasady łączą się ze sobą. Zmienia to strukturę DNA i może prowadzić do trwałych zmian, jeśli nie zostanie naprawione.
Innym rodzajem promieniowania jest energia emitowana przez naturalnie występujące elementy radioaktywne (takie jak radon i uran) lub źródła stworzone przez człowieka, takie jak te znalezione (i stworzone) w reaktorach jądrowych. Promieniowanie tego typu występuje w różnych rodzajach i może powodować różnego rodzaju uszkodzenia komórek i tkanek. Promieniowanie może bezpośrednio uszkadzać DNA lub może powodować powstawanie substancji chemicznych (tj. reaktywnych form tlenu lub ROS), które mogą następnie uszkadzać DNA lub inne składniki komórek.
Narażenie na promieniowanie z materiałów radioaktywnych zostało dobrze udokumentowane. Analizy osób, które przeżyły zrzucenie bomb atomowych na Japonię podczas II wojny światowej, wykazały duży wzrost zachorowań na białaczki wkrótce po ekspozycji, a następnie wzrost zachorowań na inne rodzaje nowotworów w ciągu kolejnych dziesięcioleci.8
Niebezpieczne ilości materiałów radioaktywnych zostały również przypadkowo uwolnione z elektrowni jądrowych. Narażenie na promieniowanie w wyniku przypadkowego uwolnienia materiałów radioaktywnych z reaktora jądrowego w Czarnobylu było związane ze wzrostem zachorowań na raka tarczycy i inne nowotwory złośliwe.9
Medyczne urządzenia obrazujące (takie jak aparaty rentgenowskie i tomografy komputerowe) również narażają pacjentów na promieniowanie. Uważa się, że dawki stosowane w pojedynczym badaniu nie powodują znacznych ilości nowotworów, ale długoterminowy wpływ wielu badań w ciągu lat nie jest jasny.10 Podobnie, narażenie pasażerów samolotów na skanowanie całego ciała na lotniskach nie uważa się za powodujące ryzyko raka.11 Pasażerowie latający w samolotach są również narażeni na promieniowanie z przestrzeni kosmicznej, ale na niskim poziomie i nie uważa się, aby stanowiło ono ryzyko raka, nawet dla członków załogi samolotu.1112
Chemiczne mutageny- Wiele różnych substancji chemicznych jest znanych jako powodujące mutacje. Te substancje chemiczne wywierają swój wpływ poprzez wiązanie się z DNA lub elementami budulcowymi DNA oraz zakłócanie procesów replikacji lub transkrypcji. Niektóre przykłady silnych mutagenów to benzo-a-piren, substancja chemiczna występująca w dymie papierosowym, oraz aflatoksyna, mutagen najczęściej spotykany na niewłaściwie przechowywanych produktach rolnych.
Przewlekłe zapalenie- Przewlekłe zapalenie może prowadzić do uszkodzenia DNA z powodu produkcji mutagennych substancji chemicznych przez komórki układu odpornościowego. Przykładem może być długotrwały stan zapalny spowodowany zakażeniem wirusem zapalenia wątroby. Dowiedz się więcej o wirusach i raku.
Radykalne związki tlenu- Podczas wychwytywania energii z pożywienia, co ma miejsce w naszych mitochondriach, mogą być wytwarzane substancje chemiczne, które są bardzo reaktywne i zdolne do uszkadzania błon komórkowych i samego DNA. Te reaktywne intermediaty tlenowe (ROI) mogą być również generowane przez ekspozycję komórek na promieniowanie, jak pokazano poniżej.
Aktywność mutagenna ROI jest związana z rozwojem raka, jak również z działaniami kilku metod leczenia przeciwnowotworowego, w tym radioterapii i chemioterapii. 131415
Nieprawidłowy podział komórki
Podczas mitozy możliwe jest, że proces podziału komórki nie dzieli dokładnie zreplikowanych chromosomów na dwie komórki córki. Błąd tego typu prowadzi do wytworzenia komórek aneuploidalnych. Komórki te będą albo pozbawione, albo zyskają znaczną liczbę genów. Ten rzadki proces może prowadzić do powstania komórek, które są bardziej podatne na nieuregulowane podziały komórkowe. Jak stwierdzono wcześniej, duży odsetek nowotworów wyizolowanych od ludzi jest aneuploidalny.
Jeśli komórka ma mutację w genie, którego produkt białkowy jest odpowiedzialny za „sprawdzanie” procesu podziału, rzeczy mogą szybko wymknąć się spod kontroli i komórki córki każdego podziału mogą stać się coraz bardziej nienormalne.
Wirusy jako mutageny
Wirusy są uważane za odpowiedzialne za znaczny odsetek przypadków raka. Wirusy mogą powodować raka w różny sposób, a sposób działania każdego typu wirusa jest prawdopodobnie nieco inny. Niektóre wirusy (w tym wiele retrowirusów) mogą powodować mutacje poprzez wprowadzanie swoich genów do genomu zainfekowanej komórki. Wstawione DNA może zniszczyć lub zmienić aktywność dotkniętych genów.161718
Wirusy mogą również powodować mutacje w sposób pośredni. Jako przykład: Zakażenie wirusem zapalenia wątroby może trwać przez wiele lat. W tym czasie system obronny organizmu próbuje pozbyć się wirusa, wytwarzając toksyczne substancje chemiczne. Te substancje chemiczne mogą uszkadzać zdrowe komórki „przypadkowe”, kierując je na drogę, która prowadzi do raka. Istnieje wiele innych sposobów, w jakie wirusy mogą powodować raka.1920
Ze względu na znaczenie wirusów w rozwoju wielu nowotworów stworzyliśmy sekcję poświęconą wirusom i rakowi.
Transpozony jako mutageny
Transpozony są krótkimi sekwencjami DNA, które mają zdolność przemieszczania się z jednego miejsca w DNA do innego. Transpozony kodują enzym, transpozazę, który działa w celu przyłączenia transpozonu do nowych miejsc w genomie (patrz schemat transpozonu, poniżej po lewej). Transpozony zostały odkryte przez Barbarę McClintock, która za swoją pracę otrzymała nagrodę Nobla.2122 Ludzki genom zawiera wiele nieaktywnych kopii transpozonów, które utraciły zdolność do przemieszczania się lub „przeskakiwania” do nowych miejsc. Około 50% ludzkiego genomu składa się z „martwych” transpozonów.23
Przemieszczanie się aktywnych transpozonów może prowadzić do mutacji, zmieniając aktywność genów. Widocznym przykładem przemieszczania się transpozonów (zwanego transpozycją) jest zabarwienie ziaren w kukurydzy indyjskiej (patrz poniżej po prawej). Uważa się, że transpozony, które są aktywne u ludzi, są zaangażowane w ludzkie choroby, w tym nowotwory.242526


Podsumowanie mutacji
Zmiana genetyczna (mutacja) Wprowadzenie
- Nieprawidłowe zachowania wykazywane przez komórki nowotworowe są wynikiem serii mutacji w kluczowych genach regulacyjnych (tj. genach naprawy DNA).
- Myśli się, że większość nowotworów powstaje z pojedynczej komórki prekursorowej, która nabywa wystarczającą ilość mutacji, aby stać się komórką nowotworową.
Mutacje DNA
- Zmiany genetyczne mogą być małe, wpływając tylko na jeden lub kilka nukleotydów (mutacje punktowe) lub mogą być dość duże, zmieniając strukturę chromosomu lub chromosomów.
- Mutacje punktowe
- Translacja jest wytwarzaniem białka przez enzymy, które „czytają” trzy nukleotydowe „słowa” (kodony) wzdłuż posłańca RNA (mRNA).
- Nawet zmiana pojedynczego nukleotydu wzdłuż DNA genu może prowadzić do całkowicie niefunkcjonalnego białka. Mutacje są pogrupowane zgodnie ze zmianami, jakie tworzą w powstającym produkcie białkowym dotkniętego genu.
- Mutacje nonsensowne – Nowy (zmutowany) kodon powoduje przedwczesne zatrzymanie syntezy białka.
- Mutacje missensowne – Zmieniony kodon powoduje wstawienie nieprawidłowego aminokwasu do białka.
- Mutacje z przesunięciem ramki – Utrata lub wzmocnienie 1 lub 2 nukleotydów w mRNA powoduje błędne odczytanie kodonów. Często prowadzą do skrócenia i niefunkcjonalnych białek.
- Zmiany na poziomie chromosomów
- Translokacje – Przerwanie i (czasami) wymiana fragmentów chromosomów.
- Amplifikacja genów – Nieprawidłowa replikacja tworzy wiele kopii danego regionu chromosomu. Ostatecznie prowadzi to do nadprodukcji odpowiednich białek.
- Inwersje – Segmenty DNA są uwalniane z chromosomu, a następnie ponownie wstawiane w odwrotnej orientacji.
- Duplikacje/delecje – Gen lub grupa genów może zostać całkowicie utracona lub skopiowana więcej niż jeden raz w obrębie chromosomu.
- Aneuploidia – Zmiana genetyczna, która obejmuje utratę lub zysk całych chromosomów.
- Spontaniczne mutacje mogą wystąpić z powodu nienaprawionego DNA lub przypadkowych zdarzeń molekularnych.
- Aneuploidia jest bardzo powszechna w komórkach nowotworowych.
Zmiany epigenetyczne
- Wyrażenie genu może być zmienione przez zmiany w DNA i chromatynie, które nie zmieniają sekwencji genetycznej. Przykłady obejmują metylację DNA i acetylację histonów.
- Metylacja – Niektóre nukleotydy w DNA są modyfikowane przez dodanie grupy metylowej, co wiąże się z inaktywacją tego regionu DNA
- Acetylacja – Dodanie grup acetylowych rozluźnia DNA i zwiększa ekspresję genów.
Mutacje indukowane
- Mutacje mogą być indukowane przez wystawienie organizmów (lub komórek) na różne zabiegi:
- Promieniowanie – promienie UV powodują mutacje punktowe, a promienie X powodują wiele form uszkodzeń.
- Mutageny chemiczne – Mogą wiązać się z DNA lub elementami budulcowymi DNA i zakłócać procesy replikacji lub transkrypcji.
- Przewlekłe zapalenie – Uszkodzenie DNA z powodu produkcji mutagennych substancji chemicznych przez komórki układu odpornościowego
- Radniki tlenowe – Powstają w wyniku produkcji energii przez komórkę i mogą uszkadzać DNA.
Inne zmiany genetyczne
- Nieprawidłowy podział komórki powodujący nieprawidłowy podział chromosomów może prowadzić do aneuploidii.
- Wirusy mogą powodować uszkodzenia genetyczne na kilka różnych sposobów i są związane z szeroką gamą nowotworów.
Mutacja i rak
- Wydaje się, że przejście od normalnej, zdrowej komórki do komórki rakowej jest stopniowym postępem.
- Rozwój raka wymaga zmian genetycznych w kilku różnych onkogenach i supresorach guza.
- Wszystkie nowotwory muszą pokonać to samo spektrum funkcji regulacyjnych w celu wzrostu i postępu, ale zaangażowane geny mogą się różnić.
- Heterogenność nowotworów komplikuje diagnostykę i leczenie.
- Możliwe jest dziedziczenie dysfunkcyjnych genów prowadzące do rozwoju rodzinnej postaci danego typu nowotworu.
Poznaj Przepływ: Mutacja
Znaj Przepływ to interaktywna gra, dzięki której możesz sprawdzić swoją wiedzę. Aby zagrać:
- Przeciągnij odpowiednie wybory z kolumny po prawej stronie i umieść je w kolejności w polach po lewej stronie. Zauważ, że użyjesz tylko pięciu z sześciu wyborów, aby ukończyć grę.
- Po zakończeniu, kliknij na 'Sprawdź’, aby zobaczyć ile masz poprawnych odpowiedzi.
- W przypadku błędnych odpowiedzi, kliknij na 'Opis’, aby przejrzeć informacje o procesach.
- Aby spróbować ponownie, wybierz 'Reset’ i zacznij od nowa.
-
1
-
2
-
3
-
4
-
5
-
Dowiedz się więcejKomórka jest w trakcie procesu syntezy DNA
-
Dowiedz się więcejPowstaje wiele kopii regionu chromosomu
- .
Dowiedz się więcejTranskrypcja wzmocnionych genów
-
Dowiedz się więcejTranslacja wzmocnionych genów
-
Dowiedz się więcejNadprodukcja kluczowego białka Protein leads to growth of drug resistant tumor
-
Learn moreDuplication Occurs
Zagraj ponownie
- 1. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biology (11th ed.). Pearson.
- 2. Surveillance, Epidemioloy, and End Results (SEER) reprezentowany przez National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. „Tworzenie ludzkich komórek nowotworowych ze zdefiniowanymi elementami genetycznymi”. Nature 400: 464-468
- 4. Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. The origin and evolution of mutations in acute myeloid leukemia. Cell, July 20, 2012
- 5. Brégeon D, Doetsch PW. Transcriptional mutagenesis: causes and involvement in tumour development. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. „Chromosome studies on normal and leukemic human leukocytes”. J Natl Cancer Inst (1960). 25: 85-100.
- 7. Rowley JD. „Nowa spójna nieprawidłowość chromosomalna w przewlekłej białaczce szpikowej zidentyfikowana przez fluorescencję chinakryny i barwienie Giemsy”. Nature (1973). 243: 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. RISK OF CANCER AND NON-CANCER DISEASES IN THE ATOMIC BOMB SURVIVORS. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. The Chernobyl accident–an epidemiological perspective. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 Mar 9.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Exposure to low-dose ionizing radiation from medical imaging procedures. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Airport Full-Body Screening: What Is the Risk? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Promieniowanie kosmiczne w lotnictwie komercyjnym. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. „Stres oksydacyjny, uszkodzenia DNA i rak piersi.” AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. „Stres oksydacyjny i eksperymentalna kancerogeneza.” Indian J. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. „Rodniki tlenowe, peroksydacja lipidów i uszkodzenia DNA.” (2002)181-182:219-222
- 16. Nair V. Retrovirus-induced oncogenesis and safety of retroviral vectors. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Epstein-Barr virus and Burkitt lymphoma. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogenous retroviruses and cancer. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV-related hepatocellular carcinoma: From chronic inflammation to cancer. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. The origin and behavior of mutable loci in maize. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Wykład o Nagrodzie Nobla
- 23. Burns KH, Boeke JD. Human transposon tectonics. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Mobilne elementy genetyczne i nowotwory. From mutations to gene therapy. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Mobile elementy w ludzkim genomie: implikacje dla choroby. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Natural mutagenesis of human genomes by endogenous retrotransposons. Cell. 2010 Jun 25;141(7):1253-61.