Postanowiwszy ustalić istnienie jądra, można teraz rozważyć eksperymentalne dowody na jego wielkość, zaczynając od eksperymentu Rutherforda.
Podsumowanie lekcji
- Dyskusja i przykład praktyczny: Wielkość jądra (15 minut)
- Dyskusja: Rozmiar atomu i jądra (10 minut)
- Pytania uczniów: Siły i najbliższe zbliżenie (30 minut)
- Dyskusja: Liczba atomowa i ładunek na jądrze (5 minut)
- Dyskusja: Górna granica wielkości jądra (30 minut)
- Dyskusja: Zagadka na przyszłą lekcję (5 minut)
Dyskusja i przykład praktyczny: Wielkość jądra
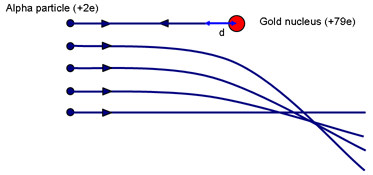
Możesz uzyskać wyobrażenie o możliwej wielkości jądra, myśląc o eksperymencie Rutherforda. Zapytaj: Jaki parametr zderzenia spowoduje, że cząstka najbardziej zbliży się do jądra? (Zderzenie czołowe z p = 0.)
Zasada zachowania energii jest wykorzystywana do obliczania odległości najbliższego zbliżenia jako miary wielkości jądra. Zrozumienie poniższych obliczeń zależy od tego, czy uczniowie zapoznali się z potencjałem elektrycznym i polami elektrycznymi. Alternatywnie służy to jako dobry materiał poglądowy.
Ekspozycja 522-1: Rozpraszanie cząstek alfa – odległość największego zbliżenia (Word, 29 KB)
Ekspozycja 522-2: Odległość największego zbliżenia (Word, 107 KB)
Gdy α zostanie chwilowo sprowadzona do stanu spoczynku (wspiąwszy się tak daleko, jak to tylko możliwe na wzgórze elektrostatyczne), praca zostanie wykonana przeciwko sile odpychającej z jądra. Energia kinetyczna α jest przechowywana w polu wokół jądra. Gdy prędkość jest zerowa, cała energia jest teraz przechowywana w polu.
Jeśli α chwilowo zatrzyma się w odległości d od (środka) jądra o ładunku Ze, energia w polu wynosi:
Eα = 14πε0 2e Zed
Jest to równe początkowej energii kinetycznej cząstki α. Rutherford użył źródła α podarowanego mu przez Madame Curie. Energia α wynosiła ~ 7,7 MeV.
Dla złota, Z = 79. Rozwiązywanie daje d ~ 3 × 10-14 m. Porównaj to ze średnicą atomów złota ~ 3 × 10-10 m. Tak więc jądro jest co najmniej 10 000 razy mniejsze od atomu. Ważne jest, aby podkreślić, że to obliczenie daje górną granicę wielkości jądra złota; nie możemy powiedzieć, że cząstka alfa dotyka jądra; bardziej energetyczna α może zbliżyć się jeszcze bardziej.
An atom jest w większości pusty (dlatego większość jak przeszedł prosto przez – jakiekolwiek elektrony prawie nie przeszkodziłyby stosunkowo masywnej α o dużej prędkości).
Dyskusja: Wielkość atomu i jądra
Zaproś uczniów, aby zaproponowali model atomu jądrowego w jakiejś skali. Na przykład: jeśli jądro miałoby średnicę 1 mm, to atom byłby 10 000 razy większy lub miałby 10 m średnicy. Wybierz odpowiednią pozycję dla 1 mm jądra (małe łożysko kulkowe lub kulka Blu-tac). Odmierz 5 m (pięć dużych kroków) do krawędzi atomu, gdzie znajdują się elektrony. Uwaga: podręcznikowe schematy atomu z jądrem nie są narysowane w skali.
Wzmocnij dokładny obraz przez poproszenie ucznia, aby stanął jako jądro, oszacuj jego obwód (40 cm?) i zapytaj, gdzie inny uczeń musiałby stanąć, aby być na krawędzi atomu. 104 × 40 cm = 4000 m}, więc promień tego atomu wynosi 2 km! Sprawdź lokalną mapę, aby znaleźć nazwane miejsce, które uczniowie rozpoznają, a które jest oddalone o 2 km.
Dalsze wzmocnienie: w ciele stałym, gdzie atomy są blisko siebie upakowane, odległość między sąsiednimi jądrami ~ wielkość atomu, tj. równoważna dwóm uczniom stojącym w odległości 4 km od siebie!
Więc to dość niesamowite, że jakikolwiek uderzył w jądro w ogóle. Oba są podobnej wielkości. Powierzchnia przekroju poprzecznego prezentowana przez jądro ~promień2, więc ~1 × 10-28 m2}.
Pytanie: Jak można by się spodziewać, że liczba odbitych promieni zależy od grubości folii metalowej zawierającej docelowe jądra? (Wyobraź sobie złote atomy w warstwach, szansa na odchylenie rośnie wraz z grubością, ale absorpcja w drodze do lub z powrotem z coraz grubszej folii w końcu zapobiegnie dalszemu wzrostowi liczby odbitych i wykrytych.
Bardzo pomocne jest, jeśli twoi studenci mogą przypomnieć sobie następujące rzędy wielkości:
Promień jądra atomowego ~ 10 -14m
Promień atomu ~ 10 -10m
Pytania dla studentów: Siły i najbliższe zbliżenie
Odcinek 522-3: Rozpraszanie Rutherforda: Kierunki działania sił (Word, 82 KB)
Epis 522-4: Rozpraszanie Rutherforda: Energia i najbliższe zbliżenie (Word, 83 KB)
Dyskusja: Liczba atomowa i ładunek na jądrze
Rutherford wykorzystał swoje dane do znalezienia ładunku jądra tarczy złota. Dalsze eksperymenty mające na celu znalezienie ładunku folii Cu, Ag i Pt dały:
| Liczba atomowa | Doświadczenie rozpraszające | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e |
| PT | 78 | 77.4 × e |
Tak więc ładunek elektryczny na jądrze jest dany przez liczbę atomową × e, czyli Z e. Z jednym wyjątkiem (wodór, H-1), Z jest zawsze mniejszy niż atomowa liczba masowa. Co więc wyjaśnia tę różnicę? Atom musi być elektrycznie obojętny. Rutherford zaproponował neutron.
Dyskusja: Górna granica wielkości jądra
Przypomnijmy, że analiza Rutherforda daje górną granicę wielkości na jądrze (d ~ 1 α energia cząstki). Rozmiar, który mierzymy zależy od energii cząstki α, której używamy. Potrzebujemy więc innego podejścia, aby znaleźć rozmiar jądra złota. Czy możesz wymyślić lepszą cząstkę do badania rozmiarów jądra? (Neutron – jako nienaładowany będzie bliżej.)
Inną techniką jest głębokie nieelastyczne rozpraszanie elektronów. Odnieś się, jeśli już zajmowałeś się falową naturą cząstek (fale de Broglie’a λ = hp), lub ten temat może być wstawiony tutaj, jeśli chcesz. Aparat do dyfrakcji elektronów ma podstawowe podobieństwo do rozpraszania cząstek. Elektrony są wystrzeliwane na cienką warstwę – w tym przypadku grafitu.
Rutherford miał szczęście, że długość fali de Broglie’a cząstek α (nieznanych mu) była dość mała, a odpychanie coulombowskie zatrzymuje się, gdy zbliżają się zbyt blisko – w przeciwnym razie efekty dyfrakcyjne pomieszałyby dane! (Spróbuj obliczeń, jeśli masz już omówione λ = hp.)
Epis 506-2: Interpretacja wzorów dyfrakcji elektronów (Word, 30 KB)
Epis 522-5: Głębokie rozpraszanie nieelastyczne (Word, 56 KB)
Epis 522-6: Elektrony mierzą wielkość jąder (Word, 42 KB)
Dyskusja: Zagadka na przyszłą lekcję
Z modelem Rutherforda wiąże się pewien fundamentalny problem. Zapytaj swoją klasę: Jak atom z centralnie położonym jądrem może być stabilny – dlaczego się nie rozpada? Zgodnie z klasyczną elektrodynamiką elektrony powinny emitować promieniowanie, gdy krążą po orbicie, i wpadać w spiralę do środka.
(Dobrze jest zostawić klasę z zagadką na przyszłą lekcję.)
Pobierz ten odcinek
.