Células contêm muita água. Uma das funções da água é dissolver diferentes materiais. Por exemplo, existem muitos compostos iónicos diferentes (sais) nas células. Os iões são usados para manter os potenciais celulares e são importantes na sinalização celular e contracção muscular.
Como se pode saber se um composto é iónico ou covalente?
Não há uma resposta simples a esta pergunta. Muitas ligações estão algures no meio. Numa ligação polar covalente, um par de electrões é partilhado entre dois átomos de modo a preencher os seus octetos, mas os electrões estão mais próximos de uma extremidade da ligação do que da outra. Há mais carga negativa numa extremidade da ligação, e isso deixa mais carga positiva na outra extremidade.
Olhar para os valores de eletronegatividade de diferentes átomos ajuda-nos a decidir quão uniformemente um par de elétrons em uma ligação é compartilhado. A eletronegatividade aumenta para o canto superior direito da tabela periódica devido a uma combinação de carga nuclear e fatores de blindagem. Os átomos no canto superior direito da tabela periódica têm uma atração maior pelos elétrons de ligação compartilhados, enquanto aqueles no canto inferior esquerdo têm uma atração mais fraca para os elétrons em ligações covalentes.
Em uma ligação carbono-oxigênio, mais elétrons seriam atraídos para o oxigênio porque ele está à direita do carbono em sua linha na tabela periódica. Compostos como , éter dimetílico, CH3OCH3, são um pouco polares. Formaldeído, CH2O, é ainda mais polar. Elétrons em ligações pi são mantidos mais soltos que elétrons em ligações sigma, por razões envolvendo mecânica quântica. Isso permite que o oxigênio puxe os elétrons para ele mais facilmente em uma ligação múltipla do que em uma ligação sigma.

Nem todas as polaridades são fáceis de determinar através de um olhar na tabela periódica. A direcção do dipolo numa ligação boro-hidrogénio seria difícil de prever sem olhar para os valores de electronegatividade, uma vez que o boro está mais para a direita mas o hidrogénio está mais acima. Acontece que o hidrogénio é ligeiramente negativo.
Uma ligação é iónica se a diferença de electronegatividade entre os átomos for suficientemente grande para que um átomo possa afastar um electrão completamente do outro. Essa situação é comum em compostos que combinam elementos da borda esquerda da tabela periódica (sódio, potássio, cálcio, etc.) com elementos do canto superior direito extremo da tabela periódica (mais comumente oxigênio, flúor, cloro). O cloreto de sódio é um composto iônico.
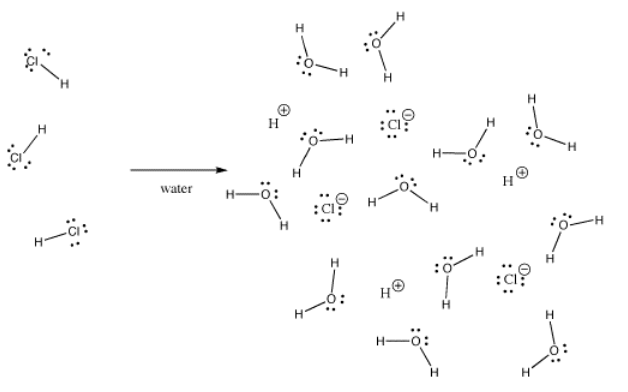
Muitas ligações podem ser covalentes em uma situação e iônicas em outra. Por exemplo, o cloreto de hidrogénio, HCl, é um gás em que o hidrogénio e o cloro estão covalentemente ligados, mas se o HCl for borbulhado em água, ele ioniza completamente para dar o H+ e Cl- de uma solução de ácido clorídrico. Mesmo em HCl gasoso, a carga não é distribuída uniformemente. O cloro é parcialmente negativo e o hidrogênio é parcialmente positivo.
Hidróxido de potássio, KOH, contém uma ligação que é covalente (O-H) e outra que é iônica (K-O). O hidrogênio é complicado porque está no topo da tabela periódica, assim como no lado esquerdo. Ele é apenas eletropositivo o suficiente para formar ligações iônicas em alguns casos. É apenas eletronegativo o suficiente para formar ligações covalentes em outros casos.
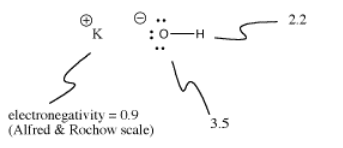
Em KOH, a ligação K-O é iônica porque a diferença de eletronegatividade entre o potássio e o oxigênio é grande. A diferença de eletronegatividade entre o oxigênio e o hidrogênio não é pequena. Uma ligação O-H pode por vezes ionizar, mas não em todos os casos.
Algumas vezes a ionização depende do que mais se está a passar dentro de uma molécula. Como a ligação K-O no hidróxido de potássio é iônica, a ligação O-H não é muito provável de ionizar. Já existe uma carga negativa sobre o oxigénio. A separação da carga custa energia, portanto é mais difícil colocar uma segunda carga negativa sobre o oxigênio ionizando a ligação O-H também. Frequentemente as primeiras ionizações nas moléculas são muito mais fáceis do que as segundas ionizações.
Exercício \(\PageIndex{1})
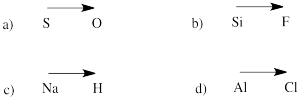
Prever a direcção da polaridade numa ligação entre os átomos nos pares seguintes:
>
a) enxofre-oxigénio b) silício-fluorina
c) hidrogénio-sódio d) cloro-alumínio
Resposta
 >
>
Porque é tão comum que um elemento da mão esquerda extrema da tabela periódica está presente como um catião, e que os elementos da extrema direita carregam uma carga negativa, podemos muitas vezes assumir que um composto contendo um exemplo de cada um terá pelo menos uma ligação iónica.
Exercício \(\PageIndex{2}\)
Traçar estruturas dos seguintes compostos. Cada um deles contém pelo menos um ânion e catião.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Resposta
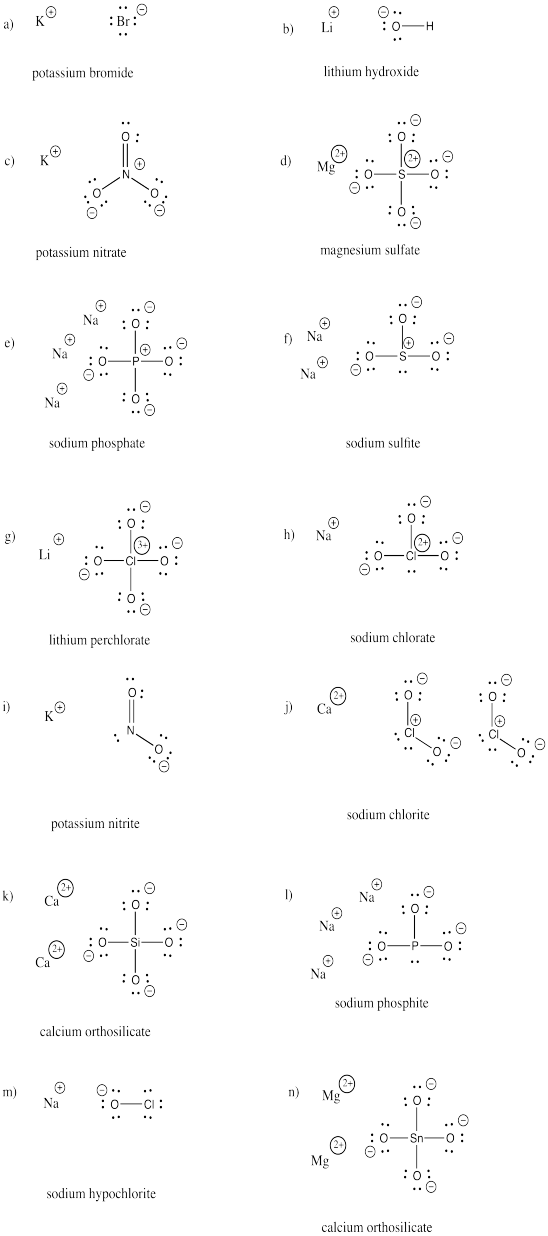
Exercício \(\PageIndex{3})
Ião amônico, NH4+, é um íon molecular comum. Desenhe estruturas para os seguintes compostos que incluem este íon.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Resposta
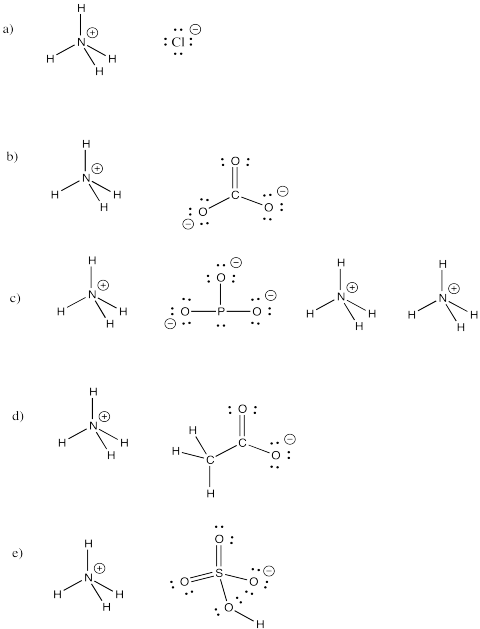
Exercício \(\PageIndex{4})
Muitos ânions têm nomes que lhe dizem algo sobre a sua estrutura.
| prefixo- ou -sufixo |
significado comum |
nome do exemplo | fórmula do exemplo |
| -ide | atom está presente como ânion | cloreto | Cl – |
| -ate | atom está presente como oxianião; geralmente uma forma comum | clorato | ClO3- |
| -ite | atom está presente como um oxianião, mas com menos oxigenados (ou menor “estado de oxidação”) que outra forma comum | clorito | ClO2- |
| per- | atom está presente como um oxianião, mas com ainda mais oxigénio do que a forma “-ate” | perclorato | ClO4- |
| hypo- | atom está presente como um oxianião, mas com ainda menos oxigenados que a forma “-ite” | hypochlorite | ClO- |
Usando a tabela como guia, proponha nomes para os seguintes ânions:
a) Br- b) O2- c) F- d) CO32- (oxianião comum) e) NO3- (oxianião comum) f) NO2-
g) S2- h) SO42- (oxanina comum) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (oxianião comum) o) PO33- p) I- q) IO3- (oxianião comum) r) IO4-
Resposta b)
óxido
Resposta c)
fluoreto
Resposta d)
carbonato
Resposta e)
nitrato
Resposta f)
nitrato
Resposta g)
sulfato
Resposta h)
sulfato
Resposta i)
sulfato
Resposta j)
persulfato
Resposta k)
carboneto
Resposta l)
nitride
Resposta m)
arsenida
Resposta n)
fosfato
Resposta o)
fosfito
Resposta p)
iodeto
Resposta q)
iodeto
Resposta r)
período
>
Atribuição
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)