Espectros de Emissões Atômicas
Os elétrons de um átomo tendem a ser dispostos de tal forma que a energia do átomo seja a mais baixa possível. O estado do solo de um átomo é o estado de energia mais baixo do átomo. Quando esses átomos recebem energia, os elétrons absorvem a energia e se movem para um nível de energia mais alto. Estes níveis de energia dos elétrons nos átomos são quantificados, o que significa novamente que o elétron deve mover-se de um nível de energia para outro em passos discretos, em vez de continuamente. Um estado excitado de um átomo é um estado em que a sua energia potencial é superior à do estado do solo. Um átomo em estado de excitação não é estável. Quando regressa ao estado de terra, liberta a energia que tinha ganho anteriormente sob a forma de radiação electromagnética.
Então como é que os átomos ganham energia em primeiro lugar? Uma maneira é passar uma corrente elétrica através de uma amostra fechada de um gás a baixa pressão. Como os níveis de energia dos electrões são únicos para cada elemento, cada tubo de descarga de gás brilhará com uma cor distinta dependendo da identidade do gás (ver abaixo).

Os sinais de “néon” são exemplos familiares de tubos de descarga de gás. Entretanto, apenas os sinais que brilham com a cor vermelho-alaranjado vistos na figura são na verdade preenchidos com néon. Sinais de outras cores contêm diferentes gases ou misturas de gases.
Os cientistas estudaram a cor rosa distintiva da descarga de gás criada pelo gás hidrogênio. Quando um feixe estreito desta luz foi visto através de um prisma, a luz foi separada em quatro linhas de comprimentos de onda muito específicos (e as freqüências desde lambda enu estão inversamente relacionadas). Um espectro de emissão atômica é o padrão de linhas formadas quando a luz passa através de um prisma para separá-lo nas diferentes freqüências de luz que ele contém. A figura abaixo mostra o espectro de emissão atômica do hidrogênio.
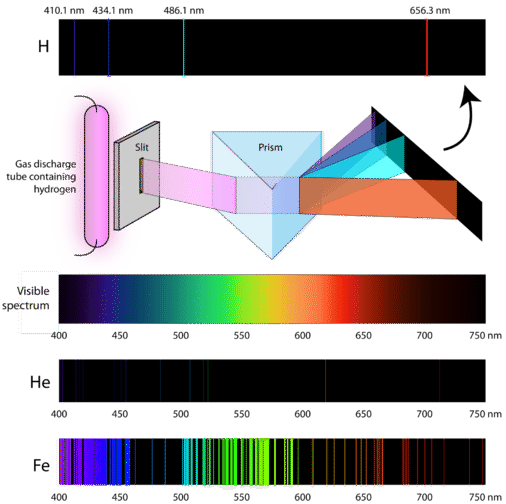
A teoria clássica foi incapaz de explicar a existência de espectros de emissão atômica, também conhecidos como espectros de emissão de linha. De acordo com a física clássica, um átomo em estado de terra seria capaz de absorver qualquer quantidade de energia em vez de apenas quantidades discretas. Da mesma forma, quando os átomos relaxassem de volta a um estado de energia mais baixo, qualquer quantidade de energia poderia ser liberada. Isto resultaria no que é conhecido como um espectro contínuo, onde todos os comprimentos de onda e frequências são representados. A luz branca vista através de um prisma e um arco-íris são exemplos de espectros contínuos. Os espectros de emissão atômica foram mais uma prova da natureza quantizada da luz e levaram a um novo modelo do átomo baseado na teoria quântica.