Tendências periódicas
Primeiro, vamos focar nos átomos individuais, e pensar nas tendências associadas com a posição de um elemento na tabela periódica. Vamos usar como nossos primeiros modelos os compostos orgânicos simples etano, metilamina e etanol, mas os conceitos se aplicam igualmente a biomoléculas mais complexas com as mesmas funcionalidades, por exemplo, as cadeias laterais dos aminoácidos alanina (alcano), lisina (amina) e serina (álcool).
Tendência periódica horizontal em acidez e basicidade: 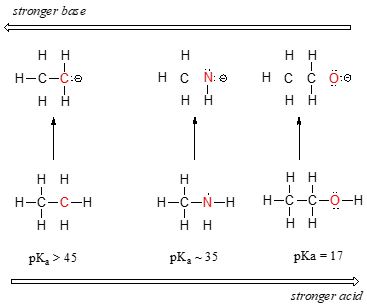 Vemos uma clara tendência em acidez à medida que nos movemos da esquerda para a direita ao longo da segunda linha da tabela periódica do carbono para o nitrogênio para o oxigênio. A chave para entender esta tendência é considerar a base conjugada hipotética em cada caso: quanto mais estável (mais fraca) a base conjugada, mais forte o ácido. Veja onde a carga negativa vai parar em cada base conjugada. Na base conjugada de etano, a carga negativa é suportada por um átomo de carbono, enquanto que na base conjugada de metilamina e etanol, a carga negativa está localizada sobre um nitrogênio e um oxigênio, respectivamente. Lembre-se da secção 2.4A que a electronegatividade também aumenta à medida que nos deslocamos da esquerda para a direita ao longo de uma linha da tabela periódica, o que significa que o oxigénio é o mais electronegativo dos três átomos, e o carbono o menos.
Vemos uma clara tendência em acidez à medida que nos movemos da esquerda para a direita ao longo da segunda linha da tabela periódica do carbono para o nitrogênio para o oxigênio. A chave para entender esta tendência é considerar a base conjugada hipotética em cada caso: quanto mais estável (mais fraca) a base conjugada, mais forte o ácido. Veja onde a carga negativa vai parar em cada base conjugada. Na base conjugada de etano, a carga negativa é suportada por um átomo de carbono, enquanto que na base conjugada de metilamina e etanol, a carga negativa está localizada sobre um nitrogênio e um oxigênio, respectivamente. Lembre-se da secção 2.4A que a electronegatividade também aumenta à medida que nos deslocamos da esquerda para a direita ao longo de uma linha da tabela periódica, o que significa que o oxigénio é o mais electronegativo dos três átomos, e o carbono o menos.
Assim, o anião metóxido é o mais estável (menor energia, menos básico) das três bases conjugadas, e o anião etilcarbão é o menos estável (maior energia, mais básico). Por outro lado, o etanol é o ácido mais forte e o etano o mais fraco.
Ao mover-se verticalmente dentro de uma dada coluna da tabela periódica, observamos novamente uma clara tendência periódica de acidez. Isto é melhor ilustrado com os haloácidos e halogenetos: a basicidade, como a eletronegatividade, aumenta à medida que nos movemos para cima da coluna.
Tendência periódica vertical em acidez e basicidade:  Conversamente, a acidez nos haloácidos aumenta à medida que descemos a coluna. Para dar sentido a esta tendência, vamos mais uma vez considerar a estabilidade das bases conjugadas. Como o flúor é o elemento halógeno mais electronegativo, podemos esperar que o flúor seja também o ião halógeno menos básico. Mas na verdade, ele é o menos estável e o mais básico! Acontece que ao mover-se verticalmente na tabela periódica, o tamanho do átomo supera sua eletronegatividade em relação à basicidade. O raio atómico do iodo é aproximadamente o dobro do do flúor, portanto, num ião iodeto, a carga negativa é distribuída por um volume significativamente maior:
Conversamente, a acidez nos haloácidos aumenta à medida que descemos a coluna. Para dar sentido a esta tendência, vamos mais uma vez considerar a estabilidade das bases conjugadas. Como o flúor é o elemento halógeno mais electronegativo, podemos esperar que o flúor seja também o ião halógeno menos básico. Mas na verdade, ele é o menos estável e o mais básico! Acontece que ao mover-se verticalmente na tabela periódica, o tamanho do átomo supera sua eletronegatividade em relação à basicidade. O raio atómico do iodo é aproximadamente o dobro do do flúor, portanto, num ião iodeto, a carga negativa é distribuída por um volume significativamente maior:  Isto ilustra um conceito fundamental na química orgânica: As cargas electrostáticas, sejam elas positivas ou negativas, são mais estáveis quando estão ‘espalhadas’ por uma área maior. Veremos esta ideia expressa repetidamente ao longo do nosso estudo da reactividade orgânica, em muitos contextos diferentes. Por enquanto, estamos aplicando o conceito apenas à influência do raio atômico na força da base. Como o flúor é o menos estável (mais básico) das bases conjugadas do haleto, HF é o menos ácido dos haloácidos, apenas ligeiramente mais forte que um ácido carboxílico. HI, com um \(pK_a) de cerca de -9, é quase tão forte quanto o ácido sulfúrico.
Isto ilustra um conceito fundamental na química orgânica: As cargas electrostáticas, sejam elas positivas ou negativas, são mais estáveis quando estão ‘espalhadas’ por uma área maior. Veremos esta ideia expressa repetidamente ao longo do nosso estudo da reactividade orgânica, em muitos contextos diferentes. Por enquanto, estamos aplicando o conceito apenas à influência do raio atômico na força da base. Como o flúor é o menos estável (mais básico) das bases conjugadas do haleto, HF é o menos ácido dos haloácidos, apenas ligeiramente mais forte que um ácido carboxílico. HI, com um \(pK_a) de cerca de -9, é quase tão forte quanto o ácido sulfúrico.
Mais importante para o estudo da química orgânica biológica, esta tendência nos diz que os tióis são mais ácidos que os álcoois. O {\i1}(pK_a}) do grupo do tiol na cadeia lateral da cisteína, por exemplo, é aproximadamente 8,3, enquanto o {\i1}(pK_a} para o grupo do álcool na cadeia lateral da serina é da ordem de 17,
Lembro-me do conceito de ‘força motriz’ que foi introduzido na secção 6.2? Lembre-se que a força motriz de uma reação é geralmente baseada em dois fatores: estabilidade relativa de carga e energia relativa total da ligação. Vamos ver como isso se aplica a uma simples reação ácido-base entre ácido clorídrico e íon flúor: Sabemos que o HCl (\(pK_a)-7) é um ácido mais forte que o HF (\(pK_a)3.2), então o equilíbrio para a reação está no lado do produto: a reação é exergônica, e uma ‘força motriz’ empurra o reagente para o produto. O que explica essa força motriz? Considere primeiro o fator de carga: como acabamos de aprender, o íon cloreto (no lado do produto) é mais estável que o íon flúor (no lado do reagente). Isto explica parcialmente a força motriz que vai do reagente ao produto nesta reação: vamos de um íon menos estável para um íon mais estável. E a energia total da ligação, o outro fator na força motriz? Se você consultar uma tabela de energias de ligação, você verá que a ligação H-F no lado do produto é mais energética (mais forte) do que a ligação H-Cl no lado reativo: 570 kJ/mol vs 432 kJ/mol, respectivamente). Isto também contribui para a força motriz: estamos passando de uma ligação mais fraca (menos estável) para uma ligação mais forte (mais estável).