Objectivos de aprendizagem
- Descrever as características de um gás.
As três fases (ou estados) comuns da matéria são os gases, líquidos e sólidos. Os gases têm a menor densidade das três, são altamente compressíveis, e enchem completamente qualquer recipiente em que são colocados. Os gases comportam-se desta forma porque as suas forças intermoleculares são relativamente fracas, por isso as suas moléculas estão em constante movimento independentemente das outras moléculas presentes. Os sólidos, pelo contrário, são relativamente densos, rígidos e incompressíveis porque as suas forças intermoleculares são tão fortes que as moléculas estão essencialmente fechadas no lugar. Os líquidos são relativamente densos e incompressíveis, como os sólidos, mas fluem rapidamente para se adaptarem à forma dos seus recipientes, como os gases. Podemos, portanto, concluir que a soma das forças intermoleculares nos líquidos se situa entre as dos gases e as dos sólidos. A Figura 10.1.1 compara os três estados da matéria e ilustra as diferenças a nível molecular.
Figure 10.1.1 Uma Substância Diatômica (O2) nos Estados Sólido, Líquido e Gasoso
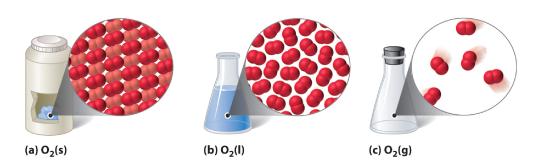
(a) O2 Sólido tem um volume e uma forma fixos, e as moléculas são empacotadas firmemente juntas. (b) O O2 líquido está em conformidade com a forma do seu recipiente mas tem um volume fixo; contém moléculas relativamente densamente embaladas. (c) O O2 gasoso enche completamente o seu recipiente – independentemente do tamanho ou forma do recipiente – e consiste em moléculas amplamente separadas.
O estado de uma determinada substância depende fortemente das condições. Por exemplo, o H2O é comumente encontrado nos três estados: gelo sólido, água líquida, e vapor de água (sua forma gasosa). Na maioria das condições, encontramos a água como o líquido essencial para a vida; bebemo-la, cozinhamos com ela e banhamo-nos nela. Quando a temperatura está fria o suficiente para transformar o líquido em gelo, podemos esquiar ou patinar sobre ele, embalá-lo em uma bola de neve ou cone de neve, e até mesmo construir moradias com ele. Vapor de água A distinção entre um gás e um vapor é sutil: o termo vapor refere-se à forma gasosa de uma substância que é um líquido ou um sólido em condições normais (25°C, 1.0 atm). O nitrogênio (N2) e o oxigênio (O2) são assim chamados de gases, mas a água gasosa na atmosfera é chamada vapor de água. é um componente do ar que respiramos, e é produzido sempre que aquecemos água para cozinhar alimentos ou para fazer café ou chá. O vapor de água a temperaturas superiores a 100°C é chamado de vapor. O vapor é usado para acionar grandes máquinas, incluindo turbinas que geram eletricidade. As propriedades dos três estados da água estão resumidas na Tabela 10.1.1
A estrutura geométrica e as propriedades físicas e químicas dos átomos, íons e moléculas geralmente não dependem do seu estado físico; as moléculas individuais de água no gelo, água líquida e vapor, por exemplo, são todas idênticas. Em contraste, as propriedades macroscópicas de uma substância dependem fortemente do seu estado físico, que é determinado por forças e condições intermoleculares como temperatura e pressão.
Figure 10.1.2 mostra os locais na tabela periódica desses elementos que são comumente encontrados nos estados gasoso, líquido e sólido. Com exceção do hidrogênio, os elementos que ocorrem naturalmente como gases estão no lado direito da tabela periódica. Destes, todos os gases nobres (grupo 18) são gases monatômicos, enquanto os outros elementos gasosos são moléculas diatômicas (H2, N2, O2, F2, e Cl2). O oxigênio também pode formar uma segunda alotrópica, a molécula triatômica altamente reativa ozônio (O3), que também é um gás. Em contraste, o bromo (como Br2) e o mercúrio (Hg) são líquidos em condições normais (25°C e 1,0 atm, comumente chamados de “temperatura e pressão ambiente”). O gálio (Ga), que derrete a apenas 29,76°C, pode ser convertido em líquido simplesmente segurando um recipiente com ele na mão ou mantendo-o em uma sala sem ar condicionado em um dia quente de verão. O resto dos elementos são todos sólidos em condições normais.
Figure 10.1.2 Elementos que ocorrem naturalmente como gases, líquidos e sólidos a 25°C e 1 atm
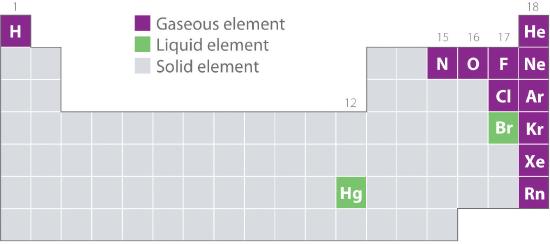
Os gases nobres e o mercúrio ocorrem como espécies monatómicas, enquanto todos os outros gases e o bromo são moléculas diatómicas.
Muitos dos elementos e compostos que encontramos até agora são tipicamente encontrados como gases; alguns dos mais comuns estão listados na Tabela 10.1.2 . As substâncias gasosas incluem muitos hidretos binários, tais como os halogenetos de hidrogênio (HX); hidretos dos calcogenos; hidretos do grupo 15 elementos N, P e As; hidretos do grupo 14 elementos C, Si e Ge; e diborano (B2H6). Além disso, muitos dos óxidos covalentes simples dos não metais são gases, tais como CO, CO2, NO, NO2, SO2, SO3, e ClO2. Muitos compostos orgânicos de baixa massa molecular também são gases, incluindo todos os hidrocarbonetos com quatro ou menos átomos de carbono e moléculas simples como éter dimetílico, cloreto de metilo (CH3Cl), formaldeído (CH2O) e acetaldeído (CH3CHO). Finalmente, refrigerantes como os clorofluorocarbonos (CFC) e os hidroclorofluorocarbonos (HCFC) são gases que podem ser facilmente liquefeitos por compressão e, por sua vez, os líquidos podem ser transformados em gases, diminuindo a pressão sobre os líquidos. A mudança de fase de líquido para gás em tubos dentro da geladeira esfria, enquanto a compressão em bobinas no fundo ou na parte de trás da geladeira aquece a sala. Amônia e SO2 são outros gases compressíveis que foram utilizados como refrigerantes, mas não podem ser utilizados em casas devido à sua natureza venenosa. A amônia ainda é utilizada como um refrigerante em grandes ambientes comerciais devido à sua eficiência e baixo custo.
Todas as substâncias gasosas mencionadas anteriormente (excepto os gases nobres monatómicos) contêm ligações covalentes ou polares covalentes e são moléculas não polares ou polares. Em contraste, as fortes atrações eletrostáticas em compostos iônicos, como NaBr (ponto de ebulição = 1390°C) ou LiF (ponto de ebulição = 1673°C), os impedem de existir como gases à temperatura e pressão ambiente. Além disso, os membros mais leves de uma determinada família de compostos são provavelmente gases, e os pontos de ebulição dos compostos polares são geralmente maiores do que os dos compostos não polares de massa molecular semelhante. Portanto, em uma determinada série de compostos, os membros mais leves e menos polares são os que têm maior probabilidade de serem gases. Com relativamente poucas exceções, entretanto, compostos com mais de cerca de cinco átomos do período 2 ou abaixo são muito pesados para existir como gases em condições normais.
Note the Pattern
As substâncias gasosas freqüentemente contêm ligações covalentes ou polar covalentes, existem como moléculas não polares ou ligeiramente polares, têm massas moleculares relativamente baixas, e contêm cinco ou menos átomos dos períodos 1 ou 2.
Embora os gases tenham uma ampla gama de usos, acredita-se que um uso particularmente desagradável de uma substância gasosa tenha sido empregado pelos persas na cidade romana de Dura, no leste da Síria, no terceiro século AD. Os persas cavaram um túnel sob a muralha da cidade para entrar e conquistar a cidade. As evidências arqueológicas sugerem que quando os romanos responderam com contra-túneis para deter o cerco, os persas acenderam betumes e cristais de enxofre para produzir um gás denso e venenoso. É provável que o fole ou as chaminés tenham distribuído os fumos tóxicos. Os restos de cerca de 20 soldados romanos foram descobertos na base da muralha da cidade, na entrada de um túnel com menos de 2 m de altura e 11 m de comprimento. Como é altamente improvável que os persas pudessem ter abatido tantos romanos na entrada de um espaço tão confinado, os arqueólogos especulam que os antigos persas usavam a guerra química para conquistar com sucesso a cidade.
Exemplo 10.1.1
Que compostos você previria que fossem gases à temperatura e pressão ambiente?
- cyclohexene
- carbonato de lítio
- cyclobutane
- óxido de vanádio(III)
- ácido benzóico (C6H5CO2H)
Dado: compostos
>
Passado para: estado físico
>
Estratégia:
>
A Decidir se cada composto é iónico ou covalente. Um composto iônico é muito provavelmente um sólido à temperatura e pressão ambiente, enquanto um composto covalente pode ser um sólido, um líquido ou um gás.
B Entre os compostos covalentes, aqueles que são relativamente não-polares e têm baixas massas moleculares são muito provavelmente gases à temperatura e pressão ambiente.
Solução:
A carbonato de lítio é Li2CO3, contendo íons Li+ e CO32, e óxido de vanádio(III) é V2O3, contendo íons V3+ e O2-. Ambos são principalmente compostos iônicos, que se espera que sejam sólidos. Os três compostos restantes são todos covalentes.
B O ácido benzóico tem mais de quatro átomos de carbono e é polar, por isso não é provável que seja um gás. Tanto o ciclohexeno quanto o ciclobutano são essencialmente moléculas não polares, mas o ciclobutano (C4H8) tem uma massa molecular significativamente menor que o ciclohexeno (C6H10), que novamente tem mais de quatro átomos de carbono. Portanto, prevemos que o ciclobutano é muito provavelmente um gás à temperatura e pressão ambiente, enquanto que o ciclohexeno é um líquido. De facto, com um ponto de ebulição de apenas 12°C, comparado com 83°C para o ciclohexeno, o cicloobutano é de facto um gás à temperatura e pressão ambiente.
Exercicio
Que compostos prevê que sejam gases à temperatura e pressão ambiente?
- n-butanol
- fluoreto de amónio (NH4F)
- ClF
-
Óxido de etileno
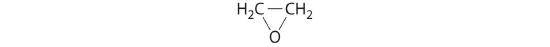 >
> - HClO4
Resposta: c; d
>
Resumo
>
Matéria bruta pode existir em três estados: gasosa, líquida e sólida. Os gases têm a menor densidade dos três, são altamente compressíveis, e enchem completamente os seus recipientes. Os elementos que existem como gases à temperatura e pressão ambiente estão agrupados no lado direito da tabela periódica; eles ocorrem como gases monatômicos (os gases nobres) ou moléculas diatômicas (alguns halogênios, N2, O2). Muitos compostos inorgânicos e orgânicos com quatro ou menos átomos não-hidrogênicos também são gases à temperatura e pressão ambiente. Todas as substâncias gasosas são caracterizadas por fracas interacções entre as moléculas ou átomos constituintes.
Key Takeaway
- As moléculas em substâncias gasosas frequentemente contêm ligações covalentes ou polares, são moléculas não polares ou ligeiramente polares, e têm massas moleculares relativamente baixas.
Problemas conceptuais
-
Explicar as diferenças entre as propriedades microscópicas e macroscópicas da matéria. O ponto de ebulição de um composto é uma propriedade microscópica ou macroscópica? massa molecular? Porquê?
-
Determine se o ponto de fusão, o momento dipolo e a condutividade eléctrica são propriedades macroscópicas ou microscópicas da matéria e explique o seu raciocínio.
-
Como é que as propriedades microscópicas da matéria influenciam as propriedades macroscópicas? Você pode relacionar a massa molecular com o ponto de ebulição? Porquê ou porque não? A polaridade pode ser relacionada ao ponto de ebulição?
-
Para uma substância que tem fases gasosas, líquidas e sólidas, organize estas fases em ordem de aumento
- densidade.
- resistência das interações intermoleculares.
- compressibilidade.
- moção molecular.
- ordem na disposição das moléculas ou átomos.
-
Explicar o que está errado com esta afirmação: “O estado da matéria determina em grande parte as propriedades moleculares de uma substância.”
-
Descrever os factores mais importantes que determinam o estado de um dado composto. Que condições externas influenciam se uma substância existe em qualquer um dos três estados da matéria?
-
Que elementos da tabela periódica existem como gases à temperatura e pressão ambiente? Destes, quais são moléculas diatómicas e quais são monatómicas? Quais são os elementos líquidos à temperatura e pressão ambiente? Que porção da tabela periódica contém elementos cujos hidretos binários são gases mais prováveis à temperatura ambiente?
-
É correcta a seguinte observação? “Quase todos os hidretos binários não metálicos são gases à temperatura ambiente, mas os hidretos metálicos são todos sólidos”. Explique o seu raciocínio.
-
É a seguinte observação correcta? “Todos os hidretos dos calcogénicos são gases à temperatura e pressão ambiente, excepto o hidreto binário de oxigénio, que é um líquido”. Explique o seu raciocínio. Você espera que 1-cloropropano seja um gás? iodopropano? Porque?
-
Explique porque é que os compostos iónicos não são gases em condições normais.
Respostas
As propriedades moleculares de uma substância controlam o seu estado da matéria sob um determinado conjunto de condições, e não o contrário. A presença de fortes forças intermoleculares favorece um estado condensado da matéria (líquida ou sólida), enquanto que a interação intermolecular muito fraca favorece o estado gasoso. Além disso, a forma das moléculas dita se uma fase condensada é líquida ou sólida.
Elementos que existem como gases são encontrados principalmente no canto superior direito e no lado direito da tabela periódica. Os seguintes elementos existem como gases: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, e Rn. Assim, metade dos halógenos, todos os gases nobres e os mais leves calcogênicos e picnogênicos são gases. Destes, todos, exceto os gases nobres, existem como moléculas diatômicas. Apenas dois elementos existem como líquidos a uma temperatura ambiente normal de 20°C-25°C: o mercúrio e o bromo. A parte superior direita da tabela periódica também inclui a maioria dos elementos cujos hidretos binários são gases. Além disso, os hidretos binários dos elementos dos Grupos 14-16 são gases.