Instabilidade estrutural das enzimas
O facto de os locais activos serem tão bem adaptados para proporcionar condições ambientais específicas também significa que estão sujeitos a influências do ambiente local. É verdade que o aumento da temperatura ambiente geralmente aumenta as taxas de reação, catalisadas por enzimas ou não. No entanto, o aumento ou diminuição da temperatura fora de uma faixa ótima pode afetar as ligações químicas dentro do local ativo de tal forma que elas são menos adequadas para a ligação de substratos. As altas temperaturas acabarão por desnaturar enzimas, como outras moléculas biológicas, um processo que altera as propriedades naturais de uma substância. Da mesma forma, o pH do ambiente local também pode afetar a função enzimática. Os resíduos ativos de aminoácidos do local têm suas próprias propriedades ácidas ou básicas que são ideais para a catálise. Estes resíduos são sensíveis a mudanças no pH que podem prejudicar a forma como as moléculas do substrato se ligam. As enzimas são adequadas para funcionar melhor dentro de uma certa faixa de pH e, como acontece com a temperatura, valores extremos de pH (ácido ou básico) do ambiente podem causar desnaturar as enzimas.
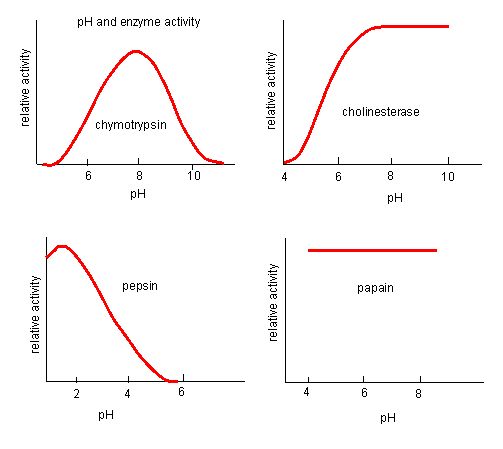
Figure 4. As enzimas têm um pH óptimo. O pH no qual a enzima é mais ativa será o pH onde os grupos R do local ativo são protonados/deprotonados de tal forma que o substrato pode entrar no local ativo e o passo inicial da reação pode começar. Algumas enzimas requerem um pH muito baixo (ácido) para serem completamente activas. No corpo humano, estas enzimas estão muito provavelmente localizadas no estômago inferior, ou localizadas em lisossomas (uma organela celular usada para digerir grandes compostos dentro da célula).
Fonte: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
O processo onde as enzimas desnaturam geralmente começa com o desenrolar da estrutura terciária através da desestabilização das ligações que mantêm a estrutura terciária unida. Ligações de hidrogênio, ligações iônicas e ligações covalentes (pontes de dissulfeto e ligações de peptídeo) podem ser interrompidas por grandes mudanças no temperado e no pH. Usando o gráfico de atividade enzimática e temperatura abaixo, faça uma história de energia para a enzima vermelha. Explique o que pode estar acontecendo de 37 °C a 95 °C.
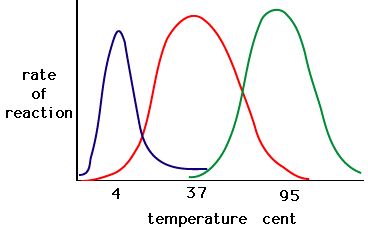
Figure 5. As enzimas têm uma temperatura óptima. A temperatura em que a enzima é mais ativa será geralmente a temperatura em que a estrutura da enzima é estável ou não comprometida. Algumas enzimas requerem uma temperatura específica para permanecerem activas e não desnaturadas. Source: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Função enzimática e ajuste induzido
Durante muitos anos, os cientistas pensaram que a ligação enzimática-substrato ocorreu de uma forma simples “lock-and-key”. Este modelo afirmava que a enzima e o substrato se encaixavam perfeitamente em uma única etapa instantânea. Contudo, a pesquisa atual suporta uma visão mais refinada chamada de encaixe induzido. O modelo de encaixe induzido expande o modelo lock-and-key ao descrever uma interação mais dinâmica entre a enzima e o substrato. À medida que a enzima e o substrato se unem, a sua interacção causa uma ligeira mudança na estrutura da enzima que confirma um arranjo de ligação mais produtivo entre a enzima e o estado de transição do substrato. Esta ligação energeticamente favorável maximiza a capacidade da enzima de catalisar sua reação.
Quando uma enzima liga seu substrato, um complexo enzimático-substrato é formado. Este complexo diminui a energia de ativação da reação e promove sua rápida progressão em uma de muitas maneiras. A um nível básico, as enzimas promovem reacções químicas que envolvem mais do que um substrato, reunindo os substratos numa orientação óptima. A região apropriada (átomos e ligações) de uma molécula é justaposta à região apropriada da outra molécula com a qual ela deve reagir. Outra forma pela qual as enzimas promovem a reação de seus substratos é criando um ambiente energeticamente favorável dentro do local ativo para que a reação ocorra. Certas reacções químicas podem ocorrer melhor num ambiente ligeiramente ácido ou não-polar. As propriedades químicas que surgem do arranjo particular de resíduos de aminoácidos dentro de um local ativo criam o ambiente energeticamente favorável para que os substratos específicos de uma enzima reajam.
A energia de ativação necessária para muitas reações inclui a energia envolvida em ligas químicas ligeiramente contorcidas para que elas possam reagir mais facilmente. A ação enzimática pode ajudar neste processo. O complexo enzimático-substrato pode reduzir a energia de ativação ao contorcer as moléculas do substrato de forma a facilitar a quebra da ligação. Finalmente, as enzimas também podem diminuir as energias de ativação ao participar da própria reação química. Os resíduos de aminoácidos podem fornecer certos íons ou grupos químicos que realmente formam ligações covalentes com as moléculas do substrato como uma etapa necessária do processo de reação. Nesses casos, é importante lembrar que a enzima sempre voltará ao seu estado original na conclusão da reação. Uma das propriedades marcantes das enzimas é que elas permanecem inalteradas pelas reacções que elas catalisam. Depois que uma enzima é feita catalisando uma reação, ela libera seu(s) produto(s).
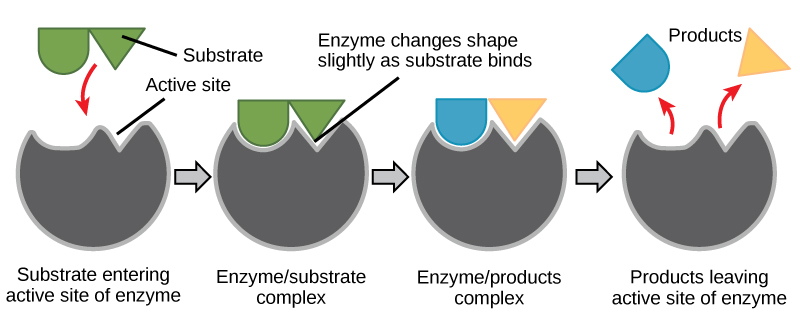
Figure 6. De acordo com o modelo de ajuste induzido, tanto a enzima como o substrato sofrem alterações conformacionais dinâmicas após a ligação. A enzima contorce o substrato em seu estado de transição, aumentando assim a taxa da reação.
Criando uma história energética para a reação acima
Usando a Figura 6, responda as questões colocadas na história energética.
1. O que são os reagentes? Quais são os produtos?
2. Que trabalho foi realizado pela enzima?
3. Em que estado se encontra a energia inicialmente? Em que estado está a energia transformada no estado final? Este ainda pode ser complicado, mas tente identificar onde está a energia no estado inicial e no estado final.