A partir do experimento de Rutherford, você pode agora considerar evidências experimentais para o seu tamanho.
Síntese da lição
- Discussão e exemplo trabalhado: Tamanho do núcleo (15 minutos)
- Discussão: Tamanho do núcleo e atómico (10 minutos)
- Perguntas aos alunos: Forças e abordagem mais próxima (30 minutos)
- Discussão: Número atómico e a carga num núcleo (5 minutos)
- Discussão: Limite superior do tamanho nuclear (30 minutos)
- Discussão: Um puzzle para uma lição futura (5 minutos)
Discussão e exemplo trabalhado: Tamanho do núcleo
Pode ter uma ideia do possível tamanho do núcleo, pensando na experiência de Rutherford. Pergunte: Que parâmetro de impacto resultará em uma partícula se aproximar do núcleo? (Uma colisão frontal com p = 0.)
O princípio da conservação de energia é usado para calcular a distância de aproximação mais próxima como uma medida para o tamanho de um núcleo. A compreensão do cálculo que se segue depende se os alunos cobriram o potencial eléctrico e os campos. Alternativamente serve como boa revisão.
Episódio 522-1: Dispersão de partículas Alfa – distância de aproximação mais próxima (Word, 29 KB)
Episódio 522-2: Distância de aproximação mais próxima (Word, 107 KB)
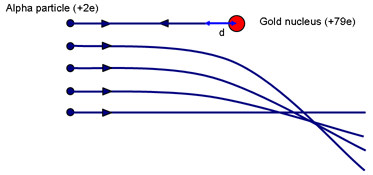
Quando o α é trazido momentaneamente para descansar (tendo subido o máximo que pode até a colina eletrostática) o trabalho terá sido feito contra a força repulsiva do núcleo. A energia cinética do α é armazenada no campo ao redor do núcleo. Quando a velocidade é zero, toda a energia é agora armazenada no campo.
Se o α parar momentaneamente quando a uma distância d do (centro do) núcleo de carga Ze, a energia no campo é:
Eα = 14πε0 2e Zed
Esta é igual à energia cinética inicial da partícula α. Rutherford usou uma fonte α dada a ele pela Madame Curie. A energia α era ~ 7.7 MeV.
Para ouro, Z = 79. A resolução dá d ~ 3 × 10-14 m. Compare isto com o diâmetro dos átomos de ouro ~ 3 × 10-10 m. Então um núcleo é pelo menos 10 000 vezes menor que um átomo. É importante enfatizar que este cálculo dá um limite superior no tamanho do núcleo de ouro; não podemos dizer que a partícula alfa toca o núcleo; um mais energético α pode se aproximar ainda mais.
Um átomo está na maioria das vezes vazio (e é por isso que a maioria dos elétrons, como passou direto – qualquer elétron dificilmente impediria a relativamente maciça alta velocidade α).
Discussão: Tamanho atómico e do núcleo
Ask seus alunos para sugerir um modelo em escala do átomo nuclear. Por exemplo: se um núcleo tivesse 1 mm de diâmetro, um átomo seria 10 000 vezes maior ou 10 m de diâmetro. Escolha uma posição adequada para um núcleo de 1 mm (um pequeno rolamento de esferas ou esfera de Blu-tac). Pisar 5 m (cinco grandes passos) até a borda do átomo onde os elétrons estão. NB: diagramas de um átomo com núcleo não são desenhados à escala.
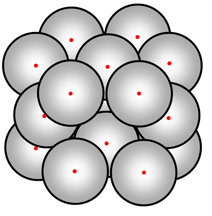
Reinforça uma imagem precisa fazendo com que um aluno se levante como núcleo, estime sua circunferência (40 cm?) e pergunte onde outro aluno teria que estar na borda do átomo. 104 × 40 cm = 4000 m}, então o raio deste átomo é de 2 km! Verifique com um mapa local para encontrar um local nomeado que os alunos reconhecerão que está a 2 km de distância.
Outros reforços: num sólido onde os átomos estão próximos, a distância entre os núcleos adjacentes ~ o tamanho de um átomo, ou seja, o equivalente a dois alunos que estão a 4 km de distância!
Por isso é bastante surpreendente que qualquer um atinja um núcleo. Ambos têm um tamanho semelhante. Área transversal apresentada por um núcleo ~radius2, portanto ~1 × 10-28 m2}.
Ask: Como você esperaria que o número de reflexos dependesse da espessura da folha de metal que contém os núcleos alvo? (Imagine os átomos de ouro em camadas, a chance de uma deflexão aumenta com a espessura, mas a absorção no caminho de entrada ou saída da folha cada vez mais espessa irá eventualmente evitar qualquer aumento no número refletido e detectado.
É de grande ajuda se seus alunos puderem se lembrar das seguintes ordens de magnitude:
Radius do núcleo atômico ~ 10 -14m
Radius do átomo ~ 10 -10m
Perguntas aos alunos: Forças e abordagem mais próxima
Episódio 522-3: Dispersão de Rutherford: Sentidos das forças (Word, 82 KB)
Episódio 522-4: Dispersão de Rutherford: Energia e abordagem mais próxima (Word, 83 KB)
Discussão: Número atómico e a carga num núcleo
Rutherford usou os seus dados para encontrar a carga do núcleo alvo dourado. Outras experiências para encontrar a carga de Cu, Ag e Pt de folhas dadas:
| Número atómico | Uma experiência de dispersão | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | >46.3 × e |
| PT | 78 | 77,4 × e |
Então a carga eléctrica num núcleo é dada pelo número atómico × e, ou seja, Z e. Com uma excepção (hidrogénio, H-1), Z é sempre inferior ao número de massa atómica. Então o que explica a diferença? O átomo deve ser eletricamente neutro. Rutherford propôs o nêutron.
Discussão: Limite superior do tamanho nuclear
Recorde que a análise de Rutherford dá um limite superior do tamanho do núcleo (d ~ 1 α energia das partículas). O tamanho que você mede depende da energia da partícula de α que você usa. Então precisamos de outra abordagem para encontrar o tamanho de um núcleo de ouro. Você pode pensar em uma partícula melhor para sondar o tamanho de um núcleo? (O nêutron – estando descarregado, ele se aproximará.)
Outra técnica é o espalhamento profundo e inelástico dos elétrons. Consulte de volta se você já cobriu a natureza ondulatória das partículas (de Broglie waves λ = hp), ou este tópico pode ser inserido aqui, se desejado. O aparelho de difração de elétrons tem uma semelhança básica com a dispersão de partículas. Os elétrons são disparados em um filme fino – neste caso de grafite.
Rutherford teve a sorte de que o comprimento de onda de Broglie das partículas α (desconhecido para ele) era bastante pequeno, e a repulsão coulomb pára como se aproximando demais – caso contrário os efeitos de difração teriam confundido os dados! (Tente o cálculo se você já tiver coberto λ = hp.)
Episódio 506-2: Interpretando padrões de difração de elétrons (Word, 30 KB)
Episódio 522-5: Dispersão profunda inelástica (Word, 56 KB)
Episódio 522-6: Os electrões medem o tamanho dos núcleos (Word, 42 KB)
Discussão: Um puzzle para uma lição futura
Há um problema fundamental com o modelo de Rutherford. Pergunte à sua classe: Como pode um átomo com um núcleo central ser estável – porque é que não desaba? De acordo com a eletrodinâmica clássica, os elétrons devem emitir radiação enquanto orbitam, e espiralar para dentro.
(É bom deixar uma aula com um quebra-cabeça para uma lição futura.)